明小花蝽卵黄原蛋白的鉴定及表达分析
2024-09-22杜会玲王瑞娟覃冬云陈浩郭琳刘艳苏龙代晓彦赵珊郑礼董小林翟一龙


摘要:本研究对明小花蝽Orius nagaii的卵黄原蛋白(vitellogenin,vg)进行结构分析、原核表达、抗体制备以及时空动态表达分析,旨在为昆虫卵黄原蛋白的研究提供理论依据。用RACE方法克隆出OnVg基因全长,运用生物信息网站分析OnVg蛋白得出其具有3个保守结构域:脂蛋白N端结构域、未知功能结构域以及血管性血友病因子结构域。构建On Vg的原核表达载体pET-32a-c(+)-OnVg,转至大肠杆菌进行诱导表达,通过免疫昆明小鼠制备了anti-OnVg抗体。Western blot结果显示anti-OnVg抗体与OnVg蛋白能够特异性结合。qPCR检测vg基因在明小花蝽若虫、成虫阶段和成虫不同组织中的时空动态表达,结果表明vg基因在若虫阶段最低,成虫阶段表达量升高且3d时表达水平达到最高:成虫腹部表达量最高,其次是肠道和卵巢。本研究结果可为探究明小花蝽的生殖调控机理提供理论支持。
关键词:明小花蝽:卵黄原蛋白:原核表达:抗体制备;时空表达
中图分类号:S476.2:Q786 文献标识号:A 文章编号:1001-4942(2024) 08-0137-09
小花蝽(Orius spp.)属半翅目花蝽科,原产于亚洲,目前在世界各国均有分布。作为一类重要的广食性捕食性天敌昆虫,小花蝽被广泛应用于防治田间及温室中的蚜虫、蓟马、螨类等多种小型害虫以及部分鳞翅目害虫。明小花蝽(Orius nagaii)隶属小花蝽属,目前仅有少量关于其分布和内生共生菌的报道,其饲养技术、生物学、生理学及防害应用等方面还未见报道。通过室内饲养明小花蝽,发现其适应能力强、产卵量高,且易于在室内大量扩繁,极具商业化饲养潜力。
卵黄原蛋白(vitellogenin,vg)是一种脂肪体细胞蛋白,其表达受性别、组织以及生长历期调控。在雌性成虫脂肪体中,vg被特异性合成,随后经过切割、糖基化和磷酸化等一系列过程,最终释放到血腔中,通过受体介导的内吞作用被卵巢摄取,在卵巢内被进一步修饰形成并发育成卵子。雌性昆虫的生殖过程受保幼激素和蜕皮激素调控,vg是主要分子靶点,但是不同昆虫受激素调节存在差异,例如蜜蜂、果蝇受蜕皮激素调控,黏虫受保幼激素调控,而斜纹夜蛾受蜕皮激素和保幼激素共同调控。
国内有关小花蝽的报道更多是关于捕食功能反应、毒性试验、营养物质选择等领域,对其繁殖关键因子的分子生物学基础研究甚少。本研究利用转录组数据获取vg基因cDNA片段,采用RACE技术克隆明小花蝽vg基因全长,运用生物信息学网站分析明小花蝽vg蛋白基因(OnVg)结构特征,构建pET-32a-c(+)-OnVg原核表达载体,并制备蛋白特异性抗体,通过荧光定量PCR分析vg基因在明小花蝽若虫、成虫阶段,以及成虫头、胸、腹、卵巢、肠道组织中的表达模式,为进一步研究OnVg的功能及其在生殖中的作用机理奠定基础。
1 材料与方法
1.1 供试昆虫
明小花蝽来自山东省农业科学院天敌昆虫实验室,试验开始于2022年2月。饲养条件:温度(26±1)℃,湿度(60+5)%,光照周期L:D=16 h:8h,以芸豆和米蛾卵喂养。
1.2 Vg蛋白的结构分析
使用NovoPro(https: //www. novopro. cn/tools/tmhmm. html)网站的在线工具进行蛋白质信号肽预测;使用EMBL(http://smart. embl- heidelberg.de/)中的SMART程序鉴定其功能结构域:使用DNAMAN 6.0.3.99中文版翻译成氨基酸序列。
1.3 引物设计
使用Primer3Plus(https://www. primer3plus.com/index.html)网站设计引物(表1)。RACE试验委托上海植硕生物科技有限公司完成,引物由生工生物工程(上海)股份有限公司合成。
1.4 明小花蝽vg基因全长克隆
1.4.1 核心片段扩增
取约20 mg明小花蝽置于2 mL的离心管中,放于液氮中冷冻研磨,使用Tr-izol法提取总RNA。通过转录组数据,利用核心引物OnVg-f/OnVg-r(表1),对提取的总RNA进行RT-PCR。对扩增产物进行测序,按照Vazyme的phanta max fidelity DNA polymerase说明书获得核心序列。
1.4.2 5’/3 'RACE克隆基因全长
根据核心序列设计RACE引物并进行5'RACE和3'RACE。5'RACE依照5’/3'RACE Kit,2nd Generation(Roche)说明书,使用引物Vg-5' RACE -rt-r进行反转录;得到的cDNA经引物Vg-5 'RACE-rl和Oligo dT-Anchor Primer(Vial 8)进行第一轮PCR;以第一轮PCR产物为模板使用引物Vg-5' RACE-r2和PCR Anchor Primer(Vial 9)进行第二轮巢式PCR0 3'RACE依照3'Full RACE Core Kit(Taka-ra)说明书,使用Vg-3' RACE-fl引物和3'RACEOuter Primer进行第一轮PCR;以第一轮PCR产物为模板,使用引物Vg-3'RACE-f2和3'RACEControl Inner Primer进行第二轮嵌套PCR。PCR产物经纯化,送至生工进行测序,将5' RACE、核心序列及3'RACE拼接在一起,得到OnVg cDNA的全长序列。
1.5 PCR扩增
提取明小花蝽总RNA,使用PrimeScript RTreagent Kit(TaKaRa)反转录合成cDNA。以cDNA为模板进行PCR扩增,参考祝晴、李佳鹏等的扩增体系和反应程序,其中上、下游引物On-Vg-1 F/R和OnVg - 2F/R各2μL,cDNA模板1μL;反应程序:94℃预变性5 min;94℃变性30s,62℃退火30 s,72℃延伸1 min,共30-35个循环;72℃延伸10 min。PCR结束后电泳检测目的条带(960 bp)。
1.6 重组表达载体的构建
按照胶回收试剂盒(北京聚合美生物科技有限公司)的使用说明,将正确的凝胶条带回收纯化。将回收产物与pET-32a-c(+)(Novagen)载体分别用限制性内切酶BamH I(Thermo)、NotI(Thermo)进行双酶切。利用T4连接酶(TaKaRa)进行连接,构成重组表达载体,转化大肠杆菌Escherichia coli DH5α感受态细胞,涂布于含氨苄青霉素(Ampr)抗性的LB固体培养基上,于37℃培养箱培养13 - 16 h后挑取菌落。将单菌落置于1.5 mL离心管中(离心管中放人500 μL含Ampr的LB液体培养基),37℃、220 r/min摇床振荡培养12 -14 h后,送至生工生物工程(上海)股份有限公司测序,以获得含目的基因的重组载体pET-32a-c(+)-OnVg。
1.7 Vg蛋白诱导表达
取2 μL测序正确的pET-32a-c(+)-OnVg重组质粒转化到E.coli BL21感受态细胞(天根生化科技有限公司)中,培养在含Ampr的LB固体培养基上,37℃高速振荡12 -14 h后观察并挑取菌落。将单菌落悬浮于15mL离心管(离心管中放人3 mL含Ampr的LB液体培养基),37℃、220 r/min振荡培养12 - 16 h,菌液浑浊后转入100 mL液体培养基扩大培养。后续菌液OD00。值在0.6左右时,加入1mg/mL IPTG(索莱宝)进行诱导,37℃、150 r/min摇5-6 h后,8 000 r/min低温离心10- 12 min收集菌体。
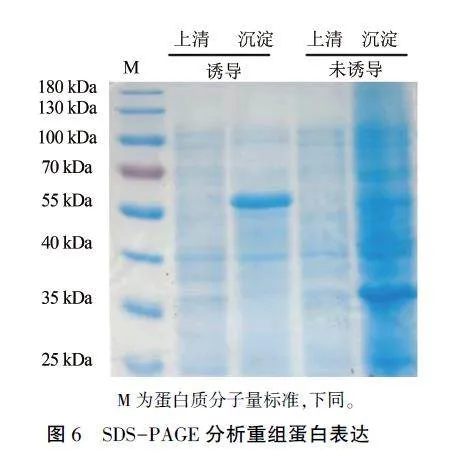
收集未诱导与诱导样品菌体,加5 mL细胞裂解液(CLB:GLPBLO为99:1),经超声波破碎,于10 000 r/min、4℃离心10- 12 min后收集上清和沉淀,1×SDS - PAGE蛋白上样缓冲液与上清1:1混合,2xSDS-PAGE蛋白上样缓冲液与沉淀按照2:1混合,振荡仪充分振荡后,于100℃沸水中变性5 min,进行聚丙烯酰氨凝胶电泳检测。检测合格后分装,- 80℃保存,用于后续的抗体制备。
1.8 Western blot
将免疫印记膜用甲醇处理约15 s,按照三明治结构方法(滤纸-PVDF膜-凝胶-滤纸),60 V或300mA转膜3h。参考祝晴、李佳鹏等的方法进行奶粉封闭、一抗和二抗孵育,使用His标签抗体和anti- OnVg血清抗体进行蛋白检测。
1.9 Vg抗体制备
将正确的重组蛋白胶条研磨,用O.go-/o生理盐水稀释。昆明小鼠提前喂养2-3 d,每只20 9左右。用1 mL针管注射300 - 400 μL稀释液到小鼠腹腔,每周注射一次,持续4周。第5周眼球取血至1.5 mL离心管,37℃水浴1h,4℃冰箱放置6h后,12 000 r/min、4℃离心13 - 15 min,取上清,置于液氮冷冻至发白状态后放入-800C冻存,或用血清加60%甘油稀释后-20℃冰箱保存。
1.10 明小花蝽卵巢蛋白提取
将羽化3d后的明小花蝽置于PBS中进行卵巢解剖,提取蛋白。研磨液制备:蛋白裂解液(RI-PA)200 μL、磷酸酶抑制剂4μL、1×蛋白酶抑制剂2 μL、100x PMSF 2μL混合在一起,所有试剂配制在冰上操作。明小花蝽卵巢(n≥40)中加入200 μL研磨液进行研磨,放人冰盒静置30min,12 000 r/min、4℃离心5- 10 min,取上清液;上清液与蛋白上样缓冲液4:1混合,100℃金属浴5min。
1.11 OnVg基因的时空表达
分别取卵、1-5龄若虫和羽化1、3、5、7、9、10d的雌成虫(n≥35),及羽化后12-24 h雌成虫的头、胸、腹、卵巢、肠道组织(n≥40)。提取总RNA,并进行反转录,而后以cDNA为模板,Actin为内参,引物见表1,使用思科捷2x SYBR GreenqPCR Mix(With ROX)试验盒检测OnVg的相对表达。qPCR反应体系20 μL:上、下游引物各0.4μL,ddH2O 6.8 μL,cDNA模板2μL(cDNA稀释10倍),2x SYBR qPCR Mix 10 μL, ROX ReferenceDyeⅡ0.4 μL。反应程序(二步法):95℃预变性20 s;90℃变性3s,60℃退火30 s,共40个循环。每个处理组进行3次生物学重复,4个技术重复。结果用2-△△Ct法计算基因的相对表达量。
1.12 数据分析
使用PASW Statistics 18软件(SPSS Inc.,Chi-cago.IL,USA)进行数据分析。
2 结果与分析
2.1 OnVg基因的核心片段及基因全长
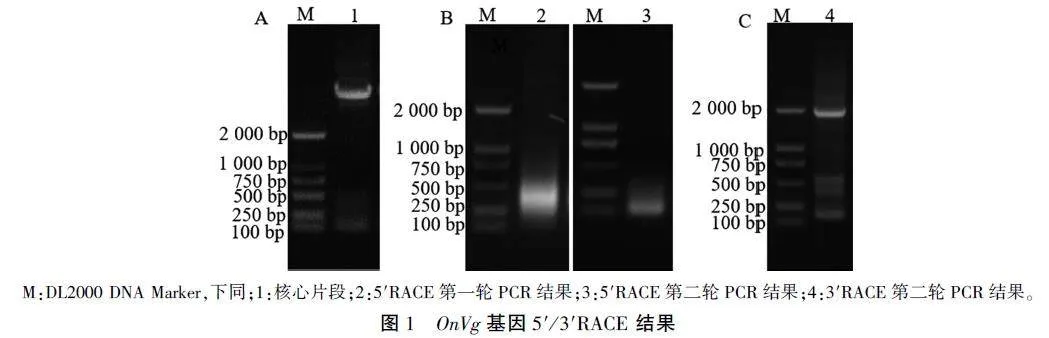
根据已知序列,设计了核心序列引物,进行核心片段扩增,开放阅读框长5 973 bp(图1A)。基因特异引物5'RACE-r1和5'RACE-r2分别与试剂盒自带引物进行第一轮、第二轮5'RACE试验。通过第一轮PCR得到了弥散条带(图IB,条带2),以第一轮PCR扩增产物为模板,进行第二轮巢式PCR,得到一条清晰的条带(图1B,条带3)。3'RACE步骤同上,进行第二轮巢式PCR,得到一条清晰的条带(图1C)。
2.2 OnVg基因序列分析
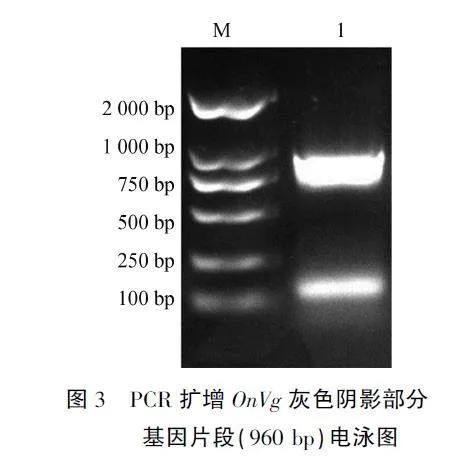
OnVg基因cDNA全长6 133 bp,其中开放阅读框长5 973 bp,翻译成1 990个氨基酸,去掉信号肽,约219.33 kDa,包含3个保守结构域:脂蛋白N端结构域(LPD_N)、未知功能结构域(un-known functuin,DUF1943)以及血管性血友病因子结构域(von Willebrand factor type D domain.vWD)。选取灰色阴影部分960 bp碱基(图2),杜会玲,等:明小花蝽卵黄原蛋白的鉴定及表达分析约32 kDa,进行PCR克隆及测序。对序列进行位点切割,切割位点RSRR将其分解成大、小两个亚基,预测大亚基为173.74 kDa,不含信号肽的小亚基为41.69 kDa。结果表明,PCR扩增序列长度正确,无突变碱基(图3)。
2.3 原核表达载体的构建和鉴定
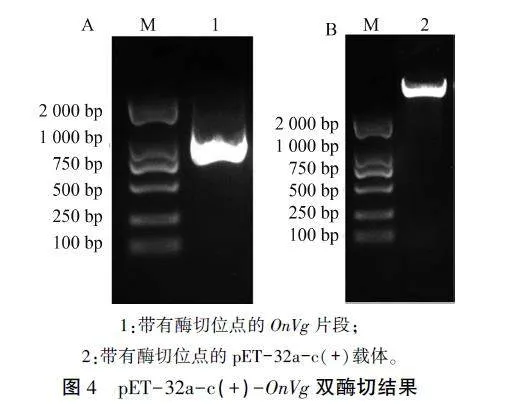
将OnVg扩增片段与pET-32a-c(+)载体经带有酶切位点的引物PCR扩增(图4),构建重组表达载体pET-32a-c(+)-OnVg。利用通用引物经PCR和双酶切鉴定,得到的片段大小基本符合预期(图5),表明载体构建成功,可用于诱导表达重组蛋白。
2.4 重组蛋白在大肠杆菌中的诱导表达
将诱导和未诱导的上清和沉淀分别进行聚丙烯酰胺蛋白电泳检测,Bradford法染色后发现,pET-32a-c(+)-OnVg的重组质粒大小在55 kDa左右(图6),为图2灰色阴影部分蛋白分子量32kDa加上载体修饰,目的蛋白主要以沉淀形式表达,在上清中表达不明显。Western blot结果(图7)显示,目的蛋白与His抗体能够很好地结合,55kDa处的条带与预期大小一致,证明重组蛋白正确表达。
2.5 抗体制备与检测
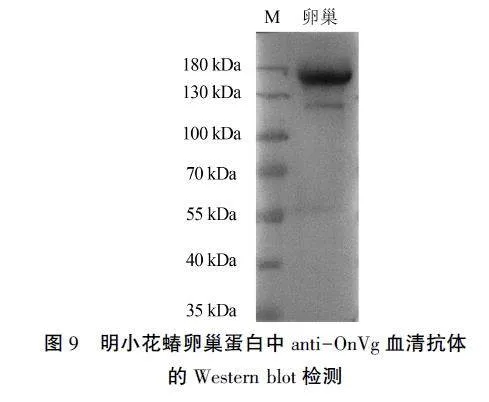
将重组蛋白经切胶研磨后配制成生理盐水稀释液,注射到昆明小鼠体内,5周后收集血清,检测血清抗体anti- OnVg。用稀释5 000倍的血清对诱导样品进行检测,结果(图8)条带单一且清晰,与预期相符,可满足免疫组化和Western blot试验的要求。用anti-OnVg血清抗体检测明小花蝽卵巢蛋白样品,结果(图9)显示,在抗体稀释5 000倍时,蛋白条带清晰,符合预测的蛋白分子量173.74 kDa。
2.6 OnVg序列时空动态表达
以Actin为内参,qPCR检测OnVg基因在明小花蝽若虫阶段、成虫阶段和雌成虫不同组织部位的动态表达模式,表明OnVg在不同发育阶段和成虫不同组织中的表达均有波动。其在成虫腹部相对表达水平最高,其次是肠道和卵巢,在胸部和头部的表达水平最低(图10A)。整个若虫阶段OnVg的表达水平较低且各阶段间无显著差异;成虫阶段表达水平变化较大,3d时达到高峰,7d时降至最低,后再次上升,但显著低于3d时(图10B)。
3 讨论与结论
卵黄原蛋白可以向胚胎提供多种营养物质,供其发育产卵,例如各种氨基酸、磷、脂质、碳水化合物、维生素等。在绝大多数昆虫中,vg是由约6 000-7 000 bp碱基编码的约220 kDa的大分子膜蛋白,大亚基(140 - 190 kDa)和小亚基(40-60 kDa) -般在分泌到血腔前被切割,大亚基往往输送至卵巢。根据氨基酸序列分析,昆虫Vg十分保守,有3个保守结构域:位于N端的卵黄原蛋白N端结构域(vitellogenin N domain,VitN)、中间区域的未知功能结构域以及位于C端的血管性血友病因子结构域:在N端有一个多聚丝氨酸区域,其具体功能尚不清楚,需要进一步研究。
通过对明小花蝽Vg基因序列的分析发现,其总长6 133 bp,编码1 990个氨基酸,去掉信号肽,分子量为219.33 kDa左右。本研究用于原核表达的Vg肽链N区是一个脂蛋白结构域,主要用于脂质运输,表达的vg重组蛋白为55 kDa左右,理论上用Vg重组蛋白免疫小鼠制备的多克隆抗体对Vg大、小亚基都应有免疫反应,但Western blot结果显示在明小花蝽雌虫卵巢中,只检测出vg的大亚基(173.74 kDa左右),在RSRR进行位点切割,结果符合预测的大亚基的蛋白分子量。相关研究表明,斜纹夜蛾Vg抗体在卵与雌性血淋巴中进行蛋白印迹分析检测出vg的大亚基;甜菜夜蛾vg多克隆抗体在雌虫血淋巴中只检测出vg的大亚基(180 kD左右);在一些高等膜翅目昆虫如日本瘤姬蜂(Pimpla nipponi-0ca)中也得到类似结果。甜菜夜蛾vg中只有编码大亚基的部分才有转录活性,而编码小亚基的部分缺失。
vg具有传统的蛋白前体功能,还与昆虫免疫反应等有关。研究表明,昆虫vg的表达在不同发育阶段具有很大差异,成虫阶段表达量最高。粘虫VgR表达量在羽化后Sd最高,黑尾叶蝉在羽化后16 d达到VgR高峰值,草地贪夜蛾vg基因表达量在成虫羽化4d达到峰值。本研究OnVg基因的表达情况与上述研究相符,都是在成虫阶段表达量最高,随着羽化时间延长,呈先上升后下降的趋势。卵巢是昆虫重要的生殖器官,具有调控生殖发育、参与免疫应答等功能。昆虫不同组织中vg的表达量存在差异,番茄潜叶蛾VgR基因在雌虫卵巢高度表达,草地贪夜蛾vg在雌虫脂肪体高度表达,大草岭雄虫vg基因在腹部的表达量较高。对组织部位的研究结果表明,OnVg基因在明小花蝽雌虫腹部高表达,其次是肠道和卵巢,进一步说明Vg与卵黄发生密切相关。下一步应着重研究Vg对明小花蝽发育的影响,探究其分子调控机制,如产卵量、羽化率、产卵前期、RNA干扰、糖代谢、脂代谢等。
本研究通过构建重组质粒并免疫小鼠,成功制备了anti-Vg血清抗体,可以特异性识别明小花蝽的vg蛋白,同时研究了OnVg基因在不同组织和发育阶段的时空表达情况,所得结果为进一步探究明小花蝽Vg的功能及生殖调控机理奠定了基础,可为明小花蝽商品化繁育提供新的途径。
基金项目:济南市农业应用技术创新项目(CX202201);山东省科技型中小企业创新能力提升工程项目(2023TSGC0709)
