离子图像类试题中变量间竞争关系的理解
2024-09-01唐磊母凌沄刘春丽


近年来水溶液中离子平衡类高考试题常以平衡体系下多变量相互关联的函数图像形式进行综合考查,属于高考压轴题.该类试题通常设定一种变量为自变量(x 轴),建立与之相关联的因变量(y 轴).因此,培养学生解答该类试题的能力可以对该类试题涉及的变量关系进行梳理及理解展开.
1 真题中变量间的竞争关系
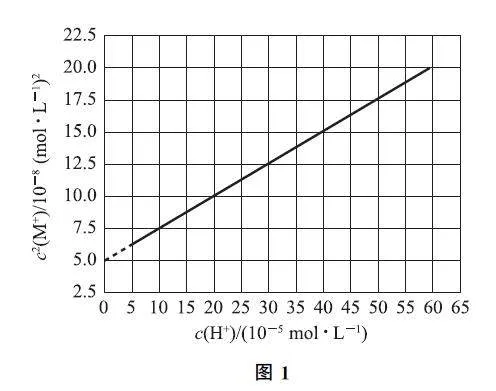
例1 (2021年全国乙卷)HA 是一元弱酸,难溶盐MA 的饱和溶液中c(M+ )随c(H+ )变化而变化,M+ 不发生水解.实验发现,298K 时c2(M+ )Gc(H+ )为线性关系,如图1中实线所示.
下列叙述错误的是( ).
A.溶液pH=4时,c(M+ )<3.0×10-4mol·L-1
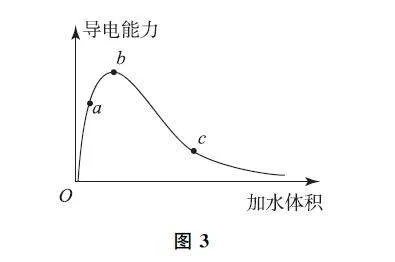
A.a、b、c3点溶液的pH:c<a<b
B.a、b、c3点CH3COOH 的电离程度:c<a<b
C.用湿润的pH 试纸测量a 处溶液的pH,测量结果偏小
D.a、b、c3点溶液用1molL-1 NaOH 溶液中和,消耗NaOH 溶液体积:c<a<b
解析
电解质溶液的导电性由自由离子的浓度和离子的电荷决定;醋酸根离子和氢离子的浓度越大,醋酸溶液导电性越强,由图可知a、b、c3点对应的溶液中氢离子浓度排序为b>a>c,pH:c>a>b,选项A 错误.
稀释促进醋酸电离,加水体积越大,醋酸的电离程度越大,故a、b、c3点醋酸电离程度为c>b>a,选项B错误.
由图可知,在醋酸体系a~b 段加水,稀释作用小于电离作用,c(H+ )随加水体积增加而增大.用湿润的pH 试纸测量a 处溶液的pH,测量结果偏小;b~c段加水,稀释作用大于电离作用,此时c(H+ )随加水体积的增大而减小.用湿润的pH 试纸测量b 处溶液的pH,测量结果偏大,选项C正确.
加水只能改变n(H+ )和n(CH3COOH)的比值,由质子守恒可知,a、b、c 3 点溶液用1 molL-1NaOH 溶液中和,消耗NaOH 溶液体积相同,选项D错误.
答案 C.
对变量竞争关系的理解 冰醋酸(无水乙酸)含有的微粒只有醋酸分子,没有可自由移动的离子;向冰醋酸中加水,溶剂水会对冰醋酸产生稀释作用和促进电离的竞争作用,导致加水过程中各离子的浓度在不同加水区间内,由于电离和稀释效应而产生差异.
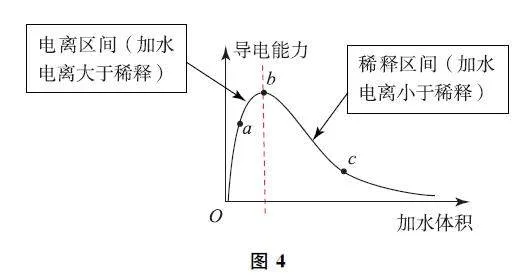
在一定温度下,冰醋酸加水体积(自变量)与溶液的导电能力(因变量)函数关系如图4所示.
变量竞争函数关系如下:
1)当加水体积为0的时候,冰醋酸(无水乙酸)中只有醋酸分子,导电能力为0.随着加水体积的增加会产生在电离区间(加水电离大于稀释)使c(H+ )增大和稀释区间(加水电离小于稀释)使c(H+ )减小的竞争.初始时(在b 点之前的电离区间)由于加水的体积很小,冰醋酸加水的电离方程式和电离平衡常数为CH3COOH+H2O⇌H3O+ +CH3COO- ,Ka=c(H3O+ )c(CH3COO- )/c(CH3COOH)c(H2O)或Ka=c(H+ )c(CH3COO- )/c(CH3COOH)c(H2O).随着加水体积的增加,即公式中c(H2O)增大,Q<K ,因此在b 点之前的电离区间内平衡向电离方向移动,进而ca (CH3COO- )<cb (CH3COO- ),ca(H+ )<cb(H+ ).
2)在b 点之前,加水使导电能力增加,说明溶液中c(H+ )浓度增大,以电离为主;在b 点之后,加水则使c(H+ )浓度减小,以稀释为主.a,b,c3点对应的溶液中,c(H+ )由小到大的顺序是c<a<b.
当加水体积超过b 点后(在b 点之后的稀释区间),当醋酸在水溶液(这里的水溶液指的是醋酸的稀溶液)中电离时,此时c(H2O)=1,冰醋酸加水的电离方程式和电离平衡常数为CH3COOH⇌H+ +CH3COO- ,Ka=c(H+ )c(CH3COO- )/c(CH3COOH) .
在超过b 点之后的稀释区间,随着加水体积的增加,cb (CH3COO- )>cc (CH3COO- ),cb (H+ )>cc(H+ ),Q<K ,平衡正向移动,越稀越电离.
3 “溶度积滴定曲线”中变量竞争关系试题的命制
例3 已知:pAg=-lgc(Ag+ ),如图5是常温下向10 mL0.1 mol·L-1 AgNO3 溶液中逐渐加入0.1mol·L-1 NaCl时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线).根据图像所得下列结论正确的是( ).[提示:Ksp(AgCl)>Ksp(AgI)]
A.常温下,Ksp(AgCl)=1.0×10-5.87
