高考中“滴定”常见题型分析
2024-09-01陈吉强


滴定是一类十分重要的实验,在每年的高考试题中都会有所涉及.这类问题考查学生对滴定知识的掌握情况,需要学生拥有较强的计算能力及理论基础.本文结合部分高考真题,对常见问题进行分类总结,以提高学生对滴定问题的掌握.
1 酸碱中和滴定
酸碱中和滴定是一种常用的化学分析方法,其核心原理是利用酸碱之间的中和反应来精确测定未知溶液的浓度.试题的已知条件可能是标准滴定溶液的浓度和待测溶液的体积,通过记录滴定过程中消耗的标准溶液体积,计算出待测溶液的浓度或含量.为了确保计算的准确性,学生要准确读取滴定管中溶液的体积,熟悉滴定终点的判断方法,细心处理每一个数据.
例1 (2021年湖南卷,节选)以NH4HCO3 和NaCl为原料制备Na2CO3,并测定某产品中NaHCO3的含量,过程如下:
① 称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中.
② 称取25.00mL上述溶液于锥形瓶中,加入2滴指示剂M,用0.1000mol·L-1盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1 mL.
③ 在上述锥形瓶中再加入2滴指示剂N,继续用0.1000mol·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2 mL.
④ 平行测定3次,V1 的平均值为22.45,V2 的平均值为23.51.
产品中NaHCO3 的质量分数为______(保留3位有效数字).
解析
由题意可知,取出的25 mL 溶液中含有Na2CO3 和NaHCO3,加入盐酸,发生反应Na2CO3 + HCl= NaHCO3 + NaCl, 用0.1000mol·L-1盐酸滴定,达到滴定终点时,溶液由红色变为无色,由此判断,指示剂M 为酚酞,消耗盐酸V1 mL;进一步加入盐酸,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,可判断指示剂N 为甲基橙,最后溶液的溶质为NaCl,此过程消耗盐酸V2 mL.
由上述分析可知,25 mL 溶液中,产品中NaHCO3 消耗的V (HCl)=V2 mL-V1 mL=23.51mL-22.45 mL = 1.06mL.因此产品中NaHCO3 的质量分数为
2 氧化还原滴定
氧化还原滴定法是一种通过氧化还原反应来测定物质含量的方法.为了准确解答相关计算,学生需要依据题意正确书写反应的化学方程式,并在此基础上进行各种计算.在氧化还原滴定中,常见的方法包括碘量法、高锰酸钾法和重铬酸钾法等.
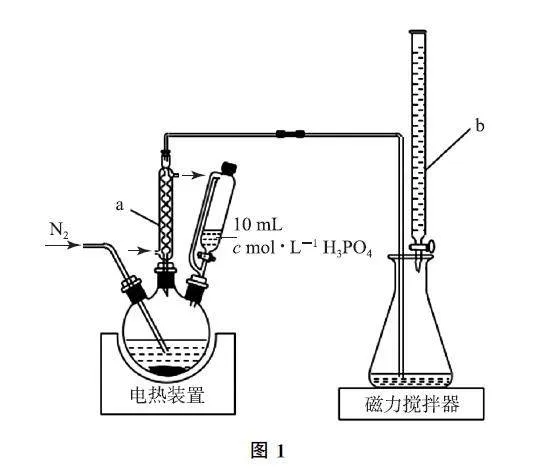
例2 (2022年河北卷,节选)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下(实验装置如图1,夹持装置未画出).
① 三颈烧瓶中加入10.00g香菇样品和400mL水;锥形瓶中加入125mL水、1mL淀粉溶液,并预加0.30mL0.01000mol·L-1的碘标准溶液,搅拌.
