例析高考中氧化还原反应常见题型
2024-09-01姚芳

氧化还原反应是高中化学十分重要的一类问题,它涉及化学反应的本质,是理解许多化学反应的关键.在高考中,氧化还原反应的考查形式多种多样,选择题、实验题和解答题中,都会出现它的身影.
1 氧化还原反应的判断
高考中氧化还原反应的判断不仅是对学生基础知识的检验,更是对他们逻辑思维能力和分析能力的考查.通过掌握判断氧化还原反应的关键要素———电子的得失或共用电子对的偏移,以及灵活运用各种辅助判断方法,如观察反应前后元素化合价的变化等,学生可以更加准确地识别氧化还原反应.
例1 (2023年全国乙卷)下列应用中涉及氧化还原反应的是( ).
A.使用明矾对水进行净化
B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热
D.荧光指示牌被照发光
解析
使用明矾净化水,其核心机制在于明矾能够发生水解反应,反应方程式为Al3+ +3H2O⇌Al(OH)3(胶体)+3H+ ,Al(OH)3胶体具有强大的吸附能力,但此过程无化合价变化,非氧化还原反应,选项A 错误.雪天在道路上撒盐是利用雪遇到盐时会降低其熔点的特性,从而使雪更容易融化,在整个过程中,元素化合价未变,非氧化还原反应,选项B错误.在暖贴中,铁粉、碳粉及氯化钠等成分接触空气后,会形成大量微小原电池,该过程中铁和氧反应过程中化合价会发生改变,为氧化还原反应,选项C正确.荧光指示牌被照发光是因为光的反射,并未发生反应,选项D错误.答案为C.
点评
氧化还原反应是化学反应中的一类重要反应,其中氧化反应和还原反应是紧密相连、相互依存的,它们共同构成了氧化还原反应的整体.在识别氧化还原反应时,我们需要注意一些特殊的反应类型,例如歧化反应.此外,还需要关注元素存在形态的变化,在化学反应中,元素由化合态变为游离态,元素化合价可能升高,也可能降低.理解氧化性和还原性的关系对于掌握氧化还原反应至关重要,强氧化剂容易得到电子,强还原剂容易失去电子,这种关系能帮助我们预测和解释氧化还原反应中的电子转移情况.
例2 (2023年浙江卷)关于反应2NH2OH+4Fe3+ =N2O↑+4Fe2+ +4H+ +H2O,下列说法正确的是( ).
A.生成1molN2O,转移4mol电子
B.NH2OH 是还原产物
C.NH2OH 既是氧化剂又是还原剂
D.若设计为原电池,Fe2+ 为负极产物
解析
可以将已知反应拆分成如下反应:2NH2OH-4e- →N2O+4H+ +H2O,4Fe3+ +4e- →4Fe2+ ,则生成1 molN2O,转移4 mol电子,选项A 正确.NH2OH 中N 元素化合价升高,被氧化,所以NH2OH 是还原剂,选项B、C 错误.若建构一个原电池,那么正极通常是得到电子的一极,Fe3+ 为氧化剂,得到电子生成Fe2+ ,故Fe2+ 为正极产物,选项D 错误.答案为A.
点评
通过电子的得失或共用电子对的偏移,氧化还原反应实现了化学物质的相互转化,这种转化不仅改变了物质的化学性质,也常常伴随着能量的变化.同时,化合价的升降是氧化还原反应的外在表现,它直观地反映了元素在反应中的氧化或还原状态.因此,深入理解电子转移和化合价升降这两个基本性质,对于掌握氧化还原反应的本质和规律,以及应用氧化还原反应解决实际问题都具有重要的指导意义.
2 化学式的书写
在高考化学中,氧化还原反应是考查学生化学知识运用能力的重点内容之一,而正确书写氧化还原反应中的化学式则是解题的关键.这些化学式不仅反映了反应物与生成物之间的关系,更揭示了氧化还原反应中电子的转移和化合价的变化.
例3 (2023年辽宁卷,节选)硫酸工业在国民经济中占有重要地位.
我国古籍记载了硫酸的制备方法———“炼石胆(CuSO4·5H2O)取精华法”.借助现代仪器分析,该制备过程中CuSO4·5H2O 分解的TG 曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如图1所示.700 ℃左右有2个吸热峰,则此时分解生成的氧化物有SO2、______和______(填化学式).
解析
图示曲线显示,700℃左右出现两个吸热峰,说明此时CuSO4 发生热分解反应,从TG 图像可知,质量减半表明有CuO 剩余,且伴随其他气体生成,此时气体产物为SO2、SO3、O2,可能出现的化学方程式为3CuSO4=700℃=3CuO +2SO2 ↑ +SO3↑+O2↑,结合反应中固体产物和气体产物的质量可以确定,该反应的产物为CuO、SO2、SO3、O2.
答案 CuO,SO3.
点评
熟练掌握氧化还原反应中化学式的书写方法和技巧,对于学生在高考中取得优异成绩至关重要.这不仅要求学生深刻理解氧化还原反应的基本原理,还要能够灵活运用化学式书写规则,准确表达反应过程中的物质转化和电子转移情况.
3 氧化还原反应的计算
在高考化学中,有关氧化还原反应的计算是检验学生综合运用知识的能力、逻辑思维能力和计算能力的重要环节.这类计算不仅涉及反应方程式的配平、化学计量关系的确定,还涵盖了氧化还原反应中电子转移数目、化合价变化等核心概念的运用.
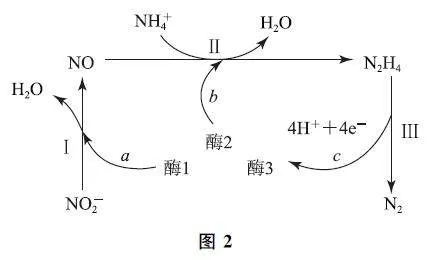
例4 (2022年湖南卷)科学家发现某些生物酶体系可以促进H+ 和e- 的转移(如a、b 和c),能将海洋中的NO- 2 转化为N2 进入大气层,反应过程如图2所示.下列说法正确的是( ).
A.过程Ⅰ中NO- 2 发生氧化反应
B.a 和b 中转移的e- 数目相等
C.过程Ⅱ中参与反应的n(NO)∶n(NH4+)=1∶4
D.过程Ⅰ→Ⅲ的总反应为NO2-+NH4+=N2↑+2H2O
解析
应过程可知,过程Ⅰ 中NO- 2 转化为NO,N 元素化合价由+3降为+2,则NO- 2发生还原反应,选项A 错误.在酶1的作用下,NO- 2转化为NO 和H2O,遵循化学反应的原则,即得失电子守恒、电荷守恒以及原子守恒,离子反应方程式为、电荷守恒以及原子守恒,离子反应方程式为NO- 2 +2H+ +e- =酶= 1NO+H2O,生成1molNO 时,a 过程中转移的电子数目为1,过程Ⅱ中,NO和 NH4+ 在酶2的作用下,生成 H2O 和N2H4,根据守恒原则,该反应的离子方程式为NO+NH4++3e-+2H+ =酶=2H2O+N2H4,在这个过程中消耗1molNO 时,转移的电子数目为3.综上分析,两个过程中转移电子数并不相等,选项B错误.由以上分析可知,过程Ⅱ中参与反应的n(NO)∶n(NH4+)=1∶1,选项C错误.过程Ⅲ的离子方程式为N2H4=酶=3N2+4H+ +4e- ,过程Ⅰ→Ⅲ的总反应为NO2-+NH4+=N2↑+2H2O,选项D正确.答案为D.
点评
在解答有关氧化还原反应的计算时,要求学生不仅要有扎实的化学理论基础,还要能够灵活运用数学计算技巧,准确处理氧化还原反应中的数量关系.
在解答氧化还原反应类试题时,熟练掌握相关定义,正确判断各物质的性质是解题基础,准确写出相应的化学反应式是解题的关键.因此,在日常学习中,学生要积极总结,不断提升自身的解题效率.
(完)
