马链球菌兽疫亚种表面蛋白FIPP的免疫效力评价
2024-08-22郭政李亚娟林永进黄坚仪巫兆如黄云飞李舜付强




摘要:【目的】评价马链球菌兽疫亚种(Streptococcus equi ssp.zooepidemicus,SEZ)表面蛋白FIPP(纤维蛋白原和Ig结合蛋白前体)的免疫效力,为预防SEZ感染提供新的候选疫苗抗原。【方法】根据NCBI数据库公布的FIPP基因序列设计引物进行PCR扩增,将扩增片段克隆到原核表达载体pCold I,并转化至大肠杆菌BL21(DE3)感受态细胞,FIPP蛋白通过IPTG诱导在大肠杆菌中表达及纯化,以SDS-PAGE进行鉴定。纯化后的重组蛋白FIPP(rFIPP)对
BALB/c小鼠进行免疫,二免14d后对小鼠进行免疫保护试验并采集血清;解剖感染SEZ小鼠的肝脏、脾脏和肺脏进行病理组织学观察。以酶联免疫吸附试验(ELISA)方法检测小鼠血清中的特异性抗体IgG水平,以蛋白质印迹(Wes-tern blotting)方法检测重组蛋白的反应原性,通过全血杀菌试验检测血清的杀菌活性。【结果】通过SDS-PAGE电泳可观察到约96kD的蛋白片段,与FIPP蛋白的理论分子量相符。重组蛋白rFIPP免疫小鼠后对SEZ攻击的保护率达70.0%。ELISA方法检测结果表明,重组蛋白rFIPP免疫小鼠后可诱导产生特异性抗体免疫球蛋白G(IgG),且极显著高于阴性对照(Plt;0.01,下同),通过IgG亚型分析,发现IgG1的抗体水平显著高于IgG2a(Plt;0.05),说明重组蛋白rFIPP免疫后产生的抗体亚型以IgG1为主。全血杀菌试验结果表明,重组蛋白rFIPP超免血清对SEZ具有极显著杀灭作用。组织病理学观察结果显示,重组蛋白rFIPP免疫后能有效减弱小鼠各类器官的病理损伤。【结论】经表达纯化的重组蛋白rFIPP在小鼠感染SEZ模型中具有良好的免疫保护效力,可用作制备SEZ亚单位疫苗的有效候选抗原。
关键词:马链球菌兽疫亚种;FIPP蛋白;免疫保护;评价
中图分类号:S852.43;S852.61文献标志码:A文章编号:2095-1191(2024)01-0263-09
Evaluation of immunogenicity of Streptococcus equi ssp. zooepidemicus surface protein FIPP
GUO Zheng',LI Ya-juan¹2,LIN Yong-jin',HUANG Jian-yi',WU Zhao-ru¹,HUANG Yun-fei¹2,LI Shun¹-2,FU Qiang¹,2
('FoshanUniversity,Foshan,Guangdong528225,China;2Foshan University Veterinary Teaching Hospital, Foshan,Guangdong528225,China)
Abstract:[Objective]This study aimed to investigate the immune efficacy of the surface protein FIPP(fibrinogen-and Ig-binding protein precursor)of Streptococcns equi ssp.zooepidemicus(SEZ)and to provide anew candidate vaccine antigen for SEZ.【Method]According to the FIPP gene sequence published in the NCBI database,the primer was de-signed for PCR amplification,and the amplified fragmentwas cloned into the prokaryotic expression vector pCold I,and then transformed into Escherichia coli BL21(DE3)receptor cells.The FIPPprotein was expressed and purified in E.coli through IPTG induction.Identification by SDS-PAGE.BALB/c mice were immunized with purified recombinant FIPP(rFIPP).14d later,the mice were immunologically protected and serum was collected.The liver,spleenand lungs of the mice infected with SEZ were dissected for histopathological observation.Enzyme-linked immunosorbent assay(ELISA)was used to detect specific antibody IgG levels in serum of mice,the reactivity of recombinant protein was detected by Western blotting analysis,and the bactericidal activity of serum was detected by whole blood bactericidal test.【Result】The protein fragments of about96kDwere observed by SDS-PAGE electrophoresis,which was consistent with the theo-retical molecular weight of FIPP protein.The protection rate of rFIPP against SEZ attack was70.0%in mice immunized with RFIPP.ELISA assay results showed that rFIPP immunized mice with hightiter specific antibody immunoglobulinG(IgG),which was extremely significantly higher than that of negative control(Plt;0.01,the same below).By IgG sub-type analysis,the antibody level of IgG1was significantly higher than that of IgG2a(Plt;0.05).These results indicated that IgG1was the main antibody subtype produced after rFIPP immunization.The results of whole blood bactericidal test showed that rFIPP superimmune serum had an extremely significant killing effect on SEZ.The histopathological observa-tion showed that rFIPP immunization could effectively reduce the pathological damage of various organs in mice.【Conclu-sion]In this study,recombinant protein rFIPP obtained by expression purification has good immunoprotectiveefficacy in amouse infecting SEZ model and can be used as avalid candidate antigen for SEZ subunit vaccine.
Key words:Streptococcus equisp.zooepidemicus;FIPP protein;immune protection;evaluation
Foundation items:National Natural Science Foundation of China(31872443);Guangdong Basic and Applied Basic Research Foundation(2022A1515140052);Guangdong Key Construction Discipline Scientific Research Capacity En-hancementProject(2022ZDJS036);Guangdong Postgraduate Education Innovation Plan Project(2022JGXM128)
0引言
【研究意义】马链球菌兽疫亚种(Streptococcus equi ssp.zooepidemicus,SEZ)属于兰氏分群的C群链球菌,可引起猪、马和牛等多种哺乳动物呼吸道感染、败血症、脑膜炎、心内膜炎和关节炎(Gruszynski et al.,2015;Madžar et al.,2015;Lin et al.,2022)。SEZ是猪链球菌病(Streptococcus suis diseases)的主要病原体之一,具有高传染性和高致死率,已导致我国养殖业巨大经济损失(Liang et al.,2018)。SEZ感染人类(人类接触感染SEZ的动物或污染SEZ的食物)则严重威胁公共卫生健康(耿建新等,2007;Kerdsin et al.,2022)。抗生素疗法是治疗猪链球菌病的主要方法,但抗生素滥用会产生耐药性和增加抗生素在动物产品中残留(Hulting et al.,2009;Tang et al.,2015;Baracco,2019)。使用灭活疫苗或弱毒疫苗预防猪链球菌病可减少使用抗生素治疗的频率,但现有的弱毒疫苗和灭活疫苗安全性低、免疫效力弱(Boyle et al.,2018;Lee et al.,2021;Hau et al.,2022)。纤维蛋白原和Ig结合蛋白前体(FIPP)是SEZ的重要表面蛋白,与化脓性链球菌的Spa蛋白具有一定同源性,理论上可作为预防SEZ的候选疫苗抗原,而重组蛋白Spa可引起机体保护性免疫反应并产生保护性抗体,是一种重要的候选疫苗抗原(Ahmed et al.,2010),但目前对FIPP蛋白在SEZ感染中的作用及引起机体保护性免疫反应的了解甚少。因此,评价FIPP蛋白的免疫原性和抗原性,对制备安全有效的新型疫苗抵御SEZ感染具有重要意义。【前人研究进展】细菌在机体内存活通常与其表面蛋白有关,典型的细菌表面蛋白具有参与细菌黏附、免疫逃避或维持细胞生长等重要功能(Mitchell and Mitchell,2010)。纤连蛋白结合蛋白通过机体纤连蛋白与弹性蛋白结合产生黏附作用,有助于菌体侵袭并扩散(Keane et al.,2007;徐全圆等,2015)。Valentin等(1990)、Godehardt等(2004)研究发现,a₂巨球蛋白与链球菌表面的IgG结合蛋白(EAG)结合,通过抑制IgG的调理和吞噬作用引起免疫逃避。内肽酶O通过与补体蛋白结合可进行免疫逃避,且能促进对脑微血管内皮细胞的黏附侵袭,增强穿透血脑屏障能力(Agarwal et al.,2014;Zhou etal.,2021;尚天甜等,2022)。SEZ具有许多分泌因子和细胞表面相关因子,在宿主—病原体的相互作用间发挥关键作用,可作为重要的免疫靶点。毒力因子M蛋白(Hulting et al.,2009;Lin et al.,2011)、纤维蛋白原结合蛋白(Mechan et al.,2009;Yi et al.,2013)和内肽酶O(尚天甜等,2022)等已被证实在SEZ侵入宿主过程中发挥重要作用,其中M蛋白和纤维蛋白原结合蛋白还可为诱导高水平特异性抗体提供保护作用,能作为亚单位疫苗用于抵御SEZ感染(Lann-ergard et al.,2005;Lin et al.,2011)。Xie等(2018)研究证实,SeseC_01411蛋白位于SEZ表面且在免疫小鼠后可引起高滴度免疫应答,针对SeseC_01411蛋白的超免血清能有效降低细菌存活率。此外,邵俊高等(2016)通过诱导表达马链球菌马亚种EAG重组蛋白,证实表达的EAG蛋白具有良好抗原性,可有效提高体液免疫水平及保护力。【本研究切入点】迄今,已证实有少数SEZ表面蛋白能制备具有保护作用的亚单位疫苗,但以FIPP蛋白作为预防SEZ候选疫苗抗原的研究鲜见报道。【拟解决的关键问题】通过原核表达并纯化重组蛋白FIPP(rFIPP),评估其免疫原性和抗原性,为鉴定FIPP蛋白在小鼠模型中对SEZ感染的潜在保护效果及制备安全有效的新型疫苗抵御SEZ感染提供参考依据。
1材料与方法
1.1试验材料
1.1.1试验动物6~8周龄雌性无特定病原体(SPF)BALB/c小鼠(体质量18.0~20.0g)购自广东省医学实验动物中心。试验前观察1周,自由采食SPF级维持鼠料(广东省医学实验动物中心)。动物试验由广东省实验动物监测委员会批准(批准号:SYXK〔粤〕2019-0136)。
1.1.2引物设计与合成根据NCBI已公布的FIPP基因序列,使用Primer5.0设计引物,并在引物两端添加BamH I、SalI酶切位点和保护碱基,引物序列:FIPP-F:5'-CGCGGATCCGAGGAAAATTTCG A-3',FIPP-R:5'-ACGC GTCGACATCTTTTTGACGT TT-3'。引物由生工生物工程(上海)有限公司合成。1.1.3细菌培养及主要试剂SEZ C55138菌株和表达质粒pColdI均由佛山科学技术学院432实验室保存提供,使用胰蛋白胨大豆琼脂(TSA)或胰蛋白胨大豆肉汤(TSB)在37℃恒温培养箱培育。大肠杆菌菌株DH5α和BL21(DE3)在含有氨苄青霉素(100.0mg/L)的LB培养基中培养。细菌基因组DNA提取试剂盒购自艾科瑞生物工程有限公司,质粒小提试剂盒和琼脂糖凝胶DNA回收试剂盒均购自天根生化科技有限公司,Ampicillin和IPTG购自Genview公司,溶菌酶(Lysozyme)和His标签蛋白纯化试剂盒(耐变性剂型)均购自碧云天生物技术有限公司,10×酶联免疫吸附(ELISA)包被液、ELISA终止液和Goat Anti-Mouse IgG/HRP均购自北京索莱宝科技有限公司,水性疫苗佐剂Montanide Gel01PR购自Seppic公司,DNA Marker、Premix Taq酶、Sal I和BamH I限制性内切酶、DNA Ligation Kit Ver.2.1(Solution I)及10×QuickCut Green Buffer均购自宝日医生物技术(北京)有限公司,Protein Marker购自Vazyme公司。
1.2试验方法
1.2.1重组质粒pCold I-FIPP原核表达载体构建与鉴定按照细菌基因组DNA提取试剂盒说明提取SEZ C55138菌株基因组DNA,通过PCR扩增FIPP基因的DNA片段。扩增产物以1.0%琼脂糖凝胶电泳进行鉴定,切取目的条带所在位置的胶条,使用琼脂糖凝胶DNA回收试剂盒获得目的片段。表达载体pCold I经BamH I和Sal I双酶切后连接PCR产物构建重组质粒pCold I-FIPP,连接产物转化至大肠杆菌DH5α感受态细胞,在LBAmp+固体培养基中过夜培养,挑取单菌落接种于LBAm+液体培养基培养8h。使用质粒小提试剂盒提取重组质粒,通过双酶切进行重组质粒鉴定,将携带FIPP基因的质粒命名为pFIPP。
1.2.2FIPP重组蛋白表达及纯化将重组质粒
pFIPP转化到大肠杆菌BL21(DE3)感受态细胞,经LBAmp+液体培养基在37℃、220r/min条件下振荡培养至D60为0.6~0.8,添加1.0mmol/L IPTG,在18℃、180r/min条件下低温诱导18h。使用4℃预冷的离心机5000r/min离心15min,弃上清液,1.0g菌体加入4.0mL非变性裂解液,加入溶菌酶使其终浓度为1.0g/L。使用超声破碎仪裂解后,对细菌裂解物以10000r/min离心20min,收集上清液和沉淀,通过SDS-PAGE检测可溶性蛋白和包涵体蛋白的表达情况,通过His标签蛋白纯化试剂盒纯化可溶性蛋白,使用BCA法测定蛋白浓度。将诱导前和诱导后的菌体及纯化后的重组蛋白进行SDS-PAGE检测。纯化后的重组蛋白FIPP命名为rFIPP。
1.2.3蛋白质印迹(Western blotting)分析重组蛋白
反应原性对纯化后的重组蛋白rFIPP和BL21全菌蛋白进行SDS-PAGE电泳,将电泳后的凝胶转印至PVDF膜,在含5%脱脂奶粉的TBST中封闭1h。分别用灭活SEZ免疫后的小鼠血清和阴性血清为第一抗体,以山羊抗小鼠IgG HRP为第二抗体,于37℃培养箱孵育1h,使用ECL超敏发光显影液进行显影分析。
1.2.4小鼠免疫和攻毒将30只SPF级BALB/c小鼠(6周龄雌性)随机平均分成3组,第1组用50.0μg纯化的重组蛋白rFIPP与Montanide Gel01PR佐剂乳化进行免疫(简称重组蛋白rFIPP免疫),第2组小鼠接种经Montanide Gel01PR佐剂乳化的等体积灭活SEZ C55138菌株(2×10⁸CFU/mL)作为阳性对照,第3组接种经MontanideGel01PR佐剂乳化的等体积PBS作为阴性对照。所有小鼠均采用腹腔注射进行免疫,14d后进行二次免疫,二免后14d通过尾静脉采血分离血清。参考SEZ攻毒条件(Xu et al.,2022),每组小鼠均通过腹腔注射1×10⁶CFU SEZ C55138菌株0.5mL,连续观察记录14d,计算各组小鼠的存活率。当小鼠出现毛发皱褶、反应迟缓和极度嗜睡等临床症状时,视作死亡。
1.2.5酶联免疫吸附(ELISA)试验使用纯化的重组蛋白rFIPP(4.0mg/L)包被ELISA滴定板。重组蛋白rFIPP用ELISA包被液稀释后4℃过夜,用含0.05%吐温-20的PBS(PBST)洗涤3次后,每孔加入300.0μL含5%牛血清白蛋白的PBS(PBS-BSA)37℃封闭2h,然后用PBST洗涤3次。添加100.0μL小鼠抗重组蛋白rFIPP血清(1:400)为一抗,在37℃下孵育1h。添加1:250山羊抗小鼠IgG HRP抗体为二抗。为了测量IgG亚型,添加1:100稀释度的IgG1HRP和IgG2a HRP。洗涤3次后,添加TMB底物显色,添加50.0μL ELISA终止液停止反应,随后使用酶标仪在450nm处读板。
1.2.6全血杀菌试验通过体外杀菌试验评估小鼠抗重组蛋白rFIPP血清的杀菌活性(Voyich et al.,2009)。无菌抗凝采集3只健康BALB/c小鼠全血,将SEZ培养至对数期,菌液浓度调整为10'CFU/mL。
800.0μL健康小鼠抗凝全血与100.0μL抗重组蛋白rFIPP血清混合,以免疫前血清与抗凝全血混合为阴性对照。向混合物中加入100.0μL细菌悬液,在37℃下孵育90min,随后进行细菌计数以计算各组细菌的存活率,评估抗重组蛋白rFIPP血清的杀菌活性。
1.2.7病理组织学观察在加强免疫14d后,通过腹腔注射1×10⁶CFU SEZ至小鼠体内。在感染24h后对小鼠进行剖检,在无菌条件下切除每组小鼠(n=3)的肝脏、脾脏和肺脏,用多聚甲醛固定液固定,制作石蜡切片并进行HE染色,在显微镜下进行组织学观察。
1.3统计分析
试验数据使用GraphPad Prism8.0进行统计,Adobe Photoshop CC2018制图,以t检验法进行差异显著性分析。
2结果与分析
2.1重组质粒pCold I-FIPP的构建与鉴定
以SEZ C55138菌株基因组DNA为模板,通过PCR扩增的FIPP基因产物经电泳后大小约1000bp,与理论值大小(1110bp)相符(图1-A)。经BamH I和Sal I双酶切连接到pCold I载体中,提取重组质粒pCold I-FIPP通过双酶切进行鉴定。与对照组质粒相比,重组质粒中可看到大小约1000bp的片段,与预期结果(1110bp)一致,说明已将目的基因成功连接到表达载体pCold I(图1-B)。
2.2重组蛋白FIPP的表达及纯化
将成功构建的重组质粒pCold I-FIPP转化至大肠杆菌BL21(DE3)感受态细胞,通过IPTG18℃诱导18h表达,以SDS-PAGE检测重组蛋白FIPP的表达情况。与诱导前相比,诱导后菌体出现的蛋白分子量约96kD,与预期相符,说明蛋白成功表达(图2-A)。诱导后的蛋白在沉淀和上清液中均能表达,使用His标签蛋白纯化试剂盒纯化可溶性蛋白,并以SDS-PAGE进行检测,可看到纯化后条带单一的目的蛋白(图2-B)。
2.3重组蛋白反应原性的Western blotting分析
对重组蛋白和BL21全菌蛋白进行SDS-PAGE电泳,以灭活SEZ免疫后小鼠血清(阳性血清)和PBS免疫小鼠血清(阴性血清)为一抗,以山羊抗鼠IgG HRP为二抗,进行Western blotting检测。从图3可看出,在阳性血清孵育下重组蛋白rFIPP有一条清晰条带,而阴性血清孵育下无条带,说明纯化后的重组蛋白rFIPP在阳性血清孵育下可发生特异性反应,而BL21全菌蛋白因不含特异性抗原不能与阳性血清和阴性血清相结合。
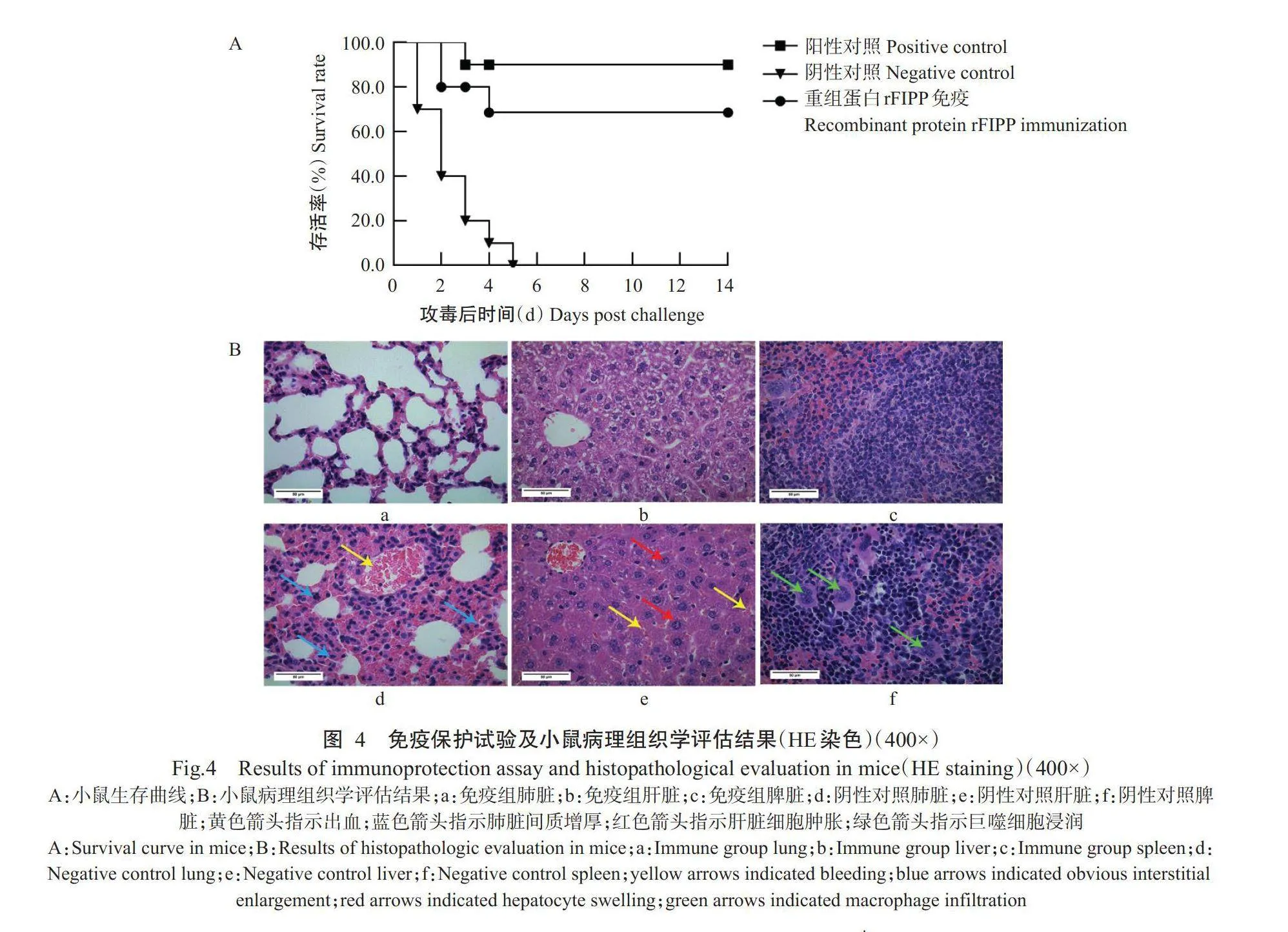
2.4重组蛋白rFIPP免疫保护试验及小鼠组织病理学评估
对二免14d后的小鼠腹腔注射1×10°CFU SEZ,评估各组小鼠的生存情况。其中,阴性对照的小鼠表现毛发皱褶、反应迟缓,并在5d内相继死亡;阳性对照的小鼠在感染3d时有1只死亡,其余小鼠表现轻微的临床症状并存活;重组蛋白rFIPP免疫的小鼠在4d内有3只死亡,其余小鼠表现轻微临床症状,试验结束时70.0%小鼠存活(图4-A)。接种SEZ后24h,解剖重组蛋白rFIPP免疫小鼠和阴性对照小鼠的肝脏、脾脏和肺脏,进行组织病理学评估,从图4-B可看出,阴性对照的小鼠在使用SEZ C55138菌株攻击后,其脾脏充血出血,大量巨噬细胞募集;肺脏呈肺间质增厚、明显出血;肝脏出现肝细胞肿胀。相比于阴性对照小鼠,重组蛋白rFIPP免疫的小鼠在组织病理学检查中未发现明显病变。说明SEZ引起的器官损伤程度在重组蛋白rFIPP免疫后有所减轻。
2.5FIPP抗体水平检测
在加强免疫后的第14d,采用间接ELISA方法检测小鼠血清中的FIPP抗体水平。从图5-A可看出,与阴性对照相比,重组蛋白rFIPP免疫小鼠的特异性IgG抗体水平极显著提高(Plt;0.01,下同);进一步检测IgG1和IgG2a亚型,发现小鼠的IgG1应答显著高于IgG2a应答(Plt;0.05)(图5-B)。说明免疫应答的类型主要为体液免疫。
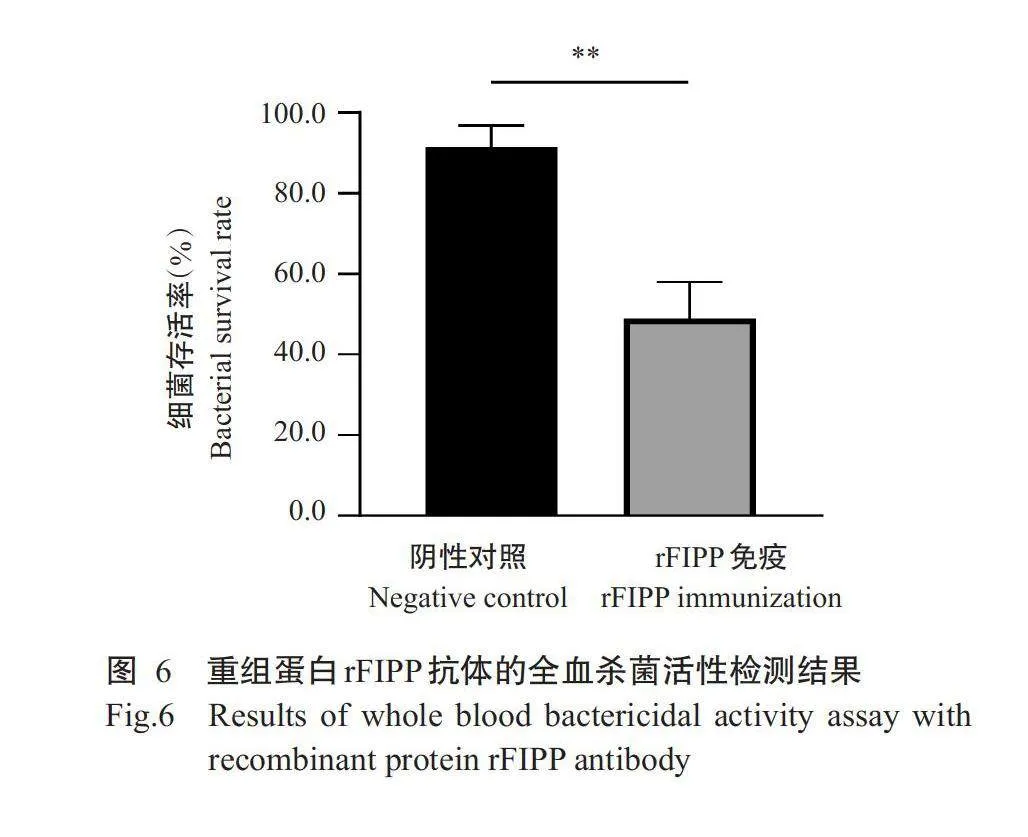
2.6全血杀菌试验结果
为验证rFIPP抗体是否具有杀菌活性,通过体外杀菌试验测试SEZ在抗rFIPP或阴性对照血清孵育的肝素化抗凝小鼠血液中的存活率。从图6可看出,在无特异性抗体的情况下,约有91.4%的SEZ存活,在重组蛋白rFIPP的超免疫血清中,仅有48.9%的SEZ存活,说明rFIPP抗体杀灭SEZ的能力极显著提高。
3讨论
目前,SEZ仍是我国猪链球菌病的主要病原体之一,随着养殖企业养殖规模的不断扩大,该病造成的危害日益严重(徐宇萌等,2023)。临床上常用青霉素、四环素和磺胺类药物等治疗马链球菌病,但大多数马链球菌菌株已对至少1种抗生素产生耐药性,其中,对青霉素的耐药性有所增加(张泽华等,2021;Lord et al.,2022;孙琼飞等,2023)。传统的预防猪链球菌病灭活疫苗和弱毒疫苗均存在明显缺陷,其中,灭活疫苗存在大量无效成分,会引起过多非特异性免疫应答,常需高剂量多次免疫;弱毒疫苗虽有较高的免疫原性,但可能存在毒力返强风险。因此,筛选出更多保护性抗原是有效防控SEZ的重要手段。亚单位疫苗是通过成熟DNA重组技术将抗原基因导入特定受体、合成和提纯具有免疫原性蛋白所制成的一种新型疫苗(Liet al.,2020),因含有明显的抗原识别成分,可避免过多无关抗原对机体的免疫刺激,提高机体免疫潜力,降低疫苗产生不良反应的可能性,适合免疫功能弱的个体使用。汪梦竹等(2022)研究表明,亚单位疫苗具有安全、不易引发感染及适合大规模生产等优点。此外,Timoney等(2007)、Mitchell和Mitchell(2010)、Wei等(2013)研究发现,细菌表面蛋白功能极多,且参与细菌黏附或抵抗宿主吞噬,随着对毒力因子研究的不断深入,许多表面蛋白被确认为潜在毒力因子,可作为有潜力的疫苗候选抗原利用。为开发更有效的亚单位疫苗,国内外诸多学者对潜在的毒力蛋白进行了研究。Hulting等(2009)研究发现,马链球菌的IgG内肽酶IdeE和IdeE2在小鼠模型中均能产生抗体,可有效防止感染马链球菌导致的体重下降。Guss等(2009)、Chen等(2021)利用多组分蛋白分别对健康威尔士山地矮种马和健康BALB/c小鼠进行免疫,使得其对预防马链球菌感染的能力显著提高。Lin等(2011)将SEZ的类M蛋白(SZP)插入猪瘟病毒中进行共表达,证实SZP对SEZ感染具有显著保护作用。Yi等(2016)鉴定一种参与SEZ生物膜形成的蛋白GroEL,可有效刺激免疫反应,防止SEZ感染。本研究中,FIPP蛋白具有典型的LPXTG样基序信号,定位于细胞表面,可能是SEZ潜在的毒力因子,而Ahmed等(2010)研究表明,FIPP蛋白与化脓性链球菌的Spa蛋白具有76.0%的同源性,Spa蛋白能诱发产生保护性抗体抵御化脓性链球菌感染,对进一步探究FIPP蛋白作为疫苗候选抗原的潜力意义重大。
本研究中,将FIPP基因插入原核表达载体pCold I,通过原核表达技术成功纯化重组蛋白rFIPP,经Montanide Gel01PR佐剂乳化的重组蛋白rFIPP抗原对SEZ的攻毒具有保护作用,重组蛋白rFIPP免疫的小鼠对SEZ C55138菌株感染具有70.0%的保护作用,而阴性对照的小鼠全部死亡;与SEZ灭活疫苗相比,重组蛋白rFIPP抗原的保护作用相对较弱,但仍表明FIPP蛋白可作为一种良好的保护抗原;采集小鼠的器官进行组织病理学观察,发现重组蛋白rFIPP免疫可减轻小鼠各脏器受SEZ感染引起的损伤;ELISA检验结果显示,重组蛋白rFIPP免疫小鼠的特异性抗体水平极显著高于阴性对照;进一步检测IgG1和IgG2a亚型发现小鼠的IgG1应答显著高于IgG2a应答,而IgG2a与Th1-反应相关,IgG1与Th2-反应相关,表明重组蛋白rFIPP可诱导Th1-/Th2-免疫显著应答;重组蛋白rFIPP能与SEZ阳性血清结合,说明其具有良好的反应原性;体外全血杀菌试验结果证实,与阴性血清相比,FIPP抗体在全血环境中可明显杀灭SEZ。由此可见,FIPP蛋白可能在SEZ感染中发挥关键作用,在小鼠的主动免疫中,对SEZ感染具有显著保护作用。因此,重组蛋白rFIPP可作为一种有效的SEZ亚单位疫苗候选抗原使用。
4结论
利用通过原核表达技术成功表达纯化的重组蛋白rFIPP免疫BALB/c小鼠,对预防SEZ感染具有显著保护作用,可减轻BALB/c小鼠各脏器病理损伤,并诱导小鼠产生特异性IgG抗体,针对重组蛋白rFIPP的血清能有效降低SEZ存活率。因此,重组蛋白rFIPP可作为制备有效SEZ亚单位疫苗的候选抗原应用。
参考文献:
耿建新,陆承平,范红结.2007.马链球菌兽疫亚种10株国内猪源分离株对小鼠免疫效力的评价[J].中国人兽共患病学报,23(2):201-204.[Geng JX,Lu CP,Fan HJ.2007.Evaluation on the immunization potency of10strains of"Sreptococcusequi subsp.zooepidemicus of pig-orgin iso-lated in China[J].Chinese Journal of Zoonoses,23(2):201-204.]
尚天甜,彭婕,鲁强生,刘旭明,曾巧英.2022.内肽酶O对马链球菌兽疫亚种突破血脑屏障的影响[J].中国兽医学报,42(10):2022-2030.[Shang TT,Peng J,LuQ S,Liu XM,Zeng QY.2022.Role of endopeptidase Oon the breakthrough of the blood-brain barrier of Sirep-tococcus"equi ssp.zooepidemicns[J].Chinese Journal of Veterinary"Science,42(10):2022-2030.]doi:10.16303/j.cnki.1005-4545.2022.10.15.
邵俊高,姜慧娇,常建新,张宝江,李善春,苏艳.2016.马链球菌马亚种IgG结合蛋白的原核表达和免疫原性[J].生物工程学报,32(5):577-583.[Shao JG,Jiang HJ,Chang JX,Zhang BJ,LiS C,Su Y.2016.Prokaryotic expression and immunogenicity of IgG-binding protein of Streptococ-cs equi subspecies equi[J].Chinese Journal of Biotech-nology,32(5):577-583.]doi:10.13345/j.cjb.150405.
孙琼飞,张家瑞,屈勇刚,梁晏.2023.1株豚鼠源马链球菌兽疫亚种的分离鉴定与耐药性分析[J].中国兽医学报,43(5):993-997.[Sun QF,Zhang JR,Qu YG,Liang Y2023.Isolation and identification of aSreptococws equi subspecies of guinea pig origin and analysis of drug resis-tance[J].Chinese Journal of Veterinary Science,43(5):993-997.]doi:10.16303/j.cnki.1005-4545.2023.05.21.
汪梦竹,蒲飞洋,赵泽阳,冯茜莉,李易聪,王慧慧,马忠仁,李倬.2022.新型疫苗的研究进展[J].畜牧与兽医,54(9):141-147.[Wang MZ,Pu FY,Zhao ZY,Feng XL,LiY C,Wang HH,Ma ZR,Li Z.2022.Advances in develop ment of novel types of vaccines[J].Animal Husbandryamp;Veterinary Medicine,54(9):141-147.]
徐全圆,石明,杨夷平,李娜,刘建华,加尔肯,冉多良.2015.马链球菌马亚种FNEB蛋白的截短表达及其免疫保护性研究[J].中国预防兽医学报,37(2):132-135.[XuQY,Shi M,Yang YP,LiN,Liu JH,Jia EK,Ran DL.2015.Expression and immunogenicity identification on trun-cated FNEB protein of Streptococcus equi subsp.equi[J].ChineseJournal of Preventive VeterinaryMedicine,37(2):"132-135.]doi:10.3969/j.issn.1008-0589.2015.02.12.
徐宇萌,郭政,李亚娟,邓静飞,何颍欣,黄云飞,付强.2023.马链球菌兽疫亚种SclE蛋白原核表达及其免疫效力评价[J].南方农业学报,54(8):2465-2473.[Xu YM,Guo Z,LiY J,Deng JF,He YX,HuangYF,FuQ.2023.Pro-karyotic expression of SclE protein from Streptococcus equi ssp.zooepidemics and evaluationon its immune effi-cacy[J].Journal of Southern Agriculture,54(8):2465-2473.]doi:10.3969/j.issn,2095-1191.2023.08.028.
张泽华,张欢,汪丽,古丽米热·对山巴依,吕芬芬,蒲小峰,张宝江,苏艳.2021.马源马链球菌兽疫亚种3株新疆分离株基因型的鉴定及MLST分析[J].微生物学通报,48(12):4742-4755.[Zhang ZH,Zhang H,Wang L,Guli-mire D,LüFF,Pu XF,Zhang BJ,SuY.2021.Identifica-tion and MLST analysis of three novel genotypes of Strep-tococcns equi subsp.zooepidemicus Xinjiang strains[J]"Microbiology China,48(12):4742-4755.]doi:10.13344/j.microbiol.china.210337.
Agarwal V,Sroka M,Fulde M,Bergmann S,Riesbeck K,Blom"A M.2014.Binding of Streptococcus pneumomiae endo-peptidase O(PepO)to complement component Clq modu-lates the complement attack and promotes host cell adhere-nce[J].The Journal of Biological Chemistry,289(22):15833-15844.doi:10.1074/jbc.M113.530212.
Ahmed EA,Penfound TA,Brewer SC,Tennant PA,Chiang EY,Dale JB.2010.Streptococcal protective antigens(Spa):A new family of type-specific proteins of group Astrepto cocci[J].European Journal of Clinical Microbiologyamp;Infectious Diseases,29(1):51-57.doi:10.1007/s10096-009-0819-0.
Baracco GJ.2019.Infections caused by group Cand Gstrepto-coccus(Sreptococcus dysgalactiae subsp.equisimilis and"Others):Epidemiological and clinical aspects[J].Micro-biology Spectrum,7(2):10.1128.doi:10.1128/microbiol-spec.GPP3-0016-2018.
Boyle AG,Timoney JF,Newton JR,Hines MT,Waller AS,Buchanan BR.2018.Streptococcs equi infections in horses:Guidelines for treatment,control,and prevention of strangles-revised consensus statement[J].Journal of Ve-terinary Internal Medicine,32(2):633-647.doi:10.1111/jvim.15043.
Chen X,Zhao Y,Su L,Wang L,Ma X,Zhang B,Su Y.2021.Enhanced immune effects and protection conferred by simultaneously targeting GAPDH,SeM,and EAG of Sequivia TLR4[J].Research inVeterinary Science,138:100-108.doi:10.1016/j.rvsc.2021.06.001.
Godehardt AW,Hammerschmidt S,Frank R,Chhatwal GS.2004.Binding of a₂-macroglobulin to GRAB(protein G-related α₂-macroglobulin-binding protein),an important virulence factor of group Astreptococci,is mediated by twocharged motifs in the Delta Aregion[J].The Biochemi-cal Journal,381:877-885.
Gruszynski K,Young A,Levine SJ,Garvin JP,Brown S,Turner L,Fritzinger A,Gertz RE,Murphy JM,Vogt M,"Beall B.2015.Streptococcus equi subsp.zooepidemicus"infections associated with Guineapigs[J].Emerging Infec-tious Diseases,21(1):156-158.doi:10.3201/eid2101.140640.
Guss B,Flock M,FrykbergL,Waller AS,Robinson C,Smith KC,Flock JI.2009.Getting to grips with strangles:An effective multi-component recombinant vaccine for the protection of horses from Streptococcus equi infection[J]PLoS Pathogens,5(9):e1000584.doi:10.1371journal ppat.1000584.
Hau SJ,Buckley A,Brockmeier SL.2022.Bacterin vaccina-tion provides insufficient protection against Sreptococcus"equi subspecies zooepidemicus infection in pigs[J].Fron-tiers in Veterinary Science,9:827082.doi:10.3389/fvets."2022.827082.
Hulting G,Flock M,Frykberg L,Lannergard J,Flock JI,Guss"B.2009.Two novel IgG endopeptidases of Streptococcus equi[J].FEMS MicrobiologyLetters,298(1):44-50.doi:10.1111/j.1574-6968.2009.01698.x.
Keane FM,Loughman A,ValtulinaV,Brennan M,Speziale P,Foster TJ.2007.Fibrinogen and elastin bind to thesame region within the Adomain of fibronectin binding protein"A,an MSCRAMM of Staphylococcus areus[J].Molecu-larMicrobiology,63(3):711-723.doi:10.1111j.1365-2958.2006.05552.x.
Kerdsin A,Chopjitt P,Hatrongjit R,Boueroy P,Gottschalk M.2022.Zoonotic infection and clonal dissemination of Strep-"tococcus equi subspecies zooepidemicus sequence type"194isolated from humans in Thailand[J].Transboundary and Emerging Diseases,69(4):e554-e565.doi:10.1111/tbed.14331.
Lannergard J,Flock M,Johansson S,Flock JI,Guss B.2005.Studies of fibronectin-binding proteins of Sreptococcus equi[J].Infect Immun,73(11):7243-7251.doi:10.1128/IAI.73.11.7243-7251.2005.
Lee H,Yun SH,HyonJY,Lee S,YiY,Choi C,Jun S,Park EC,Kim SI.2021.Streptococcus equi-derived extracellular vesicles as avaccine candidate against Streptococcus equi infection[J].Veterinary Microbiology,259:109165.doi:10.1016/j.vetmic.2021.109165.
LiZ,Ma Z,LiY,Gao S,Xiao S.2020.Porcine epidemic diar-rheavirus:Molecular mechanisms of attenuation and vac-cines[J].Microbial pathogenesis,149:104553.doi:10.1016/j.micpath.2020.104553.
Liang H,Tang B,Zhao P,Deng M,Yan LL,Zhai P,WeiZ G2018.Identification and characterization of anovel protec tive antigen,Sec_205of Streptococcusequi ssp.Zooepi-demicus[J].Vaccine,36(6):788-793.doi:10.1016/j.vac-cine.2017.12.072.
Lin HX,Huang DY,Wang Y,Lu C,Fan H.2011.A novel vac-cine against Streptococcus equi ssp.zooepidemicus infec-tions:The recombinant swinepox virus expressing M-like protein[J].Vaccine,29(40):7027-7034.doi:10.1016j.vaccine.2011.07.074.
Lin ZH,Xia Y,Guo JF,Xu G,Liu Y,Yang Y,Xie H,Huang Y,Fu Q.2022.Caspase-1deficiency impairs neutrophils recruitment and bacterial clearance in Streptococcus equi ssp.zooepidemicus infected mice[J].Veterinary Microbiol-ogy,268:109411.doi:10.1016j.vetmic.2022.109411.
Lord J,Carter C,Smith J,Locke S,Phillips E,Odoi A.2022.Antimicrobial resistanceamong Sreptococcus equi subspe-cies zooepidemicus and Rhodococcusequi isolated from"equine specimens submitted to adiagnostic laboratory in Kentucky,USA[J].Peerj,10:e13682.doi:10.7717/peerj.13682.
Madžar D,Hagge M,Möller S,Regensburger M,Lee D,Schwab S,Jantsch J.2015.Endogenous endophthalmitis"complicating Sreptococcus equi subspecies zooepidemicus"meningitis:A case report[J].BMC Research Notes,8(1):184.doi:10.1186/s13104-015-1133-9.
Mitchell AM,Mitchell TJ.2010.Streptococcus pneumoniae:Virulence factors andvariation[J].Clinical Microbiology and Infection,16(5):411-418.doi:10.1111j.1469-0691.2010.03183.x.
Tang F,LiD Z,WangH J,Ma Z,Lu C,DaiJ.2015.Prophage lysin py30protects mice from Streptococcus suis and"Sreptococus equi subsp.zooepidemicus infections[J].Applied and Environmental Microbiology,81(21):7377-7384.doi:10.1128/AEM.02300-15.
Timoney JF,Qin A,Muthupalani S,Artiushin S.2007.Vaccine potential of novel surface exposed and secreted proteins of"Streptococcus equi[J].Vaccine,25(30):5583-5590.doi:10.1016/j.vaccine.2007.02.040.
Valentin WP,Traore MY,Blobel H,Chhatwal GS.1990.Role of alpha2-macroglobulin in phagocytosis ofgroup Aand Cstreptococci[J].Fems Microbiology Letter,58(3):321-324.doi:10.1111/j.1574-6968.1990.tb13997.x.
Voyich JM,VuongC,DeWald M,NygaardT K,Kocianova S,Griffith S,JonesJ,Iverson C,Sturdevant DE,Braughton"KR,Whitney AR,Otto M,DeLeoFR.2009.The SaeR/S gene regulatory system is essential for innate immune eva-sion by Staplylococcus aureus[J].The Journal of Infec-tious Diseases,199(11):1698-1706.doi:10.1086/598967.
WeiZ G,Fu Q,Chen YS,LiM,Cong P,Mo D,Liu X.2013.Streptococcus equi ssp.z0oepidemicus C5a peptidase,a"putative invasin,induces protective immune response in mice[J].Researchin Veterinary Science,95(2):444-450.doi:10.1016/j.rvsc.2013.03.026.
Xie HL,WeiZG,Ma CQ,LiS,Liu X,FuQ.2018.Character-ization of SeseC_01411as asurface protective antigen of"Streptococcus equi ssp.zooepidemicus[J].Research inVe-terinary Science,118:517-521.doi:10.1016/j.rvsc.2018.05.007.
Xu G,Guo Z,Liu Y,Yang Y,Lin Y,Li C,Huang Y,Fu Q."2022.Gasdermin Dprotects against Sreptococus equ"subsp.zooepidemicus infection through macrophage pyrop-tosis[J].Frontiers in Immunology,13:1005925.doi:10.3389/fimmu.2022.1005925.
YiL,WangY,Ma Z,Lin HX,XuB,Grenier D,Fan HJ,Lu CP.2016.Identification and characterization of aSreptococ-cus equi ssp.zooepidemicus immunogenic GroELprotein"involved in biofilm formation[J].Veterinary Research,47(1):1-9.doi:10.1186/s13567-016-0334-0.
YiL,Wang Y,Ma Z,Zhang H,LiY,Zheng JX,Yang YC,Lu CP,Fan HJ.2013.Contribution of fibronectin-binding"protein to pathogenesis of Streptococcws equi ssp.z00epi-demics[J].Pathogens and Disease,67(3):174-183.doi:10.1111/2049-632X.12029.
Zhou Y,Yan K,Sun CF,Liu F,Peng W,Chen HC,Yuan FY,BeiWC,LiJQ.2021.Binding of plasminogen to Strepto-coccus suis protein endopeptidase Ofacilitates evasion of innateimmunity in Streptococcns suis[J].Frontiers in Mi-crobiology,12:694103.doi:10.3389/fmicb.2021.694103.
(责任编辑 思利华)
