赤霉素和多效唑对云南草蔻花柱运动的影响
2024-07-30周会平茶永鹏李孙洋崔现亮罗银玲
收稿日期:2024-03-27
基金项目:国家自然科学基金项目:相似的行为,不同机制——山姜属植物花柱运动机理研究(31360059)。
作者简介:周会平(1978-),女,河北景县,博士,研究员,研究方向:植物生理生态学。
通信作者:罗银玲(1978-),女,河北商水县,博士,教授,研究方向:植物生理生态学。
摘要:以云南草蔻的离体花为材料,研究了赤霉素(GA)和多效唑(PAC)在黑暗和光照两种条件下对花柱运动的影响。结果表明,云南草蔻两种表型(上举型和下垂型)的花柱,无论在黑暗或光照条件下,第一次运动受GA或PAC的影响均不显著。上举型花柱的第二次运动,在黑暗条件下,对照(CK)和PAC处理之间无显著差异,花柱均未发生上举运动,而GA处理后花柱发生显著的上举运动;在光照条件下,柱头-花药夹角(SAA)在GA和PAC处理时与CK均无显著差异。下垂型的第二次花柱运动,在光下显著强于暗处。在黑暗条件下,PAC处理后SAA的值大于CK与GA处理,但并不显著;在光照条件下,CK、GA和PAC处理之间无显著差异。这些结果表明,GA在云南草蔻不同表型、同一表型的不同运动阶段所起的作用存在差异。
关键词:花柱运动;光照;赤霉素;多效唑;云南草蔻
中图分类号:Q943.1" " "文献标识码:" A" " " 文章编号:2095-7734(2024)03-0001-05
" 植物运动(plant movement)是植物为更好地生存与繁殖所采取的一种策略,根据植物运动的方向与外界刺激方向之间的关系,植物运动可分为向性运动(tropism)和感性运动(nastic movement);根据运动机理,植物运动可分为生长运动(growth movement)和膨压运动(turgor movement)。[1-2]在植物运动过程中,植物激素,尤其是生长素起着非常重要的作用。Cholodny-Went假说认为,生长素在植物器官中的不对称分布,引起器官的差异生长,从而导致弯曲。[3]这种观点在后来的研究中得到较多的实验证据支持。[4-8]拟南芥幼苗的下胚轴发生向光性和向重力性反应时,在不对称生长的器官两侧,都可以观察到生长素的差异分布。[4]外施生长素后,黄化玉米和黑麦的幼茎和根,比对照表现出较强的向重力的弯曲生长。[9]豌豆下胚轴在向重力性和向光性反应中,弯曲部位生长素存在明显的不对称分布,在向外突起的一侧,有较高的生长素含量[10]。除生长素外,赤霉素、油菜素内酯、乙烯等其他植物激素也参与植物运动。[11-13]在植物运动的运动机理中,也有学者认为弯曲生长是由于生长抑制物质分布不均匀的。Hasegawa et al.[14]以萝卜为材料,发现单侧光引起向光侧生长积累抑制物质,陈汝民[15]研究玉米胚芽鞘的向光性运动,发现生长抑制物质6-甲氧基-2-苯并唑啉酮(MBSO)分布不均匀是引起玉米胚芽鞘向光性运动的主要原因,但是这方面的证据支持相对较少。
" 山姜属植物的花柱运动是植物运动的一种奇特类型,[16-18]它具有避免自交和避免雌雄干扰的作用。[16][19]每种山姜属植物的花均有两种表型——上举型(Ana-morph)和下垂型(Cata-morph),花柱在花开过程中,均会进行两次弯曲运动。上举型的花柱先向下弯曲,之后向上弯曲;下垂型的花先向上弯曲,之后向下弯曲。[18]前期研究发现,同一种山姜属植物,两个表型的花柱运动机制存在差异。在云南草蔻(Alpinia blepharocalyx)、宽唇山姜(Alpinia platychilus)和马来良姜(Alpinia mutica)三种植物中,上举型花柱的向上弯曲运动受光照控制,花柱不见光,上举运动不发生;而下垂型的花柱,其运动虽也受光照影响,但光照有无只影响运动幅度大小,并不能决定运动是否发生。[20,21]此外,在上述三种山姜属植物中,上举型在暗中不能向上弯曲的现象,在外施生长素后,不会发生改变;而外施生长素运输抑制剂NPA和TIBA后,下垂型花柱的向下弯曲受到显著抑制。生长素在花柱中的分布研究表明,在红豆蔻(Alpinia galanga)中,每种表型的花柱均可进行两次弯曲运动,但弯曲前花柱中的生长素不存在差异分布;在益智(Alpinia oxyphylla)中,花柱中生长素的不对称分布也不能解释它所有的卷曲运动。[22]
" 赤霉素可以引起细胞伸长[23][24],赤霉素的不对称分布,在植物器官的运动中也起着重要的作用。[25][26]在山姜属植物的两种表型中,不同表型或同一表型的两次运动之间,运动机制的差异也可能与赤霉素有关。因此,本研究以云南草蔻为研究材料,研究外施赤霉素和赤霉素合成抑制剂多效唑对花柱运动的影响,以期探明赤霉素是否在花柱运动中起作用。
1材料与方法
1.1材料
实验材料云南草蔻(Alpinia blepharocalyx K. Schum),为多年生草本,生长在云南省普洱市思茅区佛莲山,于2017年4月22:30左右和凌晨(天亮前,05:00)采样,采完后置于黑色塑料袋内,立即运回实验室进行控制实验。
1.2方法
1.2.1 赤霉素和多效唑处理
将云南草蔻的花去掉苞片和唇瓣后,放在盛满10μM赤霉素(GA)的溶液中,GA先用二甲亚砜(DMSO)溶液,然后加入双蒸水,DMSO的终浓度为0.01%(V/V);或者放在1mM的多效唑(PAC)溶液中,DMSO的浓度相同;对照(CK)为含有0.01% DMSO的双蒸水。
1.2.2 光照和温度条件
为确定GA和PAC对云南草蔻两次运动的影响,团队分别在第一次运动前(22:30)和第二次运动前(05:00)两个时间点进行采样。每次采样的材料带回实验室用GA或PAC处理后,分别放入两个光照培养箱,其中一个培养箱为无光照(黑暗);另一个培养箱为全光照(24h白光,强度为10.9Klux)。两个培养箱的温度均为28℃。每个光照条件下的CK、GA或PAC的处理为5-15个重复。
1.2.3 柱头-花柱夹角的测定
柱头-花药夹角(stigma-anther angle,SAA)的测量,按照Luo et al.[10]的方法进行。在处理结束后,用数码相机拍照,采用屏幕量角器(Screen Protractor
V4.0)进行角度的测定。SAA为负数的,表示柱头在花药的下方;SAA为正数的,表示柱头在花药的上方。
1.2.4 统计分析
数据的统计分析,用R软件进行(Ri386 3.4.0)。采用双因素方差分析来检验光照和化学试剂处理对SAA影响的差异显著性,并用TukeyHSD检验进行了多重比较;多重比较时考虑了两个因素的交互作用。
2结果与讨论
2.1 GA和PAC对云南草蔻第一次花柱运动的影响
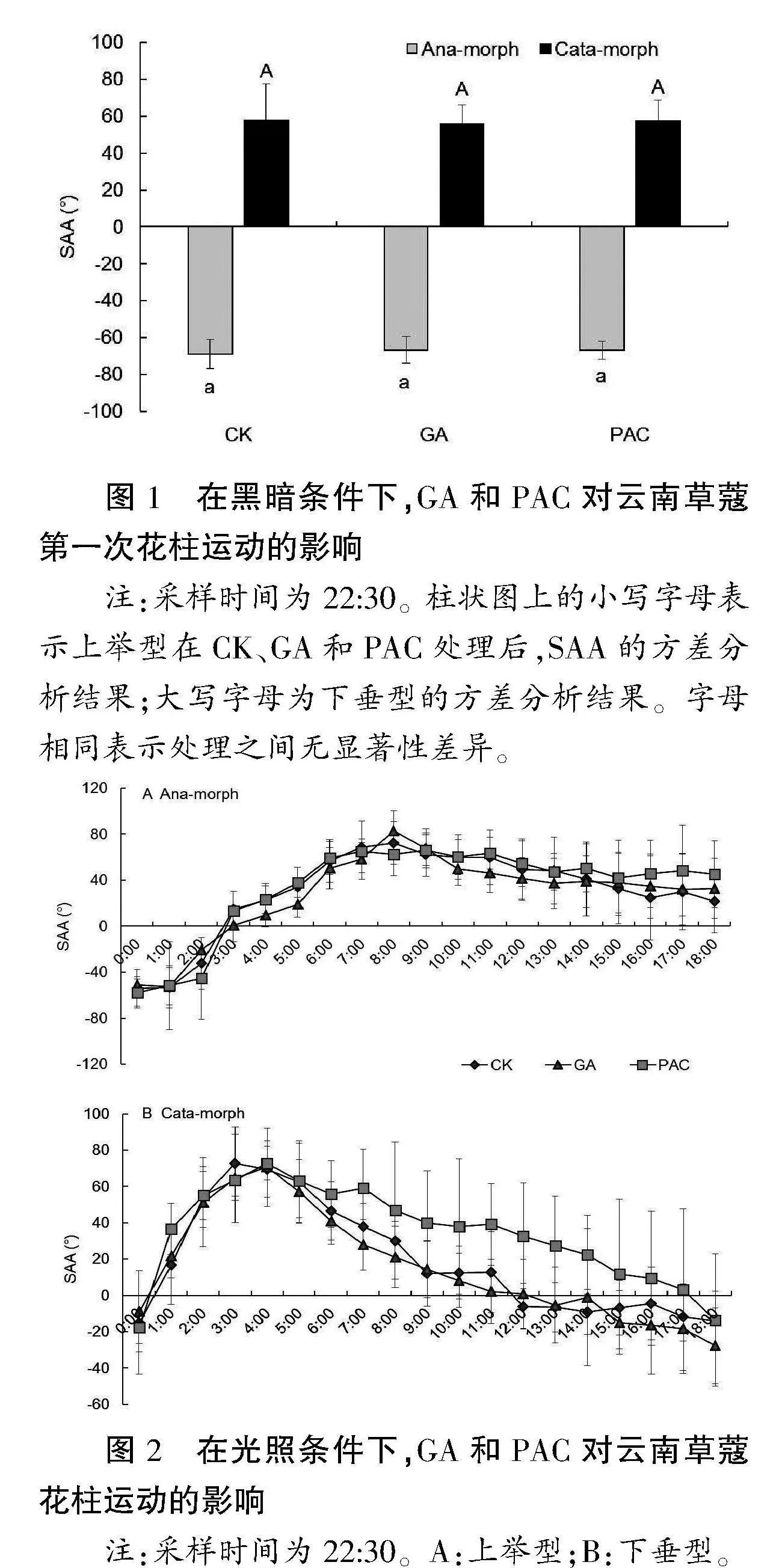
自然状态下,云南草蔻两种表型花的花柱,第一次运动发生在夜里,即黑暗条件下。花离体后,在第一次运动发生前放入黑暗条件,次日早上08:00观察时,GA和PAC处理与CK相比,均未有明显差异(图1)。
" 放入光照下的花柱,每隔1h进行一次记录,结果如图2所示。上举型的花柱,见光1h后即开始进行上举运动,至早上08:00,运动幅度达最大值;之后花柱进行向下弯曲运动,但直至18:00,柱头仍在花药上方;GA和PAC处理的花柱,花柱运动的动态进程和幅度与CK之间无明显差异。下垂型的花柱,在凌晨03:00—04:00上举运动的角度达最大值,之后直接进行下垂运动,上举运动完成和下垂运动开始之间,无大的时间间隔;与上举型的花柱相似,GA和PAC处理的花柱,花柱运动的动态进程和幅度与CK之间无明显差异。这些结果表明,改变第一次运动期间的光照条件,可以显著影响其第二次运动的开始时间,并打破了两次运动期间原有的7-10h的时间间隔。此外,在光照条件下,上举型的花药开裂时间为06:00,而自然光照下,花药开裂的时间为13:00左右。
图1" 在黑暗条件下,GA和PAC对云南草蔻第一次花柱运动的影响
注:采样时间为22:30。柱状图上的小写字母表示上举型在CK、GA和PAC处理后,SAA的方差分析结果;大写字母为下垂型的方差分析结果。字母相同表示处理之间无显著性差异。
图2" 在光照条件下,GA和PAC对云南草蔻花柱运动的影响
注:采样时间为22:30。A:上举型;B:下垂型。
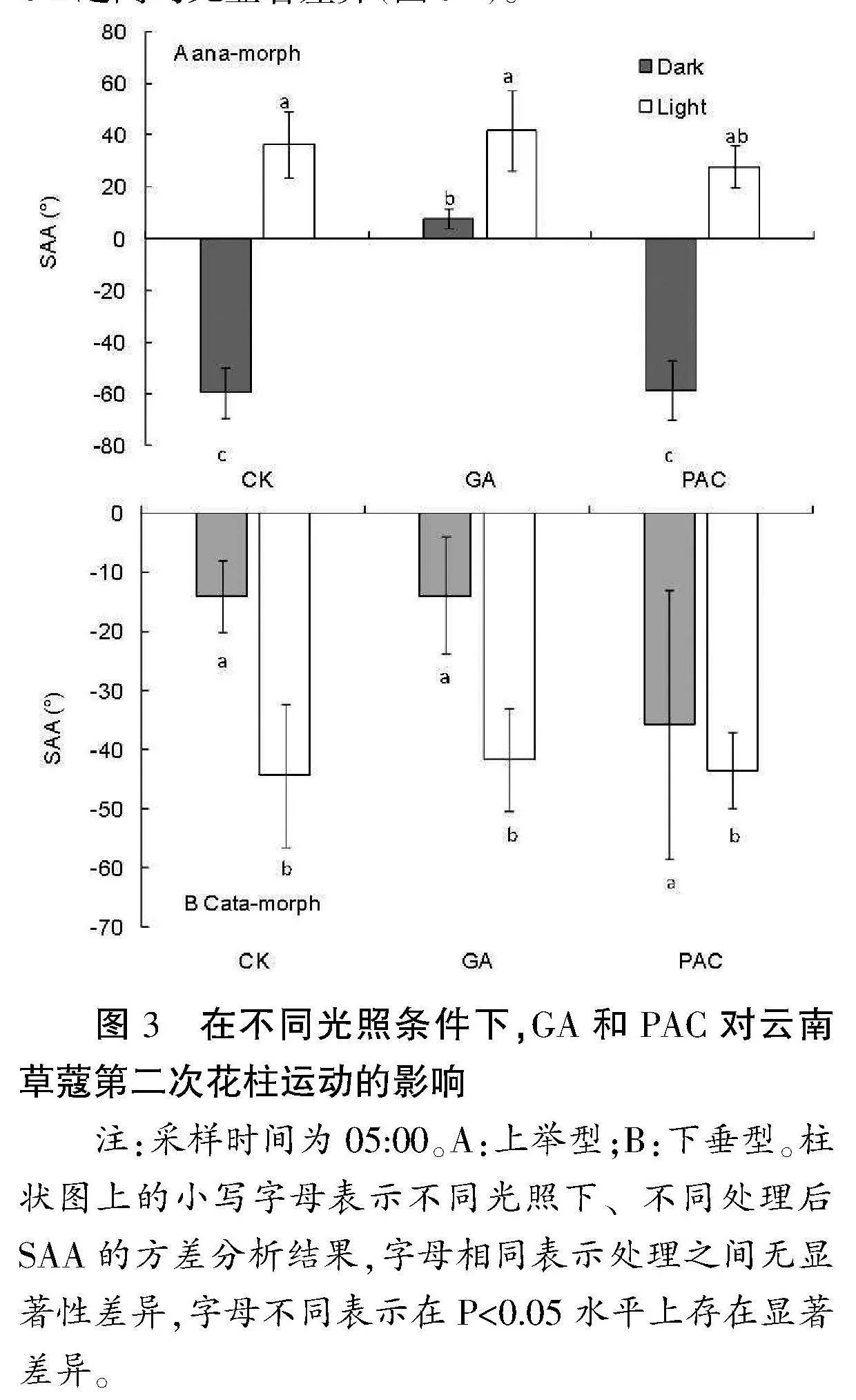
2.2 GA和多效唑对云南草蔻第二次花柱运动的影响
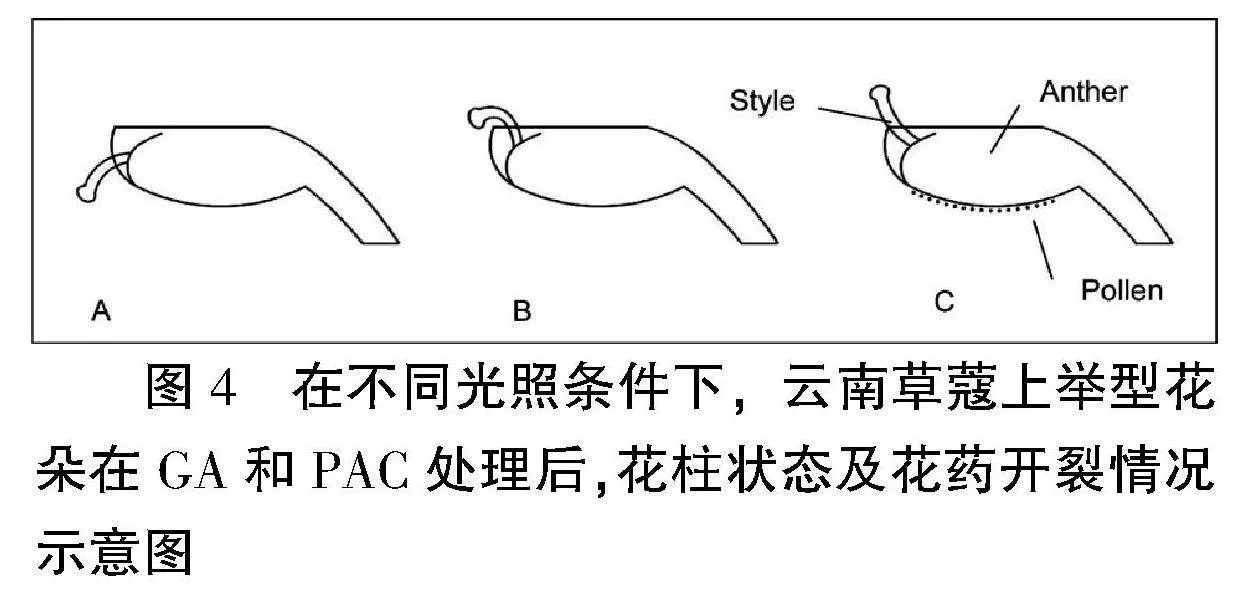
自然条件下,云南草蔻两种表型花的花柱,第二次运动发生在白天,即自然光照。若在第一次运动结束后,天亮之前把花离体放在黑暗条件下,CK和PAC处理的花柱与Luo et al.[10]之前的结果一致,花柱不发生弯曲;但GA处理的花柱发生了显著的向上弯曲运动,运动后的角度为7.84±3.85°(图3)。且此时花柱的弯曲状态与光照下上举型花柱的状态有明显的区别(图4),具体表现在GA处理过的花,虽柱头在花药上方,但紧邻柱头的花柱仍存在凹面向下的弧度,这说明GA引起的弯曲不是花柱向上弯曲的全部。此外,在暗处的上举型,其花药无论是CK、GA或PAC处理,均未开裂。在第二次运动期间,花放在光照下时,上举型的花柱均能进行上举运动,GA处理后虽卷曲增强,但与PAC和CK之间均无显著差异(图3A)。
图3" 在不同光照条件下,GA和PAC对云南草蔻第二次花柱运动的影响
注:采样时间为05:00。A:上举型;B:下垂型。柱状图上的小写字母表示不同光照下、不同处理后SAA的方差分析结果,字母相同表示处理之间无显著性差异,字母不同表示在Plt;0.05水平上存在显著差异。
" 云南草蔻下垂型的花柱,光照处理与黑暗条件相比,差异显著,这与宽唇山姜的结果一致;[18]但是GA与PAC处理未引起SAA的显著差异,且光照与化学处理之间交互作用不明显。黑暗条件下时,SAA的绝对值在CK与GA处理时最小,PAC处理时最大,但处理之间差异并不显著;运动方向一致,均为向下。光照条件下时,SAA在CK、GA与PAC之间也无显著差异(图3B)。
图4" 在不同光照条件下,云南草蔻上举型花朵在GA和PAC处理后,花柱状态及花药开裂情况示意图
注:采样时间为05:00。A:处理前,暗处CK和PAC处理后;B:暗处GA处理后;C:光下CK、GA和PAC处理后。花药下方的黑点为花粉。
综合以上结果可以看出,无论暗处或者光下,外施GA与PAC对云南草蔻两个表型的第一次花柱运动影响均不明显。外施GA和PAC对第二次花柱运动的影响,上举型最大的特点在于暗处时GA处理引起了花柱的向上弯曲运动,但弯曲幅度比光下的CK要小,这表明外施GA具有引起花柱下方细胞的伸长作用。Luo et al[20]之前研究发现,外施IAA在光下可显著提高上举型花柱第二次运动的幅度,但是在暗处外施IAA时,其结果与对照一样,花柱不能上举。那么上举型花柱的向上弯曲过程中,一方面,可能光通过生长素引起了花柱下方细胞的伸长;另一方面,可能GA通过信号途径引起了细胞伸长。在拟南芥中发现,PIF(PHYTOCHROME INTERACTING FACTOR)在细胞伸长中的作用可被光受体phyB和DELLA蛋白调控。[23][28]DELLA蛋白是GA信号通路中的负调控因子,它的含量受GA水平调控,[29]活性GA含量高时,DELLA含量低;此外,DELLA也受光照调控,[23][30]夜里时(黑暗)含量低,白天(光照)时含量高。在马来良姜(Alpinia mutica)花柱的转录组数据中,未见光的上举型花柱中DELLA的表达较高,见光后较低;而下垂型的花柱中正好相反(未发表)。可能在云南草蔻花柱运动的过程中,赤霉素主要调控花柱的向上卷曲运动,这可以解释上举型花柱在暗处外施GA时可向上弯曲,以及下垂型花柱在暗处外施PAC时下垂幅度增大。在山姜属植物益智和红豆蔻中,生长素的不对称分布不能解释每一次弯曲,[22]因此有可能GA引起的生长与生长素引起的生长博弈,决定了花柱的弯曲方向。但是,GA是如何在花柱运动中起作用的,在此过程中光照强度和持续时间是否重要,仍需进一步探究。
参考文献:
[1]" HART J W.Plant tropisms and other growth movements
[M].1990, London: Springer Press.
[2]" 武维华.植物生理学 [M].北京:科学出版社,2003:335-
347.
[3]" WENT F W,THIMANN K V. Phytohormone [M].NewYork:
Macmillan,1937:1-294.
[4]" Friml J, Wisniewska J, Benkava E, Mendgen K, Palme K.
Lateral relocation of auxin efflux regulator PIN3 mediates
tropism in Arabidopsis [J]. Nature,2002,415:805-809
[5] Tanaka H, Dhounukshe P, Brever PB, et al.Spatiotemporal
asymmetric auxin distribution: a meansto coordinate plant
development [J]. Cellular andMolecular Life Sciences,
2006,63:2738-2754.
[6]" Dong Z,Jiang C,Chen X,et al.Maize LAZY1" "mediates shoot
gravitropism and inflorescence development through
regulating auxin transport, auxin signaling,and light
response [J]. Plant physiology,2013,163(03):1306-1322.
[7]" Ramos P, Guajardo J, Moya-León M A, et al.A differential
distribution of auxin and flavonols in radiata pine stem
seedlings exposed to inclination [J]. Tree Genetics and
Genomes,2016,12(03):1-13.
[8]" Han H,Adamowski M,Qi L, et al.PIN-mediated polar auxin
transport regulations in plant tropic responses[J].New
Phytologist,2021,232(02).doi:10.1111/nph.17617.
[9]" Edelmann HG, Sabovlievic A, Njio G,Roth U,The role of
auxin and ethylene for gravitropic differential growth of
coleoptiles and roots of rye- and maize seedlings [J].
Advances In Space Research,2005,36:1167-1174.
[10] Haga K, Lino M. Asymmetric distribution of auxin correlates
with gravitropism and phototropism but not with
autostraightening (autotropism)in pea epicotyls [J].Journal
of Experimental Botany,2006,57:837-847.
[11] 江莎, 中村惠子, 山本福寿.赤霉素对水平放置水曲柳
幼苗的负向重性和木材形成的影响[J]. 云南植物研究,
2003,25(03):336-346.
[12] Nugroho WD,Yamagishi Y, Nakaba S, et al. Gibberellin is
required for the formation of tension wood and stem
gravitropism in Acacia mangium seedlings[J]. Annals of
botany,2012,110:887-895.
[13] Vandenbussche F, Callebert P, Zadnikova P, et al.
Brassinosteroid control of shoot gravitropism interacts with
ethylene and depends on auxin signaling components[J].
American journal of botany,2013,100(01):215-225.
[14] Hasegawa K, Miyamoto K, Raphanusol A. A new growth
inhibitor of light-grown radish seedlings. Plant Cell
PhysiolOGY,1980,21:363-366.
[15] 陈汝民. 6-甲氧基-2-苯并唑啉酮(MBSO)分布不均匀
是引起玉米胚芽鞘向光性运动的主要原因[J]. 植物学
报,1999,41:296-300
[16] LI QJ, XU ZF, KRESS WJ, et al. Pollination: flexible style
that encourages outcrossing [J]. Nature,2001,40:432.doi:
10.1038/35068635.
[17] 罗银玲,罗燕江,段友爱.植物花柱运动 [J]. 热带亚热
带植物学报,2010,18(02): 203-209.
[18] LUO Y L, LI Q J. Effect of light and low temperature on the
reciprocal style curvature of flexistylous Alpinia species
(Zingiberaceae) [J]. Acta Physiol Plant,2010,32:1229-
1234.doi:10.1007/s11738-010-0497-7.
[19] SUN S, GAO J Y, LIAO W J, et al. Adaptive significance of
flexistyly in Alpinia blepharocalyx(zingiberaceae):a hand
pollination experiment [J].Annals of Botany,2007,99:661–
666.doi:10.1093/aob/mcl292.
[20] LUO Y L, BI T J, LI D, et al. Effects of indole-3-acetic acid
and auxin transport inhibitors on the style curvature of three
Alpinia species (Zingiberaceae) [J].Acta Physiol Plant,
2012,34:2019-2025.doi:10.1007/s11738-012-0955-5.
[21] 毕廷菊, 周会平, 苏志龙, 等. 光对马来良姜花柱运动
和花药开裂的影响 [J]. 植物分类与资源学报,2012,34
(05):453-458.
[22] SU Z L, CUI X L, LI L, et al. Similar behavior, different
mechanisms: the research of the style bending of Alpinia
species [J]. Acta Physiol Plant,2017,39:143.
[23] DE LUCAS M,DAVIERE J M,RODRIGUEZ-FALCON M,et
al.A molecular framework for light and gibberellins control of
cell elongation [J].Nature,2008,451,480-484.doi:10.1038/
nature06520.
[24] Nakajima K M ,Ohishi M , Sato F ,et al.Gibberellin-induced
Stem Elongation and Apical BudGrowth Acceleration
Without Decreased Yield in Broccoli (Brassica oleracea L.
var. Italica)[J].The Horticulture Journal,2023.DOI:10.2503/
hortj.qh-045.
[25] PHILLIPS I D. Diffusible gibberellins and phototropism in
Helianthus annuus[J].Planta,1972,106(4):363-367.doi:10.
1007/BF00384773.
[26] LOFKE C, ZWIEWKA M, HEILMANN I, et al.Asymmetric
gibberellin signaling regulates vacuolar" trafficking of PIN
auxin transporters during root gravitropism [J]. PNAS,2013,
110(9):3627-3632.doi:10.1073/pnas.1300107110.
[27] ATAMIAN H S,CREUX N M, BROWN E A, et al.Circadian
regulation of sunflower heliotropism, floral orientation, and
pollinator visits [J].Science,2016,353,587-590.doi:10.1126/
science.aaf9793.
[28] LI K,YU R,FAN L M,et al.DELLA-mediated PIF degradation
contributes to coordination of light and gibberellin signalling
in arabidopsis [J]. NatureCommunications,2016,7:11868.doi:
10.1038/ncomms11868.
[29] FU X,RICHARDS DE,AITALI T,et al.Gibberellin-mediated
proteasome-dependent degradation of the barley DELLA
protein SLN1 repressor [J]. Plant Cell,2002,14,3191-3200.
doi: 10.1105/tpc.006197.
[30] ACHARD P, LIAO L, JIANG C, et al. DELLAscontribute to
plant photomorphogenesis [J].Plant Physiol,2007,143:1163-
1172.doi:10.1104/pp.106.092254.
Effects of GA and PAC on the Style Curvature of Alpinia Blepharocalyx
ZHOU Huiping, CHA Yongpeng, LI Sunyang, CUI Xianliang,LUO Yinling*
(College of Biology and chemistry Puer University, Pu'er" 665000,Yunnan; School of Ecology and Environmental
Science, Yunnan University, Kunming 650504,Yunnan,China)
Abstract:This paper studied the effects of gibberellins (GA) and paclobutrazol (PAC) on the style curvature of excised flower of Alpinia blepharocalyx at the dark and light conditions. The results showed that the first style curvature of two morphs (ana-morph and cata-morph) was not significantly affected by GA and PAC whenever in dark or in light. In dark condition, the second style curvature of ana-morph did not happen for CK and PAC treatment, but GA led to significant upward bending. Meanwhile in light condition, the styles of ana-morph all can bend upwardly for CK, GA and PAC treatment, and there was no significant difference among them. The stigma-anther angle (SAA) of cata-morph was significantly higher when styles were put in light than in dark. In dark condition, PAC can enhanced the second style curvature of cata-morph in dark, but the difference was not significant than CK and GA. In light condition, there was no significant difference among them. These results suggested that GA played a different role in different morph, or in different movement stage of one morph.
Key words:style curvature;light, gibberellin;paclobutrazol;alpinia blepharocalyx
