纳氏试剂对低浓度氨氮分析的影响因素及条件优化研究
2024-07-12周敬峰庞碧剑杨爽陈燕蓝文陆
周敬峰 庞碧剑 杨爽 陈燕 蓝文陆

摘要:针对部分商品化纳氏试剂在分析低浓度氨氮时灵敏度低的问题,通过研究三种商品化纳氏试剂在不同的投加量、显色时间和显色温度下,标准曲线的质量控制情况,查明关键的影响因素并确定最佳的显色条件。实验表明,氨氮标准曲线低浓度曲线点显色不充分是质量控制不达标的主要原因,而pH是主要的影响因素。通过调整纳氏试剂投加量或调节pH的方式,可显著提高低浓度曲线点吸光度,使标准曲线满足质控要求。
关键词:氨氮;商品化;纳氏试剂;分光光度法;质量控制
中图分类号:X830.2 文献标志码:B
前言
纳氏试剂分光光度法具有操作简便、反应灵敏、快速高效等特点,被各级环境监测部门广泛应用于地表水氨氮的分析工作。
目前,国内对纳氏试剂法测定低浓度氨氮的影响因素研究主要集中在显色温度和时间,如窦艳艳和李娇采用增加显色时间的方式,使低浓度点灵敏度得到提高;李凤彩采用增加显色时间和温度的方式来解决低浓度点显色问题。此外,不同的纳氏试剂种类、投加量和酸碱条件也影响氨氮测定,王炜比对国产和进口纳氏试剂,通过改变显色时间和纳氏试剂投入量使低浓度点灵敏度得到改善;田松通过外加碱液调节pH的方式加快低浓度氨氮的显色反应速率。由此可见,影响纳氏试剂显色的因素众多。
研究考察不同商品化纳氏试剂在不同显色时间、温度、加入量和额外调节pH情况下的使用效果,确定其在氨氮检测中的适用性,提高氨氮分析结果的准确性,为地表水环境监测和实验室质量控制保证提供一种简便可靠的方法。
1 实验部分
1.1 实验材料
研究在验证前,对部分监测机构正在使用中的商品化纳氏试剂进行调研,选取国内外常用的三种纳氏试剂进行实验比对,分别编号为:N1(国产)、N2(国产)、N3(进口)。酒石酸钾钠、氢氧化钠、硫酸锌等均为国产分析纯药剂。
1.2 实验设计
1.2.1 实验方法
参考《水质氨氮的测定纳氏试剂分光光度法(HJ 535 - 2009)》,以纳氏试剂种类(NI、N2、N3),纳氏试剂加入量(1.0 mL、1.5 mL、2.0 mL),显色温度(25℃、35℃、45℃)和显色时间(10 min、30 min和60 min)共4个变量做正交实验。以氨氮质量为横坐标、吸光度为纵坐标绘制标准曲线,同步分析有证标准物质。通过查看正交实验数据,分析纳氏试剂种类,加入量,显色时间和显色温度对标准曲线质量控制的影响。
由于纳氏试剂为强碱性溶液,为进一步弄清影响纳氏试剂显色的原因,在确定关键影响因素后,通过额外投加NaOH溶液(8 mol/L)的方式,以补充实验的方式研究pH对低浓度曲线点在标准方法下显色的情况。
1.2.2 最佳显色条件的选择方式
在提高实验分析效率的同时,从减少使用有毒有害试剂的角度出发,以显色时间短,显色温度容易把控,纳氏试剂用量少为标准,确定三种纳氏试剂的最佳显色条件。
1.2.3 数据分析与评价
根据《地表水和污水监测技术规范》以及《国家地表水环境质量监测网监测任务作业指导书(试行)》中的质量控制要求,实验室空白吸光度≤0. 060,斜率0.006 0-0.007 8,截距≤±0.005,氨氮标准曲线相关系数≥0. 999;样品含量≤1.0 mg/L时,加标回收率70. 0% - 130%。
采用Excel软件进行统计分析,以“质控线”形式在图中表示测定结果的质量控制情况。
2 结果与讨论
2.1 三种纳氏试剂在各反应条件下的测试结果
2.1.1 分析空白和低浓度曲线点(5.0 μg)的显色情况
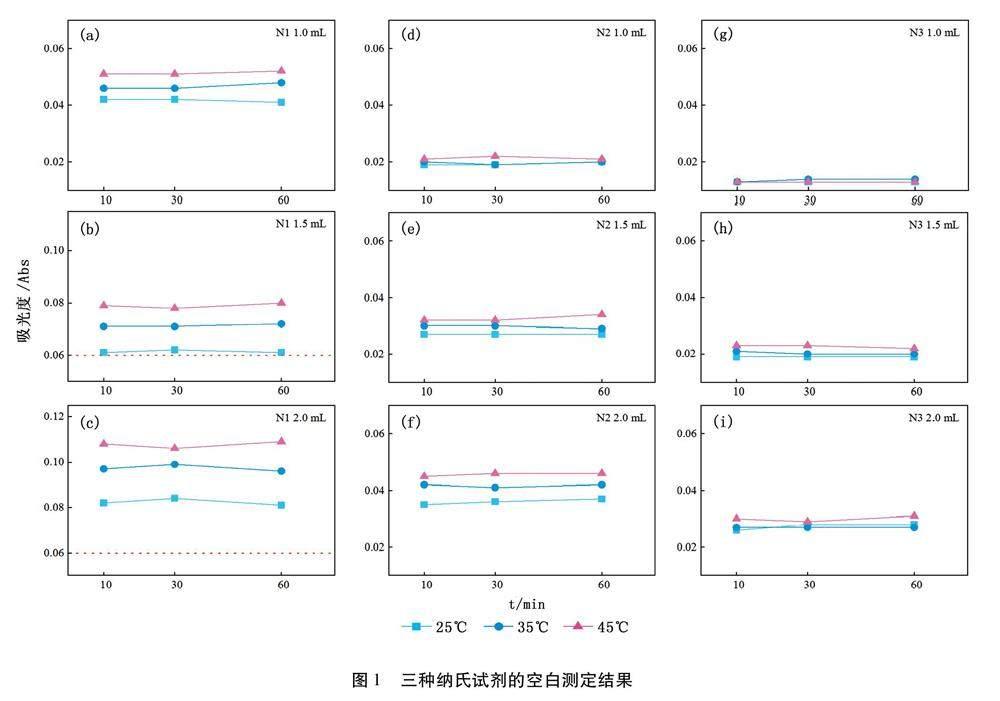
如图1所示,当纳氏试剂投加入量提高时,空白吸光度均呈上升趋势,其中N1试剂在投加量增至1.5 mL以上时,空白吸光度超出质控范围;当显色温度升高,三种试剂空白吸光度均小幅上升,N1和N2试剂在高投加量时增幅明显;随着显色时间的加长,三种试剂空白吸光度无明显变化。如图2所示,低浓度曲线点扣除空白吸光度后示意图,N1试剂低浓度曲线点吸光度随投加量增加有小幅升高,基本维持在0. 030 -0.050之间;N2试剂低浓度曲线点在高投加量的条件下显色更加稳定,维持在0. 030-0.040之间;N3试剂低浓度曲线点显色不稳定,需显色时间与投加量的共同作用才能提升。
2.1.2 标准曲线截距
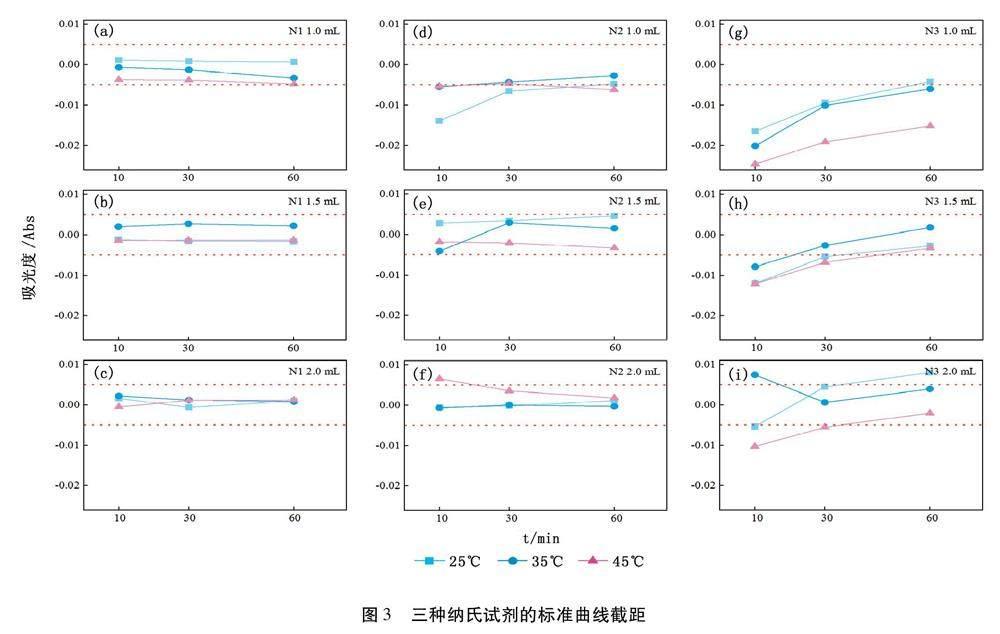
如图3所示,随纳氏试剂投加量的增加,N1试剂的截距稳定处于质控线内,N2试剂的截距均向质控线内靠拢,N3试剂的截距明显好转;随显色温度上升,三种试剂的截距无一致的规律变化;随显色时间加长,N3试剂的截距有改善趋势并向质控线内靠拢,而N1和N2试剂的截距无规律变化。
2.1.3 标准曲线斜率
如图4所示,三种试剂的斜率随纳氏试剂量的增加有小幅上升;N2和N3试剂在显色温度上升时斜率变化幅度较小,N1试剂在显色温度为45℃,试剂投加量为2 mL时超出质控线;随显色时间加长,N1试剂斜率有上升趋势,N3试剂斜率有下降趋势。
2.1.4 标准曲线相关系数
如图5所示,随纳氏试剂投加量增加,N1和N2试剂线性良好满足质控要求,N3试剂线性也逐步好转;随显色温度升高,三种试剂无规律变化;随显色时间加长,N3试剂的线性达标情况明显好转,N1和N2试剂无明显变化。
2.2 NaOH对商品纳氏试剂测试结果影响
如表1所示,当额外加入NaOH溶液时,N3纳氏试剂标准曲线有所改善,当加入量为0.5 mL时,N3纳氏试剂标准曲线均能满足质控要求。
2.3 最佳显色条件及讨论
综上所述,时间和温度能影响纳氏试剂的显色,但纳氏试剂投加量才是影响显色的关键因素。研究表明,纳氏试剂的投加量与配制试剂有关,配制所用试剂的质量和纯度对低浓度曲线点显色存在影响,所以部分纳氏试剂按标准方法要求的加入量分析时,标准曲线未能满足质量控制要求。
综合三种纳氏试剂在各反应条件下的图表数据,总结出满足1.2.2数据分析与评价要求的显色条件。N1试剂:1.0 mL纳氏试剂加入量,常温(25℃),显色10 min;N2和N3试剂:1.0 mL纳氏试剂加入量,常温(25℃),显色10 min,0.5 mLNaOH溶液。三种试剂的最佳显色温度、时间和纳氏试剂加入量均是一致的,唯一不同在于N2和N3试剂需多加氢氧化钠。
通过2.2的补充实验,弄清了投加量影响显色的原因,实验结果也与前人研究相符。我们知道反应溶液的pH在纳氏试剂多个络合反应中也有关键性影响,纳氏试剂为强碱性溶液,增大投加量可同时提高显色基团(HgI2-4)的浓度和增加溶液碱度(OH -),碱性增强反应往正方向进行并促进显色物质的生成。查阅相关文献[9 -10]时也发现,当pH为13时显色较完全且不产生浑浊,通过外加碱液的方式,N2和N3试剂的标准曲线质量控制均能满足质控要求,而此时N1试剂显色溶液pH为13. 00,N2试剂为13. 15,N3试剂为13. 20,也说明不同的商品化纳氏试剂显色溶液pH也存在一定差异。
4 结论
由于不同商品化纳氏试剂显色条件不同,使用前需做好验证工作,确定投加量显色时间及显色温度,随意改变条件存在空白吸光度和截距不符合要求的风险。其中,低浓度曲线点的不完全反应是商品化纳氏试剂标准曲线不达标的主要原因,研究批次的纳氏试剂,其主要影响因素为pH,通过调整纳氏试剂投入量或投加强碱(NaOH)调节pH的方式,可显著提高低浓度曲线点吸光度,使商品纳氏试剂标准曲线满足质控要求。
基金项目:广西自然科学基金项目(2023GXNSFBA026253)
