土壤熏蒸处理后产紫篮状菌对黄瓜促生效果研究
2024-07-09尹成林许佩佩靳义荣曹永昌
尹成林 许佩佩 靳义荣 曹永昌

摘要 以设施大棚黄瓜为试材,在设施大棚经过土壤熏蒸后,分别设定未添加商品化微生物菌剂、添加商品化微生物菌剂、添加棘孢木霉、添加产紫篮状菌(Talaromyces purepurogenus)Q2菌株4个处理,通过测定黄瓜生长势、叶绿素含量、根系活力、光合作用及防御酶活性,研究了土壤熏蒸后添加产紫篮状菌Q2菌株对黄瓜植株生长的影响。结果表明,产紫篮状菌Q2菌株可通过改善黄瓜根系活力和光合作用促进黄瓜植株的生长,产紫篮状菌Q2菌株处理的黄瓜植株功能叶光合速率提升了8.72%、叶绿素含量提高了20.79%、茎粗增加了11.26%、根系活力提升了30.00%以上,植物苯丙氨酸解氨酶活性(PAL)和过氧化物酶活性(POD)也显著上升。综合可知,土壤熏蒸后添加产紫篮状菌Q2菌株能够有效促进黄瓜生长,为菌株Q2开发利用提供理论支撑。
关键词 产紫篮状菌;黄瓜;促生效果
中图分类号 S 642.2 文献标识码 A 文章编号 0517-6611(2024)12-0013-03
doi:10.3969/j.issn.0517-6611.2024.12.003
Study on the Growth Promotion Effect of Talaromyces purpurogenus on Cucumber After Soil Fumigation
YIN Cheng-lin1,XU Pei-pei2,JIN Yi-rong3 et al
(1.Dezhou Agricultural and Rural Bureau, Dezhou Agricultural Technology Extension and Seed Industry Center,Dezhou,Shandong 253000;2. Chiping District Agricultural Development Service Center, Liaocheng, Shandong 252100;3.Dezhou Academy of Agricultural Sciences,Dezhou,Shandong 253000)
Abstract Cucumber in the greenhouse was used as the test material.After soil fumigation in the greenhouse, four treatments were set, including no commercial microbial agent, commercial microbial agent, Trichoderma asperellum and Talaromyces purpureogenus Q2 was added. By measuring the cucumber growth potential, chlorophyll content, root activity, photosynthesis and defense enzyme activity, the effects of adding strain Q2 on the growth of cucumber after soil fumigation were studied. The research results indicate that strain Q2 can promote the growth of cucumber plants by improving root activity and photosynthesis. The photosynthetic rate, chlorophyll content, stem diameter, and root activity of cucumber plants treated with strain Q2 increased by 8.72%, 20.79%, 11.26%, and more than 30.00%, respectively. The activity of phenylalanine ammonia lyase (PAL) and peroxidase (POD) in plants also significantly increased in the treatment of strain Q2. In conclusion, the addition of strain Q2 after soil fumigation could effectively promote the growth of cucumber, which provided theoretical support for the development and utilization of strain Q2.
Key words Talaromyces purpureogenus;Cucumber;Growth promoting effect
作者简介 尹成林(1990—),男,山东德州人,农艺师,硕士,从事植物病害生物防治及农业技术推广。
鸣 谢 感谢山东农业大学高克祥教授和田叶韩博士提供产紫篮状菌(Talaromyces purpureogenus)Q2菌株和棘孢木霉菌(Trichoderma asperellum)T0206菌株及对试验的指导和帮助。
收稿日期 2023-08-19;修回日期 2024-01-08
篮状菌(Talaromyces)是一类广泛分布于自然界及人类活动场所的腐生真菌,属于子囊菌亚门(Ascomycotina)、不整囊菌纲(Plectomycetes)、散囊菌目(Eurotiales)、散囊菌科(Eurotiaceae),由Benjamind于1955年首次发现并命名[1]。篮状菌有性繁殖结构为柔软的子囊果,子囊果表面缠绕着一层紧密交织的菌丝,子囊孢子多为椭球形,壁多具刺状突起,曾被认为是青霉属(Penicillium)的有性型。2011年,基于基因鉴定以及国际命名法规的优先级原则,重新界定了篮状菌属,成为一个独立的类群[2]。在随后的几年里,随着真菌分类学的发展和研究范围的扩展,篮状菌属中的物种数量迅速增长。目前,篮状菌属全球已报道177种,我国已报道篮状菌属6个组,超过60个种,分布在包括北京、山东、福建、甘肃、广东、广西、贵州、台湾、西藏、新疆、云南以及浙江等27个省(区、市)[3]。
目前,篮状菌属真菌在工业、医学和农业领域被广泛应用。暗玫瑰篮状菌(Talaromyces atroroseus)和白双轮篮状菌(T.albobiverticillius)在工业上可用来生产红色素[4-5];黄色篮状菌(T.flavus)和产紫篮状菌(T.purpureogenus)可用于农林植物保害的生物防治[6-7]。Kim等[6]从人参种子中分离的黄色篮状菌对尖镰孢菌(Fusarium oxysporum)、立枯丝核菌(Rhizoctonia solani)、核盘菌(Sclerotinia nivalis)、灰葡萄孢(Botrytis cinerea)和辣椒疫霉(Phytophthora capsici)等植物病原菌具有拮抗作用。篮状菌的开发利用为植物病害的生物防治提供了新的后备力量。产紫篮状菌(Talaromyces purpureogenus)Q2菌株是从健康黄瓜根际分离得到的一株对枯萎病等土壤传播病害具有良好防效的生防菌株。该试验基于山东省设施苦瓜和黄瓜套种模式和“威百亩土壤熏蒸+产紫篮状菌菌剂”的苦瓜枯萎病防控模式下,研究土壤熏蒸后产紫篮状菌Q2菌株对设施黄瓜生长的影响,为篮状菌的开发利用提供理论支撑。
1 材料与方法
1.1 试验地点
试验在山东省聊城市莘县设施蔬菜大棚内进行。
1.2 试验材料
1.2.1 供试菌株。
产紫篮状菌(Talaromyces purpureogenus)Q2菌株分离自健康黄瓜根际土壤,由山东农业大学高克祥教授团队提供,保藏于中国微生物菌种保藏管理委员会普通微生物中心,编号为CGMCC No.13165。
棘孢木霉菌(Trichoderma asperellum)T0206菌株,由山东农业大学高克祥教授团队提供,保藏于中国微生物菌种保藏管理委员会普通微生物中心,生物保藏号为CGMCC No.21467。
1.2.2 供试熏蒸剂。
利民沃野(42%威百亩水剂),利民控股集团股份有限公司。
1.3 试验方法
1.3.1 试验设计。
试验分为4个处理。处理1(阴性对照,CK-1),威百亩熏蒸未加商品化微生物菌剂(撒施,275 g/m2);处理2(阳性对照,CK-2),威百亩熏蒸添加商品化微生物菌剂(撒施,275 g/m2);处理3(MS+T),威百亩熏蒸加棘孢木霉(撒施,1 kg/m2,2×107 cfu/g);处理4(MS+Q2),威百亩熏蒸加产紫篮状菌Q2菌株(撒施,125 g/m2,5×108 cfu/g)。
1.3.2 黄瓜生长势调查。
2019年8月5日采用有效成分为42%的威百亩水剂进行土壤熏蒸处理,高温闷棚;9月5日,熏蒸处理结束,大棚通风散气;10月8日,黄瓜和苦瓜定植,并添加微生物制剂;11月18日,对黄瓜的苗高、茎粗和光合作用等进行调查,每个处理测量101株;定植14 d(10月22日)、21 d(10月1日)和30 d(10月8日)选取每个处理长势均匀的植株(能够反映各处理黄瓜长势的植株),测定叶绿色含量、根系活力、苯丙氨酸解氨酶活性和过氧化物酶活性,每个处理含3个重复,每个重复含7株黄瓜。
1.4 项目测定
1.4.1
叶绿素含量测定。剪取各处理黄瓜植株的功能叶,清洗后擦干水分,避开中脉将叶片剪成小块,称取0.20 g。采用95%乙醇提取叶片中叶绿素,并测定其在665、649和470 nm处的吸光度,计算叶绿素含量。
1.4.2
根系活力测定。挖取各处理生长情况一致的黄瓜苗的根系,冲洗干净后拭去水分,剪取根尖样品0.20 g。采用TTC染色法处理根尖样品,制备含甲腙25、50、100、150、200 μg的标准比色系列溶液,于485 nm处测定各处理吸光度,绘制标准曲线,并以单位质量鲜根四氮唑还原强度反映苦瓜植株的根系活力大小。
1.4.3
黄瓜防御酶活性测定。分别使用苯丙氨酸解氨酶(PAL)活性检测试剂盒(Solarbio,BC0210)和过氧化物酶(POD)活性检测试剂盒(Solarbio,BC0090)测定各处理黄瓜叶片的苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)活性,试验步骤参照试剂盒说明书。
1.5 数据分析
采用Excel 2010和SPSS 22.0软件对数据进行统计分析,应用Student-Newman-Keuls检验进行差异显著性检验。
2 结果与分析
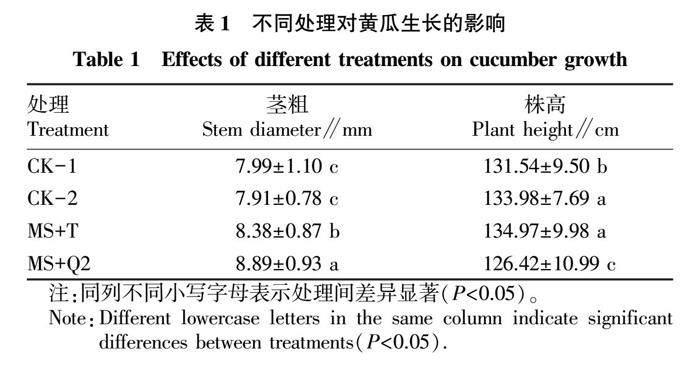
2.1 产紫篮状菌对黄瓜茎粗和株高的影响
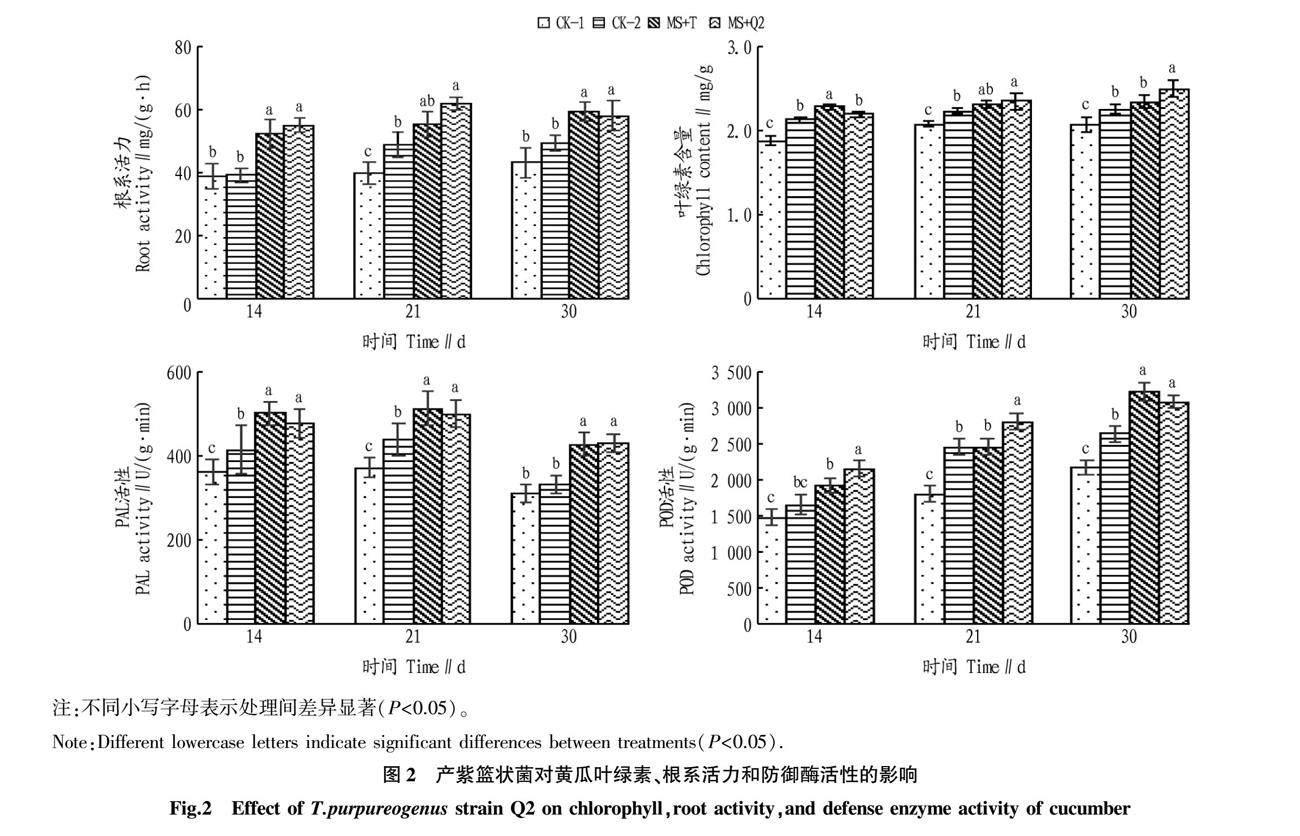
产紫篮状菌(MS+Q2)和棘孢木霉菌(MS+T)处理能够促进熏蒸后黄瓜的生长势(图1),产紫篮状菌能显著增加黄瓜植株茎粗(P<0.05),棘孢木霉菌能显著增加黄瓜植株株高和茎粗(P<0.05)。与空白对照处理相比(CK-1),产紫篮状菌和棘孢木霉菌处理分别使得黄瓜茎粗增加了11.26%和4.88%(表1)。同时,产紫篮状菌和棘孢木霉菌处理能够显著增强黄瓜根系活力,在黄瓜定植14、21和30 d后,产紫篮状菌处理后的根系活力相较于空白对照组(CK-1)分别提高了42.03%、54.75%和34.22%(图2A)。
2.2 产紫篮状菌对黄瓜光合作用的影响
不同处理的黄瓜叶片的光合速率存在差异,产紫篮状菌和棘孢木霉菌处理能够显著增强黄瓜叶片光合作用能力(P<0.05)。与空白对照处理(CK-1)相比,产紫篮状菌处理后的黄瓜功能叶光合速率、蒸腾速率和气孔导度分别提升了8.72%、15.15%和18.63%,胞间CO2浓度降低了15.98%。与各处理相比,棘孢木霉菌处理的黄瓜功能叶水分利用率最高(表2)。同时,产紫篮状菌和棘孢木霉菌处理能够显著增强黄瓜功能叶叶绿素含量,在黄瓜定植30 d后,产紫篮状菌处理后的叶片叶绿素含量相较于空白对照组(CK-1)提高了20.79%(图2B)。
2.3 产紫篮状菌对黄瓜防御酶活性的影响
与对照处理(CK-1)相比,产紫篮状菌(MS+Q2)和棘孢木霉菌(MS+T)处理能够提高黄瓜叶片中PAL和POD的活性。产紫篮状菌和棘孢木霉菌处理在处理后的第21天黄瓜叶片PAL活性相较于CK-1对照组升高了31.85%和38.52%。产紫篮状菌和棘孢木霉菌处理在处理后的第30天黄瓜叶片POD活性相较于CK-1对照组升高了42.03%和48.69%。
3 结论与讨论
产紫篮状菌(Talaromyces purpureogenus)Q2菌株是一株分离自健康黄瓜根际的具有巨大生防潜力的生防真菌[8]。在平皿中,菌株Q2能够显著地抑制包括真菌和卵菌在内的12种病原菌的生长繁殖;在温室条件下,菌株Q2对苦瓜枯萎病、烟草黑胫病、烟草根黑腐病和马铃薯茎基腐病等土传病害具有明显的预防效果,对苦瓜枯萎病和烟草黑胫病的防治效果可达到60%以上;在田间条件下,菌株Q2制剂对苦瓜枯萎病的防治效果达到50%以上,菌株Q2结合威百亩土壤熏蒸技术对枯萎病的防治效果达到80%以上,土壤经威百亩熏蒸后,施用产紫篮状菌Q2菌株可促进土壤有芽孢杆菌(Bacillus)、Gaiella等有益微生物菌群富集。但对产紫篮状菌Q2菌株对植物的促生活性较少。该研究结果表明,设施大棚土壤熏蒸后添加产紫篮状菌Q2菌株可通过改善黄瓜根系活力和光合作用促进黄瓜植株的生长。
近年来,篮状菌已成为农业领域的一颗“新星”,对其促进植物生长和预防植物病害的研究报道逐渐增多。篮状菌GS1菌株能够显著促进桑树叶片、茎重、茎长、根重和根长等指标增加[9]。黄色篮状菌纳米制剂可显著降低棉花黄萎病的发生[10]。嗜松篮状菌(T.pinophilus)M13菌株可通过产生生长素(IAA)、嗜铁素(Siderophore)和溶解磷酸盐等功能促进植物的生长,其产IAA能力是长枝木霉(Trichoderma longibrachiatum)的2倍[11]。同时,嗜松篮状菌可显著促进小麦生物量增加(鲜重、干重、根长、茎高、叶绿素含量等)和提高过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)活性[12]。但相对于酵母菌(Saccharomyces)和木霉菌(Trichoderma),篮状菌在植物生产领域的研究依旧不足。未来,篮状菌的研究将有助于丰富生防真菌资源。
参考文献
[1] BENJAMIN C R.Ascocarps of Aspergillus and Penicillium [J].Mycologia,1955,47(5):669-687.
[2] SAMSON R A,YILMAZ N,HOUBRAKEN J,et al.Phylogeny and nomenclature of the genus Talaromyces and taxa accommodated in Penicillium subgenus Biverticillium[J].Studies in mycology,2011,70(1):159-183.
[3] 陈晗,丁刚,孙炳达,等.篮状菌属分类概述及三个中国新记录种[J].菌物学报,2021,40(5):1200-1215.
[4] 孙剑秋,阮永明,金世宇,等.篮状菌属的重要性及其分类学研究概况[J].菌物研究,2021,19(2):83-93.
[5] FRISVAD J C,YILMAZ N,THRANE U,et al.Talaromyces atroroseus,a new species efficiently producing industrially relevant red pigments[J].PLoS One,2013,8(12):1-15.
[6] KIM M J,SHIM C K,KIM Y K,et al.Enhancement of seed dehiscence by seed treatment with Talaromyces flavus GG01 and GG04 in ginseng(Panax ginseng)[J].The plant pathology journal,2017,33(1):1-8.
[7] TIAN Y H,ZHAO Y,FU X S,et al.Isolation and identification of Talaromyces sp.strain Q2 and its biocontrol mechanisms involved in the control of Fusarium wilt[J].Frontiers in microbiology,2021,12:1-16.
[8] 田叶韩,彭海莹,王德浩,等.产紫篮状菌的生防潜力及其对土壤微生物群落的调控[J].应用生态学报,2020,31(10):3255-3266.
[9] OU T,ZHANG M,GAO H Y,et al.Study on the potential for stimulating mulberry growth and drought tolerance of plant growth-promoting fungi[J].International journal of molecular sciences,2023,24(4):1-18.
[10] SHABANI M H,NARAGHI L,MALEKI M,et al.Evaluation of the efficacy of different concentrations of nano-capsules containing Talaromyces flavus with two forms of powder and suspension in reducing the incidence of cotton Verticillium wilt[J].Brazilian journal of biology,2022,84:1-9.
[11] PATEL D,PATEL A,PATEL M,et al.Talaromyces pinophilus strain M13:A portrayal of novel groundbreaking fungal strain for phytointensification[J].Environmental science and pollution research,2021,28(7):8758-8769.
[12] EL-SHAHIR A A,EL-TAYEH N A,ALI O M,et al.The effect of endophytic Talaromyces pinophilus on growth,absorption and accumulation of heavy metals of Triticum aestivum grown on sandy soil amended by sewage sludge[J].Plants,2021,10(12):1-23.
