赖氨酸琥珀酰化:心血管疾病治疗的新视角
2024-07-08孟阳马毓阳陈明聪张阳赵明一
孟阳 马毓阳 陈明聪 张阳 赵明一

摘要:随着质谱技术、组学技术、抗体技术等鉴定技术的不断发展,翻译后修饰(PTM)在医学领域的研究潜力日益凸显。PTM作为一种新型的化学修饰方式,为科研人员提供了研究疾病的新视角,其中琥珀酰化修饰作为一种备受关注的新型修饰方式,已经引起了越来越多研究者的兴趣。目前,针对琥珀酰化修饰的研究主要集中在一种名为沉默信息调节蛋白5的去琥珀酰化酶上,这种酶在修饰领域中具有重要的作用,且已经对其在心血管领域的作用进行了初步探索。本文将归纳整理琥珀酰化修饰的影响因素、调控作用以及与其他PTM之间的联系,并总结目前在心血管疾病的研究成果,以期深入认识这种修饰的重要作用,为心血管疾病的研究带来新的思考和启示。
关键词:蛋白质琥珀酰化修饰;心血管疾病;翻译后修饰;表观遗传学
中图分类号: R363 文献标识码: A 文章编号:1000-503X(2024)03-0435-09
DOI:10.3881/j.issn.1000-503X.15944
Lysine Succinylation:A New Perspective in the Treatment of Cardiovascular Diseases
MENG Yang,MA Yuyang,CHEN Mingcong,ZHANG Yang,ZHAO Mingyi
Department of Pediatrics,The Third Xiangya Hospital,Central South University,Changsha 410013,China
Corresponding author:ZHAO Mingyi Tel:17773135083,E-mail:zhao_mingyi@csu.edu.cn
ABSTRACT:With the continuous development of identification technologies such as mass spectrometry,omics,and antibody technology,post-translational modification (PTM) has demonstrated increasing potential in medical research.PTM as a novel chemical modification method provides new perspectives for the research on diseases.Succinylation as a novel modification has aroused the interest of more and more researchers.The available studies about succinylation mainly focus on a desuccinylase named sirtuin 5.This enzyme plays a key role in modification and has been preliminarily explored in cardiovascular studies.This paper summarizes the influencing factors and regulatory roles of succinylation and the links between succinylation and other PTMs and reviews the research progress of PTMs in the cardiovascular field,aiming to deepen the understanding about the role of this modification and give new insights to the research in this field.
Key words:protein succinylation;cardiovascular disease;post-translational modification;epigenetics
Acta Acad Med Sin,2024,46(3):435-443
心血管疾病作为全球重要的公共卫生问题之一,其患病率和死亡率一直处于高位。根据全球疾病负担研究统计,心血管发病率在发达国家和发展中国家都在不断上升,相较于高收入国家,中低收入国家的疾病负担更重,且预防措施略显不足。自1990年至2019年,全球心血管疾病患病病例从2.71亿增长到5.23亿,预测到2030年,死于心血管疾病的人数将高达2360万人[1-2]。已有研究证明,蛋白质修饰在心血管疾病的发生发展中起着重要作用,如复杂的糖基化修饰是心血管疾病的一个重要因素,而磷酸化是最广泛的修饰之一,且都与动脉粥样硬化密切相关[3-4]。随着质谱高技术的发展,具有高分辨率和高灵敏度的质谱仪能够鉴定和量化在心血管疾病发展的不同阶段存在的多种蛋白质翻译后修饰(post-translational modification,PTM),这使得研究人员探索更多种类的PTM成为可能[5]。
在功能蛋白质组学中,PTM可以调节蛋白酶的活性,影响蛋白质的结构定位及与其他细胞分子(如蛋白质、核酸、脂质和辅因子)的相互作用,几乎参与了所有细胞生物学过程的调控,如信号转导、细胞周期控制、蛋白质降解等。
人类的基因组只包含20 000至25 000个基因,但人体内的蛋白质组却包含了超过100万个不同的蛋白质,这一巨大的差异主要是由于PTM的存在,极大地丰富了蛋白质组水平的多样性。PTM几乎可以发生在所有的蛋白质上,并且同一种蛋白质可以发生多种不同的PTM,PTM不仅能以指数级的方式扩增蛋白质的种类,同时也为人类生命的复杂性增添了更多的层次。PTM的调控机制是通过将化学基团添加到氨基酸侧链中,从而改变蛋白质的结构、活性和功能,PTM也是细胞生命活动的基本方式之一,并属于表观遗传学的研究范畴[6]。目前已知的PTM多达400多种[7],常见的修饰方式如下:(1)添加官能团,即乙酰化、甲基化、丙酰化、丙二酰化、琥珀酰化、巴豆酰化等;(2)体内糖分子的非酶添加,即糖基化;(3)通过共价键添加其他蛋白质分子,即泛素化、类泛素化、拟素化修饰和原核生物类泛素化修饰等[8-9]。
本文总结了琥珀酰化修饰的影响因素、调控因素以及与其他PTM之间的联系。通过对相关心血管疾病的研究分析,我们发现琥珀酰化修饰在疾病发生发展中起着重要作用,因此,琥珀酰化修饰的研究成果可以为开发特异性心血管疾病治疗靶点提供重要的理论依据和实践指导。
1 琥珀酰化修饰简述
在生物体内,赖氨酸是存在PTM种类最多的一种氨基酸,也是构成蛋白质中唯一一个侧链含有ε-氨基的氨基酸[10]。2011年,研究者通过质谱和蛋白质序列对比,鉴定出了异柠檬酸脱氢酶中的琥珀酰赖氨酸残基,进一步运用4种独立验证方法(质谱、高效液相色谱的共洗脱、体内同位素标记和蛋白质印迹分析)成功证实了琥珀酰赖氨酸肽的存在,首次证实并报道在进化上保守的赖氨酸可被琥珀酰化[11]。2012年有研究又证明了在真核细胞中广泛存在琥珀酰化修饰,并通过对修饰残基进行诱导突变,初步证实了赖氨酸琥珀酰化修饰可促进组蛋白结构和功能都发生改变[12]。琥珀酰基团相较于其他化学基团具有更大的质量,显著影响其结合蛋白质的结构和功能。琥珀酰基与带天然正电荷的赖氨酸残基结合,使赖氨酸带上负电荷(这一过程被称为电荷反转),也会导致蛋白质的性质、结构、功能发生变化[13]。琥珀酰化修饰主要发生在非组蛋白(如线粒体蛋白)和组蛋白的赖氨酸残基上。琥珀酰化修饰是一种重要的蛋白质翻译后修饰,是琥珀酰基供体通过酶学或非酶学的方式共价结合到赖氨酸残基上的过程。有研究报告了线粒体基质的pH和酰基辅酶A浓度足以诱导非酶琥珀酰化,也发现非乙酰化的牛血清白蛋白与0.5 mmol/L琥珀酰辅酶A孵育会导致赖氨酸琥珀酰化的pH依赖性增加,这些结果表明线粒体内酰基辅酶A水平和pH值是发生非酶促反应的关键因素[14-15]。琥珀酰辅酶A作为一种高反应性代谢物,能够转化为活性酸酐中间体,与游离赖氨酸ε-氨基基团发生反应,形成非酶琥珀酰化蛋白质,通过研究琥珀酰基辅酶A生成和代谢途径及与蛋白质的反应性,会有助于理解赖氨酸琥珀酰化修饰在蛋白质形成的作用[16]。
2 琥珀酰化修饰的影响因素
2.1 琥珀酰基转移酶
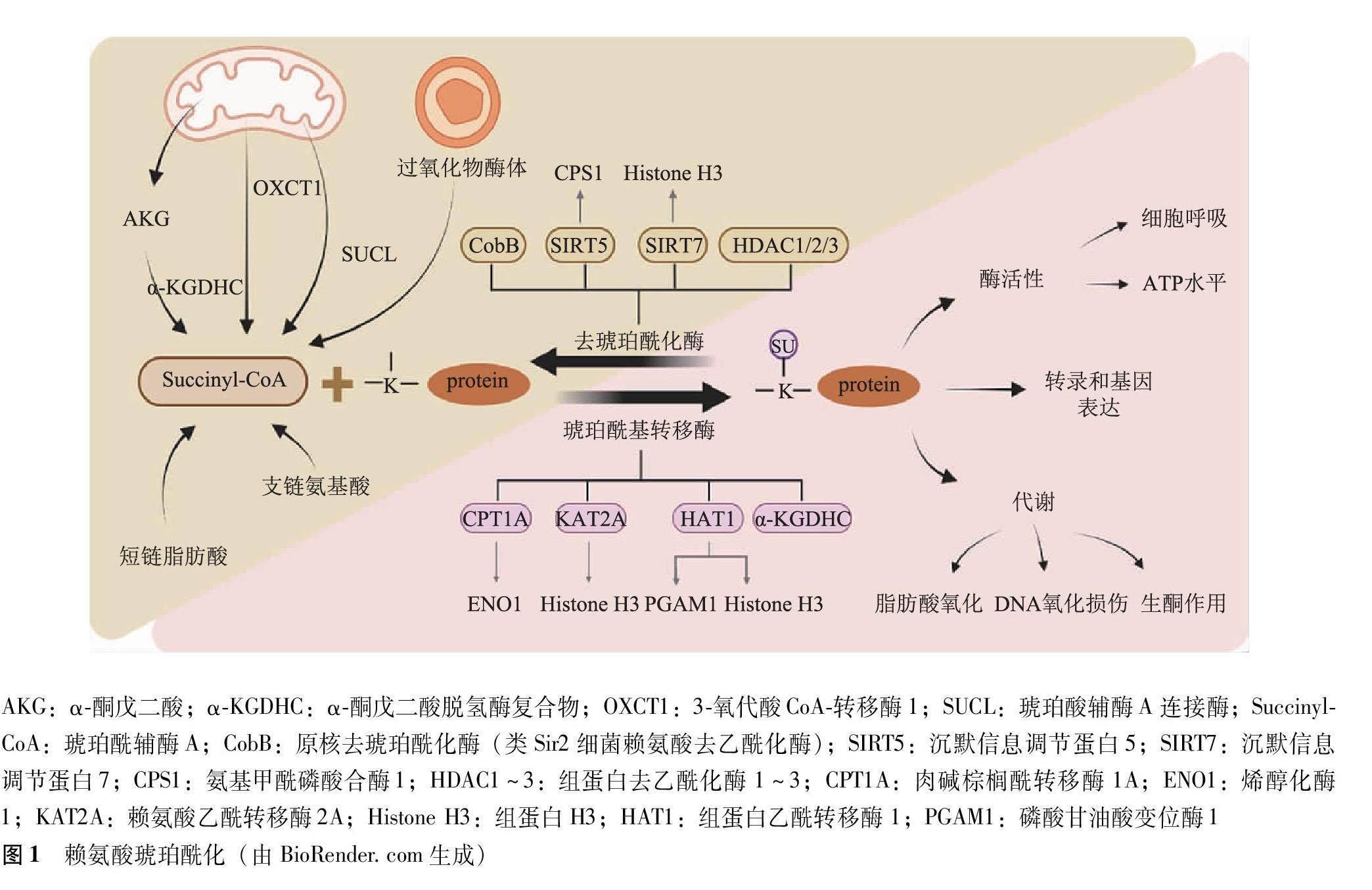
肉碱棕榈酰转移酶1A在体内和体外均具有赖氨酸琥珀酰转移酶活性。肉碱棕榈酰转移酶1A作为一种赖氨酸琥珀酰转移酶,在抑制烯醇化酶1的酶活性和促进谷氨酰胺耗尽下的细胞增殖方面不受经典的肉碱棕榈酰转移酶活性的影响[17]。α-酮戊二酸脱氢酶复合物具备一种反式琥珀酰化酶的功能,可以通过α-酮戊二酸依赖性方式介导琥珀酰化,进而调控细胞的代谢过程[18-19]。核α-酮戊二酸脱氢酶偶联的赖氨酸乙酰转移酶2A作为琥珀酰基转移酶,可催化组蛋白(H3 K79)位点上发生琥珀酰化反应,尤其在基因转录起始位点附近这一修饰频繁发生。有研究还将内源性赖氨酸乙酰转移酶2A耗尽,将含有重构表达赖氨酸乙酰转移酶2A(Tyr645Ala)突变蛋白的人神经胶质瘤细胞(U87)注射到无胸腺裸鼠脑内,发现突变蛋白的表达会抑制脑肿瘤生长,研究者从表达这些突变蛋白的肿瘤中提取出组蛋白,并进行免疫印迹分析,结果显示组蛋白(H3 K79)琥珀酰化减少[20]。Yang等[21]采用定量蛋白质组学方法研究人肝癌细胞株(Hep G2)中的琥珀酰化过程,证明组蛋白乙酰转移酶1不仅能够催化组蛋白(H3 K122)位点发生琥珀酰化以进行表观遗传调控和基因表达,还可以在K99上催化非组蛋白-磷酸甘油酸变位酶1的琥珀酰化,从而有助于糖酵解。另外,组蛋白乙酰转移酶1异常高表达与肝癌、胰腺癌和胆管癌等多种肿瘤的发生发展有关,其介导的琥珀酰化也能够促进肿瘤生长(图1)。
2.2 去琥珀酰化酶
在2013年,研究人员发布了野生型大肠杆菌中首个最全面的赖氨酸琥珀酰化蛋白数据集。进一步的研究表明,原核去琥珀酰化酶是一种类似于沉默信息调节蛋白(sirtuin,SIRT)2的酶,也是一种类Sir2细菌赖氨酸去乙酰化酶,因此同时具有去乙酰化酶的功能。在高葡萄糖培养基存在的情况下,大肠杆菌细胞中赖氨酸琥珀酰化比赖氨酸乙酰化经历更多的动态变化[22-23]。SIRT5和SIRT7是目前已知的真核生物中的去琥珀酰化酶,其中,SIRT5具有烟酰胺腺嘌呤二核苷酸依赖的脱乙酰酶活性,以及较强的脱丙二酰化酶和去琥珀酰化酶活性,氨基甲酰磷酸合酶1是其已知靶标之一[24]。SIRT5主要负责线粒体蛋白的去琥珀酰化,这一过程可以影响多种代谢途径,如脂肪酸β氧化、酮体生成和细胞呼吸等[25-26]。有研究表明SIRT7也是一种烟酰胺腺嘌呤二核苷酸依赖性组蛋白去琥珀酰化酶,以多聚ADP核糖聚合酶1依赖性方式募集到DNA双链断裂中,催化其中组蛋白(H3 K122)的去琥珀酰化,从而有助于染色质凝集和DNA双链断裂修复。相反地,如果SIRT7缺失,就会损害染色质凝集,使细胞对基因毒性应激更加敏感[27]。I类组蛋白去乙酰化酶1~3是哺乳动物细胞中主要的组蛋白去琥珀酰化酶,纯化的内源性I类组蛋白去乙酰化酶复合物在体外也具有强大的组蛋白去琥珀酰化酶活性。Li等[28] 经比较不添加和添加纯化的I类组蛋白去乙酰化酶的反应中琥珀酰化组蛋白肽的数量,发现前者反应中组蛋白(H2A/H3/H4)有11个琥珀酰化位点,而后者反应中未检测到琥珀酰化组蛋白肽,即I类组蛋白去乙酰化酶在组蛋白去琥珀酰化中具有广泛的位点特异性。此外,组蛋白琥珀酰化在启动子区域高度富集,并与基因转录活性呈正相关(图1)。
2.3 琥珀酰化供体
琥珀酰辅酶A、琥珀酸作为三羧酸循环的中间代谢产物,可以成为琥珀酰基团的来源。常见的琥珀酰辅酶A产生途径:(1)α-酮戊二酸脱氢酶复合物催化α-酮戊二酸氧化脱羧生成琥珀酰辅酶A。(2)线粒体基质
内,琥珀酸辅酶A连接酶催化的反向反应能够补充琥珀酰辅酶A。(3)支链氨基酸(缬氨酸、异亮氨酸)、蛋氨酸、胸腺嘧啶和奇数链脂肪酸(可能还有丙酸盐)的分解代谢。(4)3-氧代酸CoA-转移酶1催化辅酶A从琥珀酰辅酶A可逆转移到乙酰乙酸[29]。(5)作为一种短链脂肪酸的琥珀酸能够在细胞代谢过程中合成,可以转化为同源短链酰基辅酶A,也是赖氨酸琥珀酰化的直接供体[30]。(6)在线粒体外过氧化物酶体中也可以产生琥珀酰辅酶A[31]。(7)在红细胞生成晚期,外源性氨基酸在一定条件下也能生成琥珀酰辅酶A[32](图1)。
3 琥珀酰化的调控作用
琥珀酰化在生物体内主要通过对基因表达的调节来实现其功能,这种修饰层面的调节在更长远的方面影响着机体的状况。代谢酶的琥珀酰化修饰可以改变代谢酶的结构和活性,从而影响其催化作用,且这种修饰层面的调节能够快速改变体内的代谢情况。未来研究人员可以以蛋白质组学研究为基础,深入探究三大营养物质代谢和能量代谢中蛋白修饰酶类和底物之间的相互作用网络以及分子机制,揭示这些代谢过程中的关键调控因子,也可将其作为修饰调节靶点,并使用调节修饰酶的抑制剂或激动剂来控制修饰变化,影响着机体的发生发展。这种研究不仅可以增加人类对生物体内复杂调节机制的理解,还可能为开发新的治疗策略提供重要的线索。
3.1 对酶活性的调节
琥珀酰化对于参与代谢的多种酶具有深远影响,如SIRT5通过去琥珀酰化抑制丙酮酸脱氢酶复合物和琥珀酸脱氢酶的活性,从而抑制生化活性和线粒体呼吸[26]。线粒体三功能酶α-亚基是一种参与脂肪酸氧化的蛋白质,SIRT5敲除会导致线粒体三功能酶α-亚基的去琥珀酰化减少,从而降低其活性,造成长链酰基辅酶A积累和ATP产生减少[33]。SIRT5 通过负向调控产生烟酰胺腺嘌呤二核苷酸磷酸的异柠檬酸脱氢酶2的琥珀酰化,导致异柠檬酸脱氢酶2活性降低,这种改变破坏了细胞烟酰胺腺嘌呤二核苷酸磷酸稳态和氧化还原电位,增加了细胞对氧化应激的易感性[34]。α-酮戊二酸脱氢酶可以作为反式琥珀酰化酶,改变三羧酸循环中其他酶的活性[18]。
3.2 对代谢的调节
琥珀酰化修饰对细胞的主要代谢途径产生广泛影响,涵盖了生酮作用、脂肪酸β氧化、三羧酸循环以及ATP合成等过程,这些都是细胞能量代谢网络的核心环节,值得注意的是,琥珀酰化是一个动态的过程,能够随着细胞代谢状态的改变而做出相应的调整[35]。在过氧化物酶体中,SIRT5介导去琥珀酰化抑制酰基辅酶A氧化酶1的活性,对脂肪酸β氧化产生影响。此外,当SIRT5被敲除,会破坏活性氧稳态,进而引发DNA氧化损伤[36]。赖氨酸琥珀酰化通过破坏3-羟基-3-甲基戊二酰辅酶A合酶2的底物结合区改变了酶的活性从而可以负调控生酮作用[25]。Fukushima等[37]对不同日龄新生兔心脏进行灌注,研究由糖酵解转变为脂肪酸氧化这种能量代谢变化中的新型蛋白PTM作用,发现葡萄糖氧化的限速酶丙酮酸脱氢酶和脂肪酸氧化酶中的长链酰基辅酶A脱氢酶的琥珀酰化修饰程度随着年龄增长而增加,同时琥珀酰化也促进了两种酶的活性增强。
3.3 对转录、基因表达的调节
核小体是染色质的基本结构单位,每个核小体由两个亚基构成,每个亚基包括H2A、H2B、H3、H4 4个组蛋白。组蛋白的N末端部分与环境之间相互作用,易受到PTM的影响[38]。早期研究表明,组蛋白氨基琥珀酰化促进核小体核心的转录[39]。组蛋白琥珀酰化在基因启动子处高度富集,启动子组蛋白琥珀酰化与基因转录活性呈正相关[28]。一项研究通过染色质免疫沉淀测序证明了染色质琥珀酰化在基因启动子附近表现出独特的定位模式,并调节基因转录,与基因表达相关,进一步研究发现染色质琥珀酰化将三羧酸循环缺陷与表观遗传转录有效联系起来[40]。组蛋白琥珀酰化通过削弱DNA与组蛋白的亲和力,降低核小体和染色体的稳定性,促进DNA与蛋白质的分离,从而促进转录因子与DNA的结合,进而促进转录[41] 。
4 琥珀酰化与其他PTM之间的联系
当同一个赖氨酸残基上发生多种PTM可以通过串扰或协同作用调节生物过程[42]。有研究通过酒精诱导线粒体蛋白酰化的方法,发现乙酰基和琥珀酰基存在广泛重叠,同时也在同一个赖氨酸残基下鉴定出乙酰化增加,琥珀酰化减少的情况[43]。Rardin 等[25]比较了小鼠肝脏中SIRT3靶向线粒体赖氨酸乙酰化数据集和肝脏线粒体蛋白琥珀酰化数据,发现赖氨酸琥珀酰化和乙酰化位点之间有近80%的重叠,SIRT3和SIRT5的靶向位点也有24%的重叠。SIRT3和SIRT5在共同富集途径中对蛋白质的差异调节可能表明乙酰化和琥珀酰化在调节线粒体代谢网络方面存在串扰或协同作用。琥珀酰化和丙二酰化均受SIRT5调控,有研究也发现56%的线粒体蛋白丙二酰化位点与琥珀酰化位点重叠,并确定了11种蛋白的16个位点被琥珀酰化、乙酰化、丙二酰化修饰,进一步支持了PTM之间的串扰或协同作用在调节生物过程中的重要影响[44]。
5 琥珀酰化在心血管疾病中的研究
5.1 心肌梗死
已有研究证明蛋白酰化与急性心肌梗死存在潜在关联(表1)。有研究在急性心肌梗死小鼠模型中发现肝脏SIRT5的表达水平升高,研究者进一步通过构建肝脏特异性SIRT5过表达小鼠和野生型小鼠进行经心肌缺血造模,以便研究缓解心脏急性缺血的机制,结果发现肝脏SIRT5过表达小鼠的心肌梗死和心肌纤维化面积明显小于野生型,但成纤维细胞生长因子21分泌入血量会增加,推测在心肌缺血模型中SIRT5是通过肝-心串扰机制来发挥心脏保护作用的[45]。线粒体是细胞内氧化磷酸化和合成三磷酸腺苷的主要场所,在维持细胞存活、细胞死亡和细胞代谢稳态方面发挥重要作用。Takada等[46]研究发现,在心肌梗死小鼠模型中线粒体琥珀酰辅酶A水平降低,氧化磷酸化功能受到损害,使用5-氨基乙酰丙酸可恢复琥珀酰辅酶A水平和氧化磷酸化能力。慢性心力衰竭中存在琥珀酰辅酶A含量的降低,这可能也造成线粒体蛋白琥珀酰化减少,但有意思的是,与对照组相比某些单个线粒体蛋白修饰程度却增加,在添加琥珀酰辅酶A后,这些蛋白的琥珀酰化水平又会降低,因此这种修饰过程在心肌梗死后慢性心力衰竭病程中可能受损。最新一项研究探究了与急性心肌梗死相关的膜修复因子Mitsugumin 53(以下简称MG53)经PTM后,对心肌细胞凋亡和炎症的影响,证明了MG53 K130琥珀酰化被赖氨酸乙酰转移酶3B促进,并被 SIRT7抑制,而MG53的琥珀酰化位点与泛素化位点相同,其琥珀酰化也会促进泛素化,从而诱导MG53降解,并抑制蛋白质水平,加剧缺氧/复氧诱导的心肌细胞损伤,因此研究者可以利用SIRT7的去琥珀酰化作用,抑制MG53泛素化,并上调蛋白水平,实现靶向治疗心肌梗死[47]。
5.2 心肌缺血
2015年有研究采用蛋白质组学和质谱相结合的方法,对敲除SIRT5的小鼠和正常小鼠心脏的线粒体蛋白总琥珀酰化赖氨酸含量进行了分析,一系列数据表明敲除SIRT5后,代谢途径中的蛋白质广泛存在琥珀
酰化修饰,而SIRT5的缺失直接影响心脏缺血再灌注的梗死面积,其中致病的关键在于琥珀酸脱氢酶活性增加[48]。在2020年,Ali等[49]分别分离了由缺血性心肌病引起的心力衰竭患者心脏和非衰竭供体心脏的肌原纤维,定量分析其中的琥珀酰化赖氨酸残基,结果表明心力衰竭患者的琥珀酰化修饰减少,证实缺血性心力衰竭心脏中肌原纤维蛋白琥珀酰化减少可能是由于琥珀酰辅酶A的产生减少。
5.3 肥厚性心肌病
SIRT5的去琥珀酰化酶活性在维持心脏代谢方面发挥重要作用,SIRT5缺乏会导致小鼠体内生化代谢发生异常,且与对照组相比,SIRT5敲除小鼠在横主动脉收缩引起的压力超负荷模型中会加速发展为心功能障碍,这揭示了SIRT5是在心脏超负荷情况下维持正常代谢的关键分子[50]。当敲除SIRT5 后,线粒体三功能酶α-亚基作为一种参与脂肪酸氧化的蛋白质,其活性下降,小鼠心脏脂肪酸氧化和ATP产生受损,从而发展为肥厚性心肌病[33]。研究者通过对琥珀酰化蛋白进行GO富集分析和KEGG通路富集分析,在小鼠横纹肌肥大和心脏肥大处发现大量琥珀酰化蛋白,这些蛋白主要参与氧化磷酸化途径[51]。有研究发现全身SIRT5敲除的小鼠在暴露于慢性压力超负荷时死亡率增加,但死亡率增加是由于SIRT5分子的心脏内在效应还是心脏外效应尚未有定论。Hershberger等[52]开发了一种经他莫昔芬诱导的心脏特异性 SIRT5 敲除小鼠模型,通过对其心脏进行琥珀酰化蛋白质组学定量分析,发现在SIRT5消融15至31周时氧化代谢蛋白的琥珀酰化增加,相较于暴露于慢性压力超负荷的全身SIRT5敲除小鼠,心脏特异性SIRT5敲除小鼠与对照组之间的存活率并没有显著差异,因此全身SIRT5敲除小鼠接受主动脉弓缩窄手术后,其表型可能受到SIRT5在心脏外组织中作用的影响。
5.4 心房颤动
2018年Bai等[53]提出一个假设:线粒体中发生的可逆性琥珀酰化也许能够调节心房颤动中能量代谢受损。随后2019年,Bai等[54]使用高效液相色谱-联质谱和免疫印迹技术分析心房颤动患者与窦性心律患者蛋白质琥珀酰化水平,发现这两组患者的蛋白质琥珀酰化水平不仅存在显著差异,而且大多数差异表达的蛋白与能量代谢有关,这项研究进一步表明,琥珀酰化可能参与了瓣膜性心脏病患者的心房颤动过程。
5.5 心肌纤维化
心肌纤维化是心力衰竭发生中的一个显著的病理变化,可导致心脏收缩和舒张功能受损,进而促进心功能不全[55]。为了验证槲皮素在治疗心肌纤维化和心力衰竭中的有效性,研究者在主动脉弓缩窄诱发的心肌纤维化和心力衰竭小鼠模型的基础上腹腔注射槲皮素,与对照组相比,发现槲皮素能够保护心肌组织并改善心脏功能。同时体外实验也发现槲皮素可以通过调节氧化应激来保护小鼠心房肌-1细胞免受高葡萄糖诱导的炎症损伤。此外,槲皮素还可以维持线粒体呼吸链功能和线粒体稳态,从而改善细胞活性,这种改善作用与SIRT5介导的异柠檬酸脱氢酶2去琥珀酰化有关[56]。这些都表明药用植物在治疗心血管疾病方面具有独特的作用。
5.6 主动脉疾病
血管平滑肌细胞丢失、细胞外基质破坏和炎性细胞浸润会导致主动脉瘤和主动脉夹层的发生,这两种疾病都具有高发病率和死亡率[57-58]。2023年,Zhang等[59]首次关注到了主动脉中蛋白质赖氨酸琥珀酰化的情况:(1)采用4D无标记技术评估主动脉瘤和主动脉夹层患者主动脉组织中赖氨酸琥珀酰化的整体特征,研究结果显示,与对照组相比,主动脉瘤和主动脉夹层患者主动脉组织中蛋白质琥珀酰化显著升高,通过对差异赖氨酸琥珀酰化蛋白及位点进行了大量生物信息学分析发现这些差异修饰蛋白质主要定位于线粒体和细胞质中,并参与多种能量代谢过程。(2)通过建立体外血管平滑肌细胞赖氨酸琥珀酰化模型,观察到琥珀酰化调节了3种关键代谢酶(丙酮酸激酶、乳酸脱氢酶A和琥珀酸脱氢酶亚基A)的活性变化,最终得出赖氨酸琥珀酰化可能通过调节能量代谢途径促进主动脉瘤和主动脉夹层的发生的结论,这项研究为琥珀酰化在治疗主动脉疾病方面提供了新的方向和思考。此外,Zhang等[60]还通过串联质谱标签标记和质谱分析了胸主动脉瘤组和胸主动脉夹层组与对照组相比存在的差异表达蛋白质。该研究发现,虽然在两个比较组间存在197种差异表达蛋白,但与从文献综述和AmiGO数据库查找到的琥珀酰化相关蛋白重叠的只有一种蛋白,即3-氧代酸CoA-转移酶1。由于在主动脉瘤和主动脉夹层中3-氧代酸CoA-转移酶1的机制可能涉及氧化应激、酮体代谢、自噬等多因素的调节,故仍需要进一步探索3-氧代酸CoA-转移酶1的作用。
6 总结展望
赖氨酸琥珀酰化修饰作为一种PTM,极大地增加了蛋白质组的功能多样性,并与细胞正常的生命活动和多种疾病机制密切相关。随着质谱技术的发展和广泛应用,这种新型琥珀酰化修饰成为研究线粒体功能障碍疾病快速发展的热点方向。赖氨酸琥珀酰化修饰在心肌梗死、心肌缺血、肥厚性心肌病、心房颤动、心肌纤维化和主动脉疾病中都发挥了重要作用。目前关于琥珀酰化在心血管疾病方面特定蛋白靶点的研究仍然较少,因此,深入阐明蛋白靶点的琥珀酰化修饰机制以及PTM之间的串扰或协同作用,可以更清晰地认识疾病的发生发展,进而为临床治疗提供新的理论依据。此外,SIRT蛋白家族的调节剂(抑制剂和激活剂)也是未来研究的方向,靶向调节剂作为临床治疗剂还需要不断探索、开发和验证。
利益冲突 所有作者声明无利益冲突
作者贡献声明 孟阳:设计和撰写论文;马毓阳:论文图表制作;陈明聪、张阳:论文修订;赵明一:申请基金资助和指导论文撰写,并同意对研究工作诚信负责
参 考 文 献
[1]Roth GA,Mensah GA,Johnson CO,et al.Global burden of cardiovascular diseases and risk factors,1990-2019:update from the GBD 2019 study[J].J Am Coll Cardiol,2020,76(25):2982-3021.DOI:10.1016/j.jacc.2020.11.010.
[2]Balakumar P,Maung UK,Jagadeesh G.Prevalence and prevention of cardiovascular disease and diabetes mellitus[J].Pharmacol Res,2016,113(Pt A):600-609.DOI:10.1016/j.phrs.2016.09.040.
[3]van den Boogert MAW,Larsen LE,Ali L,et al.N-glycosylation defects in humans lower low-density lipoprotein cholesterol through increased low-density lipoprotein receptor expression[J].Circulation,2019,140(4):280-292.DOI:10.1161/CIRCULATIONAHA.118.036484.
[4]Jagavelu K,Tietge UJ,Gaestel M,et al.Systemic deficiency of the map kinase-activated protein kinase 2 reduces atherosclerosis in hypercholesterolemic mice[J].Circ Res,2007,101(11):1104-1112.DOI:10.1161/CIRCRESAHA.107.156075.
[5]Hermann J,Schurgers L,Jankowski V.Identification and characterization of post-translational modifications:Clinical implications[J].Mol Aspects Med,2022,86:101066.DOI:10.1016/j.mam.2022.101066.
[6]Gao J,Shao K,Chen X,et al.The involvement of post-translational modifications in cardiovascular pathologies:focus on sumoylation,neddylation,succinylation,and prenylation[J].J Mol Cell Cardiol,2020,138:49-58.DOI:10.1016/j.yjmcc.2019.11.146.
[7]Ramazi S,Zahiri J.Posttranslational modifications in proteins:resources,tools and prediction methods[J].Database (Oxford),202 2021:baab012.DOI:10.1093/database/baab012.
[8]Stastna M,Van Eyk JE.Posttranslational modifications of lysine and evolving role in heart pathologies-recent developments[J].Proteomics,2015,15(5-6):1164-1180.DOI:10.1002/pmic.201400312.
[9]Striebel F,Imkamp F,Ozcelik D,et al.Pupylation as a signal for proteasomal degradation in bacteria[J].Biochim Biophys Acta,2014,1843(1):103-113.DOI:10.1016/j.bbamcr.2013.03.022.
[10]王志鹏,程农壹,梁妍钰,等.蛋白质中新型赖氨酸翻译后修饰的结构简介[J].大学化学,2017,32(12):41-47.DOI:10.3866/PKU.DXHX201708002.
[11]Zhang Z,Tan M,Xie Z,et al.Identification of lysine succinylation as a new post-translational modification[J].Nat Chem Biol,201 7(1):58-63.DOI:10.1038/nchembio.495.
[12]Xie Z,Dai J,Dai L,et al.Lysine succinylation and lysine malonylation in histones[J].Mol Cell Proteomics,2012,11(5):100-107.DOI:10.1074/mcp.M111.015875.
[13]Sreedhar A,Wiese EK,Hitosugi T.Enzymatic and metabolic regulation of lysine succinylation[J].Genes Dis,2020,7(2):166-171.DOI:10.1016/j.gendis.2019.09.011.
[14]Sabari BR,Zhang D,Allis CD,Zhao Y.Metabolic regulation of gene expression through histone acylations[J].Nat Rev Mol Cell Biol,2017,18(2):90-101.DOI:10.1038/nrm.2016.140.
[15]Wagner GR,Payne RM.Widespread and enzyme-independent nepsilon-acetylation and nepsilon-succinylation of proteins in the chemical conditions of the mitochondrial matrix[J].J Biol Chem,2013,288(40):29036-29045.DOI:10.1074/jbc.M113.486753.
[16]Wagner GR,Bhatt DP,OConnell TM,et al.A class of reactive acyl-coa species reveals the non-enzymatic origins of protein acylation[J].Cell Metab,2017,25(4):823-837.e8.DOI:10.1016/j.cmet.2017.03.006.
[17]Kurmi K,Hitosugi S,Wiese EK,et al.Carnitine palmitoyltransferase 1a has a lysine succinyltransferase activity[J].Cell Rep,2018,22(6):1365-1373.DOI:10.1016/j.celrep.2018.01.030.
[18]Gibson GE,Xu H,Chen HL,et al.Alpha-ketoglutarate dehydrogenase complex-dependent succinylation of proteins in neurons and neuronal cell lines[J].J Neurochem,2015,134(1):86-96.DOI:10.1111/jnc.13096.
[19]Hansen GE,Gibson GE.The alpha-ketoglutarate dehydrogenase complex as a hub of plasticity in neurodegeneration and regeneration[J].Int J Mol Sci,2022,23(20).DOI:10.3390/ijms232012403.
[20]Wang Y,Guo YR,Liu K,et al.Kat2a coupled with the alpha-kgdh complex acts as a histone h3 succinyltransferase[J].Nature,2017,552(7684):273-277.DOI:10.1038/nature25003.
[21]Yang G,Yuan Y,Yuan H,et al.Histone acetyltransferase 1 is a succinyltransferase for histones and non-histones and promotes tumorigenesis[J].EMBO Rep,202 22(2):e50967.DOI:10.15252/embr.202050967.
[22]Sun L,Yao Z,Guo Z,et al.Comprehensive analysis of the lysine acetylome in aeromonas hydrophila reveals cross-talk between lysine acetylation and succinylation in luxs[J].Emerg Microbes Infect,2019,8(1):1229-1239.DOI:10.1080/22221751.2019.1656549.
[23]Colak G,Xie Z,Zhu AY,et al.Identification of lysine succinylation substrates and the succinylation regulatory enzyme cobb in escherichia coli[J].Mol Cell Proteomics,2013,12(12):3509-3520.DOI:10.1074/mcp.M113.031567.
[24]Du J,Zhou Y,Su X,et al.Sirt5 is a nad-dependent protein lysine demalonylase and desuccinylase[J].Science,201 334(6057):806-809.DOI:10.1126/science.1207861.
[25]Rardin MJ,He W,Nishida Y,et al.Sirt5 regulates the mitochondrial lysine succinylome and metabolic networks[J].Cell Metab,2013,18(6):920-933.DOI:10.1016/j.cmet.2013.11.013.
[26]Park J,Chen Y,Tishkoff DX,et al.Sirt5-mediated lysine desuccinylation impacts diverse metabolic pathways[J].Mol Cell,2013,50(6):919-930.DOI:10.1016/j.molcel.2013.06.001.
[27]Li L,Shi L,Yang S,et al.Sirt7 is a histone desuccinylase that functionally links to chromatin compaction and genome stability[J].Nat Commun,2016,7:12235.DOI:10.1038/ncomms12235.
[28]Li J,Lu L,Liu L,et al.Hdac1/2/3 are major histone desuccinylases critical for promoter desuccinylation[J].Cell Discov,2023,9(1):85.DOI:10.1038/s41421-023-00573-9.
[29]Dong YN,Mesaros C,Xu P,et al.Frataxin controls ketone body metabolism through regulation of oxct1[J].PNAS Nexus,2022,1(3):pgac142.DOI:10.1093/pnasnexus/pgac142.
[30]Chen XF,Chen X,Tang X.Short-chain fatty acid,acylation and cardiovascular diseases[J].Clin Sci (Lond),2020,134(6):657-676.DOI:10.1042/CS20200128.
[31]Chinopoulos C.The mystery of extramitochondrial proteins lysine succinylation[J].Int J Mol Sci,202 22(11):6085.DOI:10.3390/ijms22116085.
[32]Burch JS,Marcero JR,Maschek JA,et al.Glutamine via alpha-ketoglutarate dehydrogenase provides succinyl-coa for heme synthesis during erythropoiesis[J].Blood,2018,132(10):987-998.DOI:10.1182/blood-2018-01-829036.
[33]Sadhukhan S,Liu X,Ryu D,et al.Metabolomics-assisted proteomics identifies succinylation and sirt5 as important regulators of cardiac function[J].Proc Natl Acad Sci USA,2016,113(16):4320-4325.DOI:10.1073/pnas.1519858113.
[34]Zhou L,Wang F,Sun R,et al.Sirt5 promotes idh2 desuccinylation and g6pd deglutarylation to enhance cellular antioxidant defense[J].EMBO Rep,2016,17(6):811-822.DOI:10.15252/embr.201541643.
[35]Chen H,Xu H,Potash S,et al.Mild metabolic perturbations alter succinylation of mitochondrial proteins[J].J Neurosci Res,2017,95(11):2244-2252.DOI:10.1002/jnr.24103.
[36]Chen XF,Tian MX,Sun RQ,et al.Sirt5 inhibits peroxisomal acox1 to prevent oxidative damage and is downregulated in liver cancer[J].EMBO Rep,2018,19(5):e45124.DOI:10.15252/embr.201745124.
[37]Fukushima A,Alrob OA,Zhang L,et al.Acetylation and succinylation contribute to maturational alterations in energy metabolism in the newborn heart[J].Am J Physiol Heart Circ Physiol,2016,311(2):H347-H363.DOI:10.1152/ajpheart.00900.2015.
[38]Torres-Perez JV,Irfan J,Febrianto MR,et al.Histone post-translational modifications as potential therapeutic targets for pain management[J].Trends Pharmacol Sci,202 42(11):897-911.DOI:10.1016/j.tips.2021.08.002.
[39]Pineiro M,Hernandez F,Palacian E.Succinylation of histone amino groups facilitates transcription of nucleosomal cores[J].Biochim Biophys Acta,1992,1129(2):183-187.DOI:10.1016/0167-4781(92)90485-i.
[40]Smestad J,Erber L,Chen Y,et al.Chromatin succinylation correlates with active gene expression and is perturbed by defective tca cycle metabolism[J].iScience,2018,2:63-75.DOI:10.1016/j.isci.2018.03.012.
[41]Liu J,Shangguan Y,Tang D,et al.Histone succinylation and its function on the nucleosome[J].J Cell Mol Med,202 25(15):7101-7109.DOI:10.1111/jcmm.16676.
[42]Xu HD,Wang LN,Wen PP,et al.Site-specific systematic analysis of lysine modification crosstalk[J].Proteomics,2018,18(9):e1700292.DOI:10.1002/pmic.201700292.
[43]Ali HR,Assiri MA,Harris PS,et al.Quantifying competition among mitochondrial protein acylation events induced by ethanol metabolism[J].J Proteome Res,2019,18(4):1513-1531.DOI:10.1021/acs.jproteome.8b00800.
[44]Nishida Y,Rardin MJ,Carrico C,et al.Sirt5 regulates both cytosolic and mitochondrial protein malonylation with glycolysis as a major target[J].Mol Cell,2015,59(2):321-332.DOI:10.1016/j.molcel.2015.05.022.
[45]Zhou B,Xiao M,Hu H,et al.Cardioprotective role of sirt5 in response to acute ischemia through a novel liver-cardiac crosstalk mechanism[J].Front Cell Dev Biol,202 9:687559.DOI:10.3389/fcell.2021.687559.
[46]Takada S,Maekawa S,Furihata T,et al.Succinyl-coa-based energy metabolism dysfunction in chronic heart failure[J].Proc Natl Acad Sci USA,2022,119(41):e2203628119.DOI:10.1073/pnas.2203628119.
[47]Wang Y,Zhou H,Wu J,et al.Mg53 alleviates hypoxia/reoxygenation-induced cardiomyocyte injury by succinylation and ubiquitination modification[J].Clin Exp Hypertens,2023,45(1):2271196.DOI:10.1080/10641963.2023.2271196.
[48]Boylston JA,Sun J,Chen Y,et al.Characterization of the cardiac succinylome and its role in ischemia-reperfusion injury[J].J Mol Cell Cardiol,2015,88:73-81.DOI:10.1016/j.yjmcc.2015.09.005.
[49]Ali HR,Michel CR,Lin YH,et al.Defining decreased protein succinylation of failing human cardiac myofibrils in ischemic cardiomyopathy[J].J Mol Cell Cardiol,2020,138:304-317.DOI:10.1016/j.yjmcc.2019.11.159.
[50]Hershberger KA,Abraham DM,Martin AS,et al.Sirtuin 5 is required for mouse survival in response to cardiac pressure overload[J].J Biol Chem,2017,292(48):19767-19781.DOI:10.1074/jbc.M117.809897.
[51]Cheng X,Wang K,Zhao Y,et al.Research progress on post-translational modification of proteins and cardiovascular diseases[J].Cell Death Discov,2023,9(1):275.DOI:10.1038/s41420-023-01560-5.
[52]Hershberger KA,Abraham DM,Liu J,et al.Ablation of sirtuin5 in the postnatal mouse heart results in protein succinylation and normal survival in response to chronic pressure overload[J].J Biol Chem,2018,293(27):10630-10645.DOI:10.1074/jbc.RA118.002187.
[53]Bai F,Ma Y,Liu Q.Succinylation as a novel mode of energy metabolism regulation during atrial fibrillation[J].Med Hypotheses,2018,121:54-55.DOI:10.1016/j.mehy.2018.09.018.
[54]Bai F,Tu T,Qin F,et al.Quantitative proteomics of changes in succinylated proteins expression profiling in left appendages tissue from valvular heart disease patients with atrial fibrillation[J].Clin Chim Acta,2019,495:345-354.DOI:10.1016/j.cca.2019.05.002.
[55]Gyongyosi M,Winkler J,Ramos I,et al.Myocardial fibrosis:biomedical research from bench to bedside[J].Eur J Heart Fail,2017,19(2):177-191.DOI:10.1002/ejhf.696.
[56]Chang X,Zhang T,Wang J,et al.Sirt5-related desuccinylation modification contributes to quercetin-induced protection against heart failure and high-glucose-prompted cardiomyocytes injured through regulation of mitochondrial quality surveillance[J].Oxid Med Cell Longev,202 2021:5876841.DOI:10.1155/2021/5876841.
[57]Chakraborty A,Li Y,Zhang C,et al.Programmed cell death in aortic aneurysm and dissection:a potential therapeutic target[J].J Mol Cell Cardiol,2022,163:67-80.DOI:10.1016/j.yjmcc.2021.09.010.
[58]Nienaber CA,Clough RE,Sakalihasan N,et al.Aortic dissection[J].Nat Rev Dis Primers,2016,2:16053.DOI:10.1038/nrdp.2016.53.
[59]Zhang H,Zhang Y,Wang H,et al.Global proteomic analysis reveals lysine succinylation contributes to the pathogenesis of aortic aneurysm and dissection[J].J Proteomics,2023,280:104889.DOI:10.1016/j.jprot.2023.104889.
[60]Zhang Y,Zhang H,Wang H,et al.Tandem mass tag-based quantitative proteomic analysis identification of succinylation related proteins in pathogenesis of thoracic aortic aneurysm and aortic dissection[J].Peer J,2023,11:e15258.DOI:10.7717/peerj.15258.
(收稿日期:2023-11-17)
