掌叶木V-ATP酶C亚基基因克隆及表达模式分析
2024-07-01徐健李雪萍
徐健 李雪萍

【摘 要】 从珍稀濒危植物掌叶木中克隆了一个V-ATP酶C亚基(HbVATP_C)基因,对其生物信息学特征进行了分析,利用荧光定量技术检测了该基因在不同组织和干旱及盐胁迫下的表达模式。结果显示,该基因开放阅读框全长1128 bp,编码 375个氨基酸,蛋白分子量是42.57 kD,等电点为5.44,为亲水性蛋白。HbVATP_C具有典型的V-ATP_C结构域,与其他植物同源性较高。HbVATP_C在掌叶木根、茎和叶等不同组织中均有表达,在幼叶中表达水平显著高于其他部位。干旱胁迫下,该基因表达水平均高于对照,盐胁迫下变化不明显,说明该基因能响应干旱胁迫。为进一步研究该基因在掌叶木中的功能奠定了基础。
【关键词】 掌叶木;V-ATP酶C亚基;基因克隆;表达模式
Cloning and Expression Analysis of a V-ATPase_C Subunit Gene
from Handeliodendron Bodinieri
Xu Jian, Li Xueping*
(Henan University of Science & Technology, Luoyang 471023, China)
【Abstract】 This study cloned a V-ATPase C subunit gene (HbVATP_C) from the rare and endangered plant Handeliodendron bodinieri, analyzed its bioinformatic characteristics, and used qPCR technology to detect the expression pattern of HbVATP_C in different tissues and under drought and salt stress. The results showed that the open reading frame of HbVATP_C is 1128 bp in length, encoding 375 amino acids. The protein has a molecular weight of 42.57 kD, with an isoelectric point of 5.44, and is a hydrophobic protein. HbVATP_C has a typical V-ATP_C domain structure and shows high homology with other plant homologs. HbVATP_C is expressed in various tissues such as roots, stems, and leaves of H. bodinieri. The expression level is significantly higher in young leaves compared to other tissues. The expression level of this gene is higher than that in the control of drought and salt stress, indicating that the gene can respond to environmental stresses. This study lays a foundation for further research on the function of HbVATP_C in H. bodinieri.
【Key words】 Handeliodendron bodinieri; V-ATPase-HbVATP_C subunit; gene cloning; expression Pattern
〔中图分类号〕 Q943 〔文献标识码〕 A 〔文章编号〕 1674 - 3229(2024)02- 0066 - 06
[收稿日期] 2024-03-25
[基金项目] 国家自然科学基金(31600530)
[作者简介] 徐健(1990- ),男,硕士,河南科技大学园艺与植物保护学院助理实验师,研究方向:植物生物学。
[通讯作者] 李雪萍(1980- ),女,博士,河南科技大学园艺与植物保护学院副教授,研究方向:园林植物发育生物学、园林植物种质资源收集与濒危植物保护。
0 引言
Handeliodendron bodinieri (Lévl.) Rehd.是Sapindaceae科、Handeliodendron属的单种,为中国特有的珍稀濒危物种,被列为国家一类保护植物,主要分布在中国西南部广西和贵州交界海拔500~900米的喀斯特林区[1]。掌叶木为落叶阔叶乔木,树形优美、材性优良,是建筑和家具制造的好材料;叶片含有木脂素和类黄酮苷,具有药用价值[2];花果颜色鲜艳可作观赏;种子脂肪含量高,有极高的营养价值与很好的低温流动性,兼具食用价值和工业价值,有望开发为高端食品和生物质柴油[3-4]。囊泡型H+ATPase(V-ATPase)主要存在于真核生物液泡膜系统中,是一个由ATP驱动的质子泵,它利用ATP水解的能量转化为电化学势能,介导氢离子的跨膜转运[5],使液泡酸化并执行重要的细胞功能。V-ATP酶是具有活性的多聚体复合酶,C亚基是其中一个重要的单元[6],主要参与调控V-ATPase活性和微丝骨架的结合[7-8],因此被广泛关注。
干旱和盐胁迫是植物生长发育过程中严重的非生物胁迫因子,V-ATPase是维持细胞内膜不同区块pH差异以保证细胞正常完成生化功能重要因子[9],研究其在逆境胁迫下的调控特性具有一定理论价值。本研究从掌叶木中克隆了一个液泡膜ATPase亚基基因HbVATP_C,对其进行了生物信息学分析和进化分析,并利用实时荧光定量技术检测了该基因在干旱和盐胁迫情况下的表达情况,为后续深入研究该基因功能提供前期基础。
1 材料和方法
1.1 植物材料
本研究所用掌叶木种子由河南科技大学园林实验中心提供,种子处理方法参照前人研究[10]。种子萌发一周后,将幼苗移栽到草炭土中培养6周,期间用霍格兰营养液浇灌。6周后取幼苗的根(主根和侧根)、叶(幼嫩叶、成熟叶和叶柄)、茎(韧皮部和木质部)等不同部位,用于分析目的基因在不同组织表达情况。分别选取长势一致的6周龄幼苗用20% PEG6000和200 mM NaCl浇灌进行干旱和盐胁迫处理,并分别于0 h、12 h、24 h、48 h和72 h收集叶片材料,每个时间点取3个生物学重复。所有材料取材后液氮速冻,置于-80 ℃保存备用。
1.2 RNA提取、反转录与基因扩增
将收集的植物材料研磨成粉末后分别称取100 mg,利用植物总RNA提取试剂盒(北京天根生物有限公司)提取总RNA,用1.5%琼脂糖凝胶电泳检测其质量,然后利用cDNA反转录试剂盒(Takara)合成cDNA第一链。
基于前期研究的掌叶木转录组数据(未发表)筛选V-ATP酶C亚基候选基因,获取其cDNA基因全长序列。利用Primer Premier 5.0软件设计目的基因CDS(编码序列)全长克隆引物(HbVATP_C-f: 5-ATGGCATCTAGATACTGGGC-3和HbVATP_C-r:5
-TCAAACAAGATTGATTGTGAAG-3)。以未处理材料的根、茎和叶混合样本cDNA 为模板,采用PrimeSTAR HS高保真聚合酶(Takara,R010Q)进行扩增。扩增体系25 μL,包含1 μL cDNA模板,12.5 μL PrimeSTAR HS,各0.5 μL正反向引物,10.5 μL ddH2O。PCR反应条件:98 ℃ 预变性 1 min;98 ℃ 变性10 s,58 ℃ 退火15 s,72 ℃延伸45 s,30次循环;72 ℃ 延伸5 min;4 ℃保存。PCR产物用1%琼脂糖凝胶电泳检测并拍照,对符合预期大小的片段进行切胶纯化回收,连接至pTOP克隆载体,转化后挑取克隆摇菌,送至生工生物工程(上海)股份有限公司进行测序,将测序得到的序列与模板序列进行比对,分析其相似性。
1.3 生物信息学分析
利用Expasy server (https://www.expasy.org/)的ProtParam和 ProScale工具分析蛋白的分子量(Molecular weight)、等电点(Theoretical pI)、亲水性平均系数(Grand average of hydropathicity,GRAVY)、不稳定指数(Instability index)等。利用 SMART(http://smart.embl-Heidelberg.de) 在线网站预测该蛋白的功能结构域。利用SOPMA工具[11]进行蛋白质二级结构预测,SWISS models(https://swissmodel. expasy. org/)进行蛋白质三级结构预测[12]。
1.4 同源性分析
利用植物基因组网站Phytozome(V13)(https://phytozome-next.jgi.doe.gov/)BLASTP工具(登陆日期:2024年2月25日),基于目标基因蛋白序列在苔藓(Physcomitrium patens)、拟南芥(Arabidopsis thaliana)和玉米(Zea mays)等不同进化地位的物种基因组中进行同源序列检索并下载相应序列,使用 MEGA6软件[13]进行序列相似性比对,并使用邻接法(neighbor-joining)构建系统树,分析掌叶木V-ATP酶C亚基基因的系统进化地位。
1.5 表达分析
根据测序结果,设计HbVATP_C基因的荧光定量引物(RT-HbVATP_C-f: 5-AGCTAAACAGAGGGG
AAA-3, RT-HbVATP_C-r: 5-GAAGACACCGCCCA
GTATC-3),以Actin为内参基因(RT-Actin-f: 5
-CGATGAATCTGGGCCAGCTAT-3,RT-Actin-r: 5
-TAAACCGGAGCTGACCAAACT-3)。以胁迫后12 h、24 h、 48 h、72 h掌叶木叶片材料cDNA为模板,0 h材料为对照,利用2×M5 HiPer SYBR Premix EsTaq荧光定量试剂盒(北京聚合美,MF787)进行表达量检测。每个样品3次生物学重复。反应体系和程序参照说明书进行,根据2-ΔΔCt法计算掌叶木HbVATP_C基因在干旱胁迫后的相对表达变化。
2 结果与分析
2.1 HbVATP_C基因克隆
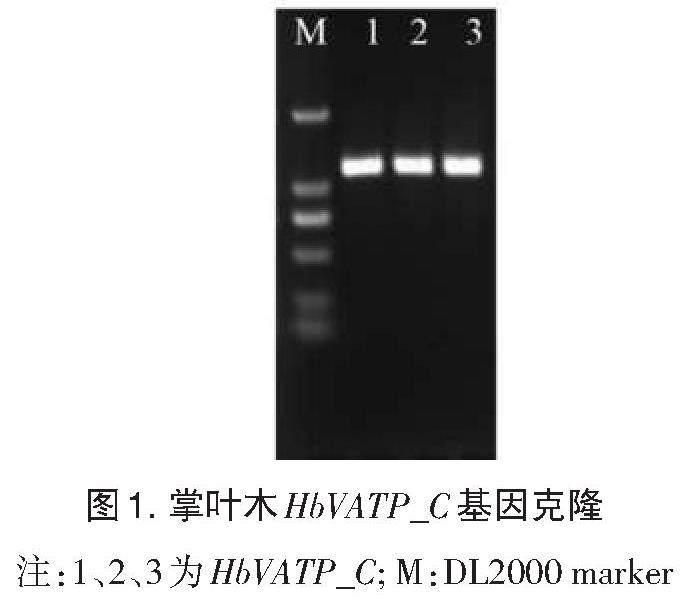
以掌叶木未处理叶片样品的cDNA为模板,利用基因全长克隆引物进行 PCR扩增,电泳分析结果显示扩增条带约为 1100 bp(图1),测序结果显示该基因全长1128 bp,编码 375个氨基酸,将其命名为HbVATP_C。
2.2 HbVATP_C生物信息学分析
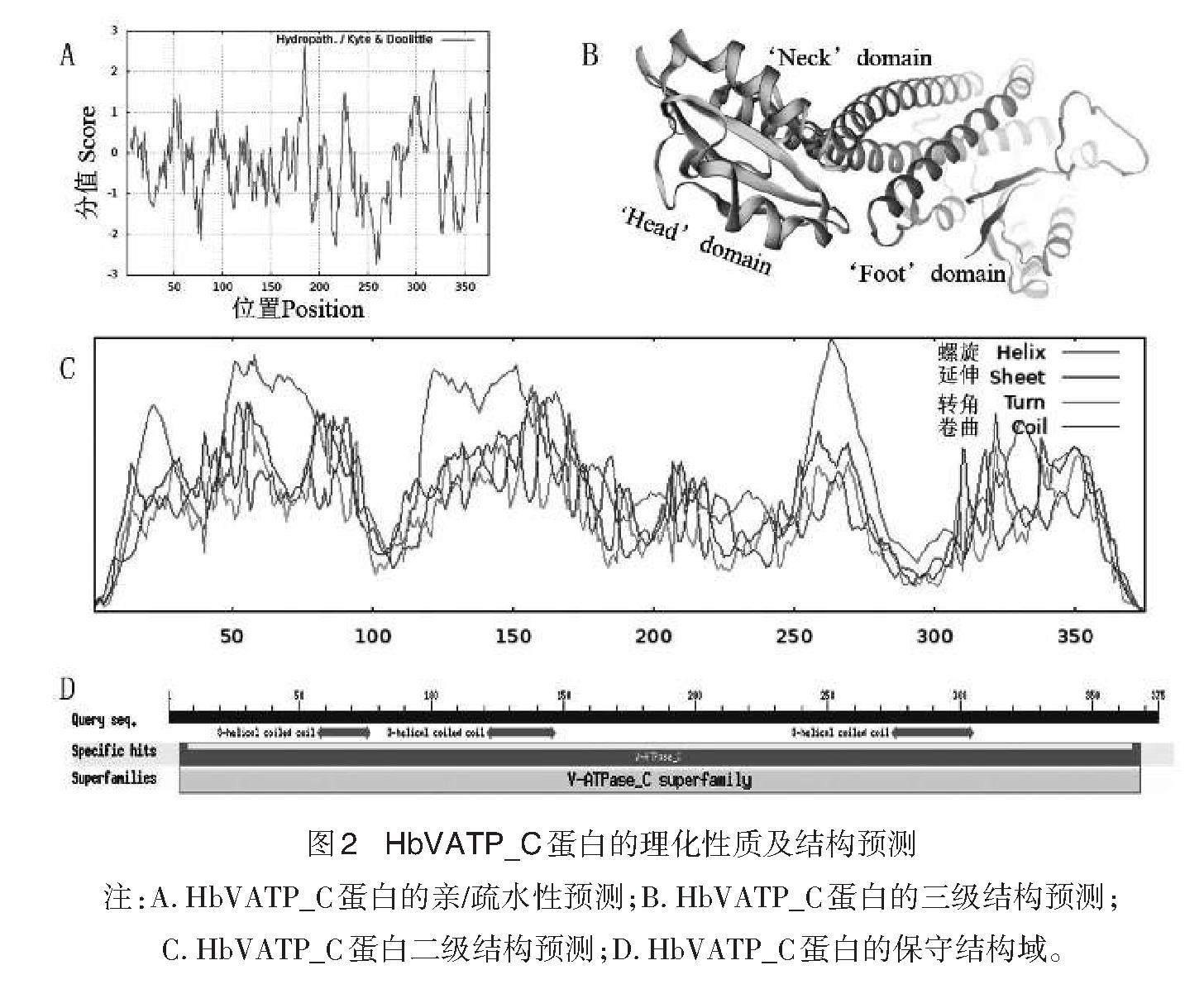
使用ExPASy在线工具对HbVATP_C蛋白进行理化性质分析,结果显示,HbVATP_C蛋白的分子量是42.57 kD,等电点为5.44,为酸性蛋白。不稳定指数(instability index)是51.17(>40),属于不稳定蛋白。亲水性平均系数(Grand average of hydropathicity,GRAVY)是-0.307,说明该蛋白为亲水性蛋白(图2-A)。信号肽主要由疏水性氨基酸组成,运用SignalP4.1 server进行HbVATP_C信号肽分析,发现该序列不存在信号肽,TMHMM Serverv 2.0预测结果表明HbVATP_C无跨膜区(图未显示)。蛋白二级结构预测分析显示(图2-C),HbVATP_C蛋白二级结构中,α螺旋(Alpha helix)区域占比最高,为全部氨基酸的58.67%(220个);48个氨基酸参与形成延伸链(Extended strand),占比的12.8%;β转角(β turn)占4.27%;不规则卷曲(Random coil)共计91个,占比24.27%。基于同源建模的SWISS model预测显示(图2-B)HbVATP_C蛋白质三级结构与模板(V-type proton ATPase subunit C,SMTL ID: 7uw9.1.2)之间的序列同源性为 88.27%,且以α螺旋和不规则卷曲为主要结构。利用NCBI网站保守结构域分析工具(Conserved Domain Search)分析HbVATP_C蛋白的保守结构域,结果显示,该蛋白具有V-ATP_C保守结构域(图2-D),表明该蛋白属于V-ATP类蛋白家族成员。
2.3 HbVATP_C序列相似性分析和系统发育树分析
选取苔藓植物、单子叶植物和双子叶植物等不同进化水平的12种代表性物种,利用同源检索方法下载选定物种中的同源基因的氨基酸序列并进行多重序列比对,结果如图3所示。掌叶木HbVATP_C蛋白与其他物种VATP-C具有较高的一致性,整体相似度为85.52%,说明这些蛋白在进化上非常保守,暗示它们在植物进化过程中发挥重要的作用。其中,与桃(Prunus persica)Prupe.3G312200.1.p、棉花(Gossypium hirsutum)Gohir.D11G067700.1.p、杨树Populus trichocarpa)Potri.017G061100.1和葡萄(Vitis vinifera)VIT_214s0068g01280.2的相似度分别为87.77%、87.2%、86.97%、86.13%,说明它们可能执行相似的功能。利用MEGA6.0软件将上述同源蛋白序列进行系统发育树构建和遗传距离分析,结果如图4所示。13个参试物种VATP-C基因编码蛋白经聚类可分为两大分支,小立碗藓(Physcomitrium patens)、玉米(Zea mays)和水稻(Oryza sativa)被分为一类,掌叶木和其他物种被聚在另外一个分支,说明它们亲缘关系较近,与苔藓植物和单子叶植物水稻、玉米等同源性较远。
2.4 HbVATP_C基因表达模式分析
利用荧光定量PCR分析HbVATP_C基因在掌叶木幼苗根(主根和侧根)、叶(幼嫩叶、成熟叶和叶柄)、茎(韧皮部和木质部)等部位的相对表达量,结果表明,HbVATP_C在各部位均有表达,但在叶片中表达量明显高于其他部位,幼嫩叶片中表达量最高(图5)。为了探究HbVATP_C基因对干旱和盐胁迫的响应,对掌叶木在干旱、盐胁迫条件下的表达响应模式进行分析。结果如图6-A所示,干旱处理后,HbVATP_C表达量显著提高,在12小时时表达量上调到2.6倍,48小时后达到最高值4.7倍。在盐胁迫条件下,HbVATP_C表达量变化趋势不明显,在12小时达到对照组的1.6倍(图6-B)。
3 结论与讨论
V-ATP酶分布广泛且结构复杂,首次被发现是在酵母液泡膜上,是一种运输质子的ATP酶,对细胞的生理功能有重要作用,参与细胞的生长、细胞内酸化调节和物质的转运[14-15]以及多种信号传导的过程[16]。目前,编码V型 ATP酶复合体的12个基因均已被识别[17],其中C亚基主要参与调控V型ATP酶活性和微丝骨架的结合,一直是关注热点。
本研究基于转录组数据,利用PCR技术扩增获得掌叶木HbVATP_C基因,编码375个氨基酸,蛋白的分子量是42.57 kD,等电点为5.44。HbVATP-C无信号肽,为亲水性蛋白。该蛋白属于不稳定蛋白,二级结构原件包括α螺旋(58.67%)、延伸链(12.8%)和β转角(4.27%),不规则卷曲(24.27%),α螺旋和不规则卷曲是二级结构的主要元件。该蛋白在植物中具有较高的保守性,序列比对显示该蛋白与桃、棉花、杨树和葡萄同源蛋白的相似度非常高,系统发育树也显示它们具有较近的亲缘关系。
为对HbVATP_C的表达情况进行确定分析,利用荧光定量技术进行检测。结果显示,该基因在掌叶木的主根、侧根、韧皮部、木质部、叶、叶柄等不同部位均有表达,但在嫩叶中表达量最高,说明该基因具有时空表达差异性。V-ATP_C对逆境胁迫响应灵敏,在胁迫发生后,其转录水平迅速提高[18],说明V-ATP酶C亚基可能在逆境胁迫中起重要作用。研究发现,在干旱胁迫后的12小时,HbVATP_C表达水平即提升为对照组的2倍以上,并在48小时内保持高水平表达;在盐胁迫下,HbVATP_C表达水平也有适当上调,12小时后,转录水平提高到对照组的1.6倍。这些结果初步说明,HbVATP_C基因可能参与掌叶木应答干旱和盐胁迫,但其参与的途径和方式有待进一步研究。
[参考文献]
[1] 熊志斌, 冉景丞, 谭成江,等. 濒危植物掌叶木种子生态特征[J]. 生态学报,2003,23(4):820-825.
[2] 张娜, 郭志勇, 李在留, 等. 掌叶木叶化学成分研究[J]. 三峡大学学报(自然科学版), 2015,37(3):96-99.
[3] 郭松, 李在留, 薛建辉, 等. 掌叶木不同种源种子的经济性状[J]. 林业科学, 2019,55(4):84-96.
[4] 曹丽敏. 珍稀特有植物掌叶木的研究进展[J]. 安徽农业科学, 2009,37(3):1043-1045.
[5] Beyenbach K W, Wieczorek H. The V-type H+ ATPase: molecular structure and function, physiological roles and regulation[J]. Journal of Experimental Biology, 2006,209(4):577-589.
[6] Cipriano D J, Wang Y, Bond S, et al. Structure and regulation of the vacuolar ATPases[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2008,1777(7-8):599-604.
[7] Vitavska O, Wieczorek H, Merzendorfer H. A novel role for subunit C in mediating binding of the H+-V-ATPase to the actin cytoskeleton[J]. Journal of Biological Chemistry, 2003,278(20):18499-18505.
[8] Drory O, Frolow F, Nelson N. Crystal structure of yeast V-ATPase subunit C reveals its stator function[J]. EMBO reports, 2004,5(12):1148-1152.
[9] Hong-Hermesdorf A, Brüx A, Grüber A, et al. A WNK kinase binds and phosphorylates V-ATPase subunit C[J]. FEBS letters, 2006,580(3):932-939.
[10] 李樱花, 郭松, 李在留, 等. 掌叶木种皮障碍及种子各部位内源抑制活性的研究.[J]. Guihaia, 2016,36(4): 443-448+470.
[11] Geourjon C, Deleage G. SOPMA: significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments[J]. Bioinformatics, 1995,11(6):681-684.
[12] Blom N, Gammeltoft S, Brunak S. Sequence and structure-
based prediction of eukaryotic protein phosphorylation sites[J]. Journal of molecular biology, 1999,294(5):1351-1362.
[13]Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular biology and evolution, 2013,30(12):2725-2729.
[14]Parra K, Chan C. Yeast phosphofructokinase-1 subunit Pfk2p is necessary for ph homeostasis and glucose-
dependent V-ATPase reassembly: The role of glycolysis[J]. BBA-Bioenergetics, 2014(1837):e113.
[15] Schumacher K, Krebs M. The V-ATPase: small cargo, large effects[J]. Current opinion in plant biology, 2010,13(6):724-730.
[16] Parra K J, Chan C, Chen J. Saccharomyces cerevisiae vacuolar [H+] -ATPase regulation by disassembly and reassembly: one structure and multiple signals[J]. Eukaryotic cell, 2014,13(6):706-714.
[17] Seidel T, Kluge C, Hanitzsch M, et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar [H+]-ATPase in living plant cells[J]. Journal of biotechnology, 2004,112(1-2):165-175.
