娄彻氏链霉菌HM85 的鉴定及其对甜菜的防病促生作用
2024-07-01杨智敏张慧豪张园园杜红岩刘晓东侯亚光王毅徐道龙黄金贵程晓宁随洋王瑞利于超赵玲玲陈春梅雅茹贾丽张明月王宏伟姚淞耀赵莹邵科
杨智敏 张慧豪 张园园 杜红岩 刘晓东 侯亚光 王毅 徐道龙 黄金贵 程晓宁 随洋 王瑞利 于超 赵玲玲 陈春梅 雅茹 贾丽 张明月 王宏伟 姚淞耀 赵莹 邵科

摘要:由甜菜尾孢菌(Cercospora beticola)引起的甜菜褐斑病是一种广泛发生、危害严重的真菌性病害,严重制约了我国糖料产业的发展。为挖掘对甜菜褐斑病具有生防应用潜力的拮抗菌株,从内蒙古自治区呼伦贝尔黑土地采集甜菜健康植株根际土壤样本,通过梯度稀释平板法和对峙培养法进行分离、纯化、筛选,获得1株具有良好拮抗效果的菌株HM85。基于其形态学特征和生理生化特征,结合16S rRNA基因序列分析将菌株HM85鉴定为娄彻氏链霉菌(Streptomyces rochei)。平板对峙试验结果显示,菌株HM85对甜菜尾孢菌HB2-2-2菌株的生长有明显抑制作用,抑菌率为58.68%。盆栽试验结果表明,HM85在防治甜菜褐斑病的同时对甜菜植株具有一定的促生作用,株高、株鲜重、根长、根鲜重和根直径与对照组相比分别增加22.73%、20.47%、36.10%、32.52%和75.03%。由此可见,娄彻氏链霉菌HM85具有作为促生菌剂和生防菌剂的研发潜力。
关键词:娄彻氏链霉菌;甜菜尾孢菌;甜菜褐斑病;拮抗活性;促生作用
doi:10.13304/j.nykjdb.2024.0144
中图分类号:S182 文献标志码:A 文章编号:10080864(2024)05014808
食糖被列为国家的重要战略储备,对我国经济发展和人民生活有着非常重要的意义。甜菜(Beta vulgaris L.)作为主要糖料作物之一,其产糖量约占世界年产糖量的25%[1]。甜菜褐斑病(Cercospora leaf spots,CLS)是由甜菜尾孢菌(Cercospora beticola Sacc.)引起的叶部病害,在世界范围内最具破坏性,影响1/3以上的甜菜种植区[23]。该病在我国东北、华北和西北三大甜菜产区发病普遍,每年均有不同程度的发生,一般可使块根减产15%~20%,含糖率下降0.8~2.0 个百分点,叶茎损失40%~70%[45];病情指数每增加1个单位,根重减少1.3 g,含糖率降低0.046个百分点[6]。
甜菜褐斑病发病初期叶片呈现褐色或紫色小圆斑,随后斑点逐渐扩大,直径达2~5 mm,斑点周围呈褐色。后期病斑中央呈现灰白色霉层,即病菌的分生孢子和分生孢子梗。病斑因发病程度、叶片大小而不同,每片病叶上病斑可达数十个至上千个,病斑连片后,叶片干枯死亡。一般褐斑病先侵染外层生理成熟的叶片,逐渐向中层叶片发展,发病重的外层、中层叶片陆续枯死,影响甜菜的光合作用和养分输送,导致植株生长势衰弱、甜菜块根产量下降、含糖量降低、块根中灰分和有害氮增加、原料产量和质量下降[7] 。
在甜菜种植中,除了选用抗病品种、合理轮作外,褐斑病治以化学防治为主。但化学杀菌剂的长期不合理使用不仅引起环境污染、食品药物残留、非靶标生物毒害等问题,还导致病原菌的选择压力和抗药性增强[8-10]。生物防治是植物病害综合防治的重要措施,可通过有益微生物及其代谢产物调节微生态、直接或间接抑制病原菌生长繁殖等途径达到控制病害的目的,具有环境友好、高效无污染、改善土壤微生态等优点。近年来,利用拮抗菌防治褐斑病的研究越来越被关注。研究发现,多粘芽孢杆菌(Paenibacillus polymyxa)对甜菜褐斑病有抑制作用[7];青霉对尾孢菌(Cercosporabeticola)有抑制作用,其抑制作用与粘合剂水平有关[11];解淀粉芽孢杆菌(Bacillus amyloliquefaciens)TL6对花生褐斑病具有较好的防治效果,其发酵液原液对花生褐斑病防治效果为69.17%[12]。放线菌资源丰富,在土壤中分布广泛,多数可产生抗菌物质,其中链霉菌属及其相似类菌群是植物病害生物防治中最主要的资源。链霉菌是产生抗生素的主要来源,约80%的抗生素应用在农业生产上。链霉菌制成的菌剂已有多种被应用于农业生产,如链霉素、井岗霉素、农抗120、多效霉素、S-921等。放线菌对多种植物病原菌有拮抗作用,如葡萄孢菌、杨树腐烂病菌、灰霉病菌以及白菜软腐病菌等[13]。目前,关于放线菌防治甜菜褐斑病的研究较少,挖掘、筛选和利用拮抗放线菌对甜菜褐斑病进行生物防治具有重要意义。本研究从内蒙古呼伦贝尔黑土地采集甜菜健康植株根际土样,从中分离筛选对甜菜褐斑病病原菌具有拮抗作用的放线菌,旨在为甜菜褐斑病的生物防治奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试甜菜
试验所用甜菜品种为KWS2314,种子由内蒙古敕勒川糖业有限责任公司提供。其属于丰产偏高糖品种,抗病性居于中等水平,为内蒙古产区主栽品种之一。
1.1.2 供试土样
2021年9月,在内蒙古自治区呼伦贝尔甜菜生产田采集甜菜根际土样品2份。每份样本随机选择5株健康甜菜植株,小心用铁锹将植株挖起,使劲摇晃,除去大颗粒土壤。将附着在根上1~5 mm的土壤用无菌滤纸条充分刮取,装于无菌自封袋内,-80 ℃保藏[14]。
1.1.3 供试病原菌
甜菜褐斑病病原菌甜菜生尾孢(Cercospora beticola)HB2-2-2 菌株由河南农业大学植物病害生物防治研究室分离、鉴定和保存。
1.1.4 供试培养基
高氏1号培养基(1 L):淀粉20.0 g、KNO3 1.0 g、Na2HPO4 0.5 g、MgSO4·7H2O0.5 g,NaCl 0.5 g、FeSO4·4H2O 0.01 g、琼脂18.0 g,121 ℃,1×105 Pa高压蒸汽灭菌20 min。PDA培养基(1 L):马铃薯 200.0 g、葡萄糖 20.0 g,琼脂18.0 g。淀粉水解培养基(1 L):可溶性淀粉 10.0 g、NaCl0.5 g、MgCO3 1.0 g、K2HPO4 0.3 g、KNO3 1.0 g,pH调至7.2,琼脂20 g。明胶液化培养基(1 L):明胶200.0 g、葡萄糖 20.0 g、蛋白胨5.0 g,pH调至7.2。牛奶凝固与胨化培养基(1 L):脱脂牛奶1 000 g、CaCO3 0.02 g。纤维素水解培养基(1 L):MgSO4·7H2O 0.5 g、K2HPO4 0.5 g、NaCl 0.5 g、KNO31.0 g,pH调至7.2。碳源利用培养基(1 L):(NH4)2SO42.64 g、K2HPO4 0.5 g、KH2PO4 0.5 g、MgSO4·7H2O0.5 g、CuSO4·5H2O 0.006 4 g、 FeSO4·7H2O 0.001 g、MnCl2·4H2O 0.001 g、ZnSO4·7H2O 0.001 g,pH 调至7.2,琼脂15 g。氮源利用培养基(1 L):葡萄糖10.0 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O0.01 g、KH2PO4 0.1 g,pH调至7.2,琼脂15.0 g。所需试剂均购自天津市铠通化学试剂有限公司。
1.2 试验方法
1.2.1 土样预处理
采集的土壤样品室温自然风干2~3 d后,称取土壤2 g置于装有18 mL灭菌生理盐水的锥形瓶中,放置在摇床150 r·min-1震荡2 h,保存备用。
1.2.2 菌株分离
取预处理土壤悬液1 mL加入9 mL灭菌生理盐水中,依次进行梯度稀释。分别吸取200 μL稀释度10-3和10-4的土壤悬液到分离培养基高氏1号培养基平板上,每个稀释度设置3个重复,用无菌涂布棒均匀涂布,置于生化培养箱(宁波莱福科技有限公司)28 ℃倒置培养。培养5~7 d后,观察菌落生长情况,用接种环挑选单菌落至高氏1号培养皿上纯化培养,并根据菌落形态特征对分离得到的放线菌菌株去重,加入25%(体积分数)甘油在-80 ℃保存备用[15]。
1.2.3 拮抗菌株初筛
以甜菜褐斑病病原菌为靶标菌进行拮抗菌株的筛选。用接种针挑取甜菜生尾孢HB2-2-2菌饼(直径5 mm)置于PDA 平板中央,在其四周 3.0 cm处划线接种不同放线菌纯培养,以单独接种靶标菌为空白对照,在28 ℃培养箱中倒置培养。培养7~10 d后(空白对照菌落直径长至培养皿约3/4处,但未长满),拍照并记录具有拮抗活性的菌株。
1.2.4 拮抗菌株的复筛
根据初筛结果,选择对靶标菌有抑制作用的菌株进行复筛试验。以甜菜生尾孢菌为靶标菌,在距靶标菌(直径5 mm)3.0 cm 处用接种环划线接种初筛中有拮抗活性的菌株,以仅接种靶标菌为空白对照,每个处理设置3个重复。倒置培养7~10 d后,统计菌丝直径并计算菌丝生长抑制率(公式1),从中挑出抑菌效果最佳的菌株进行下一步研究。
1.2.5 形态特征观察
将筛选出的放线菌HM85划线接种于新鲜的高氏1号培养基上,28 ℃倒置培养48 h,拍照并记录生防菌的菌落形状、颜色及边缘形态等特征。
1.2.6 生理生化特性测定
参考《常见细菌系统鉴定手册》[15]中描述的方法对菌株 HM85的碳源和氮源利用、分解纤维素、明胶液化以及产H2S能力等特性进行测定。
1.2.7 16S rRNA基因序列分析
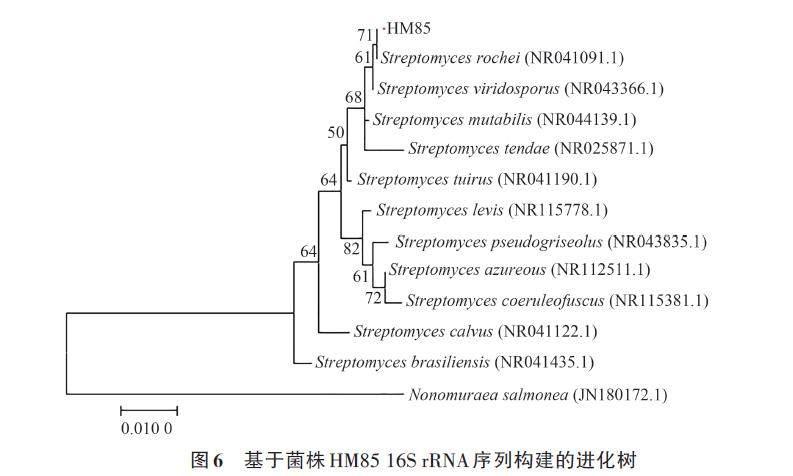
采用CTAB法[15]提取放线菌基因组DNA,利用引物243F(5'-GGATGAGCCCGCGGCCTA-3') 和A3R (5'-CCAGCCCCACCTTCGAC-3')扩增16S rRNA 基因。PCR反应体系:2×PCR mix 12.5 μL,243F/A3R引物各1.0 μL,DNA模板1.0 μL,无菌水9.5 μL。扩增程序:95 ℃ 5 min;94 ℃ 1 min,59 ℃ 30 s,72 ℃1.5 min,35个循环; 72 ℃延伸10 min。将扩增得到的PCR产物用1 %的琼脂糖凝胶电泳进行特异性检测,并送往生工生物工程(上海)股份有限公司进行测序。将获得的序列在NCBI数据库(https://www.ncbi. nlm. nih. gov/)进行BLAST 比对分析。用MEGA7 软件采用极大似然法(maximum likelihood)重复1 000次进行聚类分析并构建系统进化树。
1.2.8 拮抗菌株HM85对甜菜促生效果测定
用无菌土种植甜菜种子,在25 ℃、光照强度为600 lx的温室日夜交替培养30 d(每天黑暗培养8 h,光照培养16 h),在甜菜幼苗第4片叶时,将不同处理的菌液或培养基灌根接种至甜菜根部。处理组A:每株先接种拮抗菌株HM85发酵液15 mL,待24 h 后接种病原菌甜菜生尾孢HB2-2-2 孢子液15 mL(取甜菜生尾孢在PDA平板上生长的菌饼于PDB培养基中180 r·min-1、28 ℃培养7 d,3层滤纸过滤后用血球计数板计数孢子含量,调整孢子含量为1×106 cell·mL-1)。处理组B:每株同时接种灭菌的高氏1号液体培养基和病原菌甜菜生尾孢HB2-2-2孢子液各15 mL。对照组:每株加入灭150菌的高氏1号液体培养基和PDA培养基各15 mL灌根。处理后的甜菜苗在温室中培养,30 d后调查统计株高、根长、根直径、鲜重等生理指标。试验重复3次,每处理8株甜菜苗。
促生效率=(A-B)/B×100% (2)
式中,A 和B 分别为处理组A和处理组B的株高、鲜重和根长等性状。
1.2.9 数据统计和分析
使用Excel进行数据统计和整理,GraphPad Prism8.0.2绘制柱状图,使用IBM SPASS Statistics 26软件进行数据分析,采用单因素ANOVA检验对数据进行差异显著性分析。
2 结果与分析
2.1 拮抗菌株的筛选结果
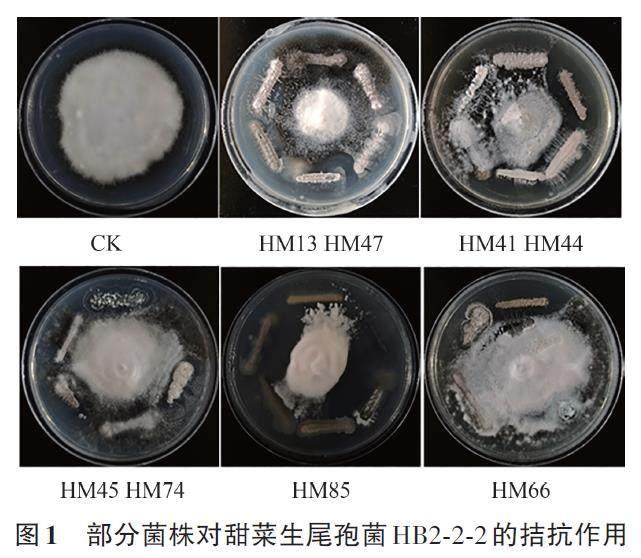
用高氏1号培养基对采集的甜菜根际土样放线菌进行分离、培养,纯化,得到43株放线菌分离物。通过平板对峙法对分离获得的放线菌株进行筛选,获得8株对甜菜褐斑病病原菌甜菜生尾孢HB2-2-2具有抑制效果的拮抗菌株,分别为HM13、HM41、HM44、HM47、HM45、HM66、HM74 和HM85(图1)。
复筛结果(图2和表1)表明,供试的8株放线菌对甜菜褐斑病病原菌菌丝生长的抑菌半径为(0.71±0.03)~(2.37±0.06)cm,抑菌率为(17.56%±0.70%)~(58.68%±1.60%),其中,菌株HM85对甜菜褐斑病病原菌菌丝生长抑制作用最强,抑菌半径为(2.37±0.06) cm,抑菌率为(58.68%±1.60%)。因此,选定菌株HM85进行后续研究。
2.2 菌株HM85 对甜菜的防病促生作用
盆栽实验结果(图3)表明,与空白对照组相比,仅接种甜菜生尾孢菌HB2-2-2孢子液的甜菜植株出现生长势衰弱、叶片发黄等症状,株高、株鲜重、根鲜重、根直径分别降低17.27%、9.83%、14.35%和8.02%。而先接种HM85发酵液再接种HB2-2-2孢子液的甜菜植株长势良好,同时叶片呈绿色无发黄症状。
如图4所示,加入生防菌株HM85发酵液的处理组与仅接种病原菌的甜菜植株相比,根长无显著性差异,但株高、根鲜重、根直径及地上部分鲜重等生理指标显著提高,对不同指标的促生效率从20.47%~75.03%不等,其中对根直径的促生效率最为明显,为75.03%(表2)。表明菌株HM85在防治甜菜褐斑病的同时对植株有一定的促生作用。
2.3 菌株HM85 的分类鉴定结果
2.3.1 菌株HM85的形态学特征
菌株HM85在高氏1号培养基上的形态特征如图5所示,气生菌丝颜色为牡蛎白,基内菌丝颜色为黑色。
2.3.2 菌株HM85的生理生化性质分析
从表3可以看出,菌株HM85 能够利用木糖、棉子糖、L-阿拉伯糖、L-鼠李糖、果糖、葡萄糖、甘露醇、水杨苷作为单一碳源生长,不能利用蔗糖、肌醇作为单一碳源生长,能使牛奶凝固与胨化,能使明胶液化,可以产H2S和黑色素,能使淀粉水解,能够分解纤维素。
2.3.3 菌株HM85 的分子生物学鉴定
菌株HM85的16S rRNA 基因序列比对结果(图6)显示,菌株HM85与供试链霉菌的同源性为99.72%~98.45%。其中,与娄彻氏链霉菌S. roche(VITLG012)的同源性最高(99.72 %),说明二者的亲缘关系最近;基于16S rRNA构建的系统进化树也显示其与娄彻氏链霉菌(S. roche)(VITLG012)聚为同一分支,结合形态特征和生理生化特性等结果,将菌株HM85鉴定为娄彻氏链霉。
3 讨论
甜菜褐斑病的流行严重影响着甜菜块根产量、含糖率、灰分和有害氮含量,导致原料产量和质量下降,影响甜菜糖的加工效率与质量。同时,尾孢菌不仅为甜菜褐斑病发生的主要病原菌,还是大豆、玉米等粮食作物病害发生的主要病原。已有研究表明,玉蜀尾胞菌(Cercosporazeaemaydis)、大豆尾孢菌(Cercospora sojina)等是引起玉米和大豆灰斑病和褐斑病的重要病原菌[16-18]。因此,本研究结果在丰富甜菜褐斑病生防优质菌种资源的同时,为其他植物与粮食作物相关病害的防治防控研究提供了重要参考。
放线菌是植物病害生物防治的重要微生物资源。其中,链霉菌产生的抗生素广泛应用于医疗与制药领域,是放线菌门中最为庞大且极富物种多样性的分支。链霉菌经过多年来系统深入研究,在系统分类学、多样性以及天然产物资源勘探与应用等领域都取得了巨大进展。弗氏链霉菌(S. fradiae) [19]、黄麻链霉菌(S. corchorusii) [20]、毒三素链霉菌(S. toxytricini)[21]等被用于作物枯萎病的防治;疮痂链霉菌(S. scabiei)和藤黄灰链霉菌(S.luteogriseus)可以防治花生白绢病等[22]。本研究从内蒙古自治区呼伦贝尔黑土地甜菜根际土壤分离得到43株可培养放线菌,从中筛选出8株对甜菜褐斑病病原菌具有拮抗作用的菌株,其中,最具生防应用潜力的菌株HM85 鉴定为娄彻氏链霉菌(S. roche)。
前期研究发现,娄彻氏链霉菌(S. roche)XL-6无菌发酵液显著降低茄子青枯病发病率和病情指数[23];苹果内生娄彻氏链霉菌A-m1发酵滤液对葡萄座腔菌(Botryosphaeria dothidea)、苹果拟茎点霉(Phomopsis mali)、胶孢炭疽菌(Colletotrichumgloeosporioides)等病原菌表现出抑菌作用[24]。HM85对峙培养试验结果显示,该菌对甜菜生尾孢菌的生长有较强抑制作用,并且在防褐斑病的同时对甜菜有一定的促生作用。由此可见,娄彻氏链霉菌HM85具有良好的研发和应用潜力,围绕该菌对甜菜褐斑病的生防机理还有待进一步探究。
参考文献
[1] KHAN M F R. Success and limitations of using fungicides tocontrol cercospora leaf spot on sugar beet [J/OL]. Agric. Res.Technol. Open Access. J., 2018,14(2): 555909 [2024-04-03].https://doi.org/10.19080/ARTOAJ.2018.14.555909.
[2] TAN W B, LI K X,LIU D L, et al ..Cercospora leaf spot diseaseof sugar beet [J/OL].Plant Signal. Behav., 2023,18(1): 2214765[2024-04-02]. https://doi.org/10.1080/15592324.2023.2214765.
[3] 邹锋康, 丁广洲, 贾海伦, 等. 甜菜褐斑病及种质资源抗性研究进展[J]. 中国糖料, 2019, 41(4):63-69.
ZOU F K, DING G Z, JIA H L, et al .. Research progress on leafspot disease (Cerecospora beticola Sacc.) and germplasmresistance of sugar beet [J]. Sugar Crops oChina, 2019, 41(4):63-69.
[4] 林杰, 刘梅, 吴学宏, 等. 甜菜褐斑病菌三种分子检测方法的比较[C]//中国植物病理学会,中国植物病理学会2010年学术年会论文集.中国农业科学技术出版社,2010:164.
[5] 王录红,周翔,李王胜,等.甜菜褐斑病菌分离培养及病程分子鉴定[J].中国糖料, 2022,44(1):60-63.
WANG L H, ZHOU X, LI W S, et al .. Isolation of cercosporabeticola and molecular identification of sugar beet leaf spotcourse [J]. Sugar Crops China, 2022,44(1):60-63.
[6] 乔志文.高抗褐斑病性和含糖率甜菜品种田间鉴定[J].中国农学通报, 2019,35(7):123-127.
QIAO Z W. Identification of sugar beet varieties with highresistance to cercospora leaf spot and high sugar content infield [J]. Chin. Agric. Sci. Bull., 2019,35(7):123-127.
[7] 史应武,娄恺,李春,等.甜菜褐斑病内生拮抗菌的筛选、鉴定及其防效测定[J].植物病理学报, 2009,39(2):221-224.
[8] BUDAKOV D, NAGL N, STOJSIN V, et al .. Sensitivity ofcercospora beticola isolates from serbia to carbendazim andflutriafol [J]. Crop Protection, 2014, 66: 120-126.
[9] TRKULJA N R, MILOSAVLJEVIC A G, MITROVIC M S,et al .. Molecular and experimental evidence of multi-resistanceof Cercospora beticola field populations to MBC, DMI and QoIfungicides [J]. Eur. J. Plant Pathol., 2017, 149: 895-910.
[10] 林杰,刘梅,吴学宏,等.甜菜褐斑病菌抗药性分子机理研究进展[J].中国糖料, 2012 (4): 60-64.
LIN J, LIU M, WU X H, et al .. Progress in fungicide resistancemolecular mechanisms of beet leaf spot disease [J]. SugarCrops China, 2012 (4): 60-64.
[11] EL-FAWY M M, EL-SHARKAWY R M I, ABO-ELUOUSR KA M. Evaluation of certain Penicillium frequentans isolatesagainst cercospora leaf spot disease of sugar beet [J]. Egy. J.Biol. Pest Control, 2018, 28: 1-7.
[12] 张海东,刘晓舟,梁春浩,等.花生褐斑病生防菌筛选及田间防效评价[J].花生学报, 2023,52(3):42-47.
ZHANG H D, LIU X Z, LIANG C H, et al .. Screening ofbiocontrol agents against peanut early leaf spot and evaluationof its field control effect [J]. J. Peanut Sci., 2023,52(3):42-47.
[13] 钟伏付,苏娜,杨廷宪,等.魔芋品种选育与改良研究进展[J].湖北农业科学, 2011, 50(3): 446-449.
ZHONG F F, SU N, YANG Y X, et al .. Advances in varietybreeding of Amorphophallus konjac [J]. Hubei Agric. Sci., 2011,50(3): 446-449.
[14] LEI S N, XU X H, CHENG Z Q, et al .. Analysis of thecommunity composition and bacterial diversity of therhizosphere microbiome across different plant taxa [J/OL].Microbiologyopen, 2019, 8(6): e00762 [2024-04-02]. https://doi.org/10.1002/mbo3.762.
[15] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:1-419.
[16] 徐秀德,董怀玉,姜钰,等.玉米灰斑病抗性鉴定技术[J].植物保护学报,2003(2):129-132.
XU X D, DONG H Y, JIANG Y, et al .. The technique foridentification of resistance to gray leaf spot on maize [J]. J.Plant Protect., 2003(2):129-132.
[17] 钟兆西,王伟,张桂荣.大豆灰斑病菌(Cercospora sojina)生物学特性的研究[J].大豆科学,1989(3):288-294.
ZHING Z X, WANG W, ZHANG G R. Study on the biologicalcharacteristics of Cercospora sojina [J]. Soybean Sci., 1989(3):288-294.
[18] 张海涛,殷丽华,柯希望,等.绿豆叶斑病菌分生孢子的产生和萌发条件研究[J]. 农学学报,2016,6(10):78-82
ZHANG H T, YIN L H, KE X W, et al .. Conidia productionand germination conditions of mung bean leaf spot pathogen [J]. J.Agric., 2016,6(10):78-72.
[19] 刘秋,齐小辉,闫建芳,等.瓜类枯萎病拮抗放线菌 H628 的鉴定[J].沈阳农业大学学报, 2008(2): 178-181.
LIU Q, QI X H, YAN J F, et al .. Identification of actinomycesH628 against Fusarium oxysporum f. sp. cucumerinum [J]. J.Shenyang Agric. Univ., 2008(2): 178-181.
[20] 燕照玲,孙虎,施艳,等.黄瓜枯萎病拮抗放线菌 S24 的分离、鉴定及发酵条件优化[J]. 河南农业科学, 2014, 43(9): 88-92, 100.
YAN Z L, SUN H, SHI Y, et al .. Isolation,identification andfermenting condition optimization of antagonistic actinomycetesS24 against Fusarisum oxysporum f.sp. cucumebrium [J]. HenanAgric. Sci., 2014, 43(9): 88-92,100.
[21] 刘金秀,马正,申屠旭萍,等.黄瓜枯萎病拮抗放线菌筛选及其生防作用鉴定[J]. 园艺学报, 2012, 39(6): 1123-1130.
LIU J X, MA Z, SHEN T X P, et al .. Isolation andidentification of antagonistic actinomycetes and theirapplication in the biocontrol of Fusarium oxysporum f. sp.cucumerinum [J]. Acta Hortic. Sin., 2012, 39(6): 1123-1130.
[22] 职永玺, 何海荣, 周琳, 等. 防控花生白绢病的根际放线菌分离鉴定及防效评价[J]. 农药学学报, 2023, 26(1): 101-113.
GNEG Y X, HE H R, ZHOU L, et al .. Isolation, identificationand evaluation of rhizosphere actinomycetes for control ofpeanut southern blight [J]. Chin. J. Pestic. Sci., 2023, 26(1):101-113.
[23] 李威,肖熙鸥,李可,等.娄彻氏链霉菌 XL-6 的抑菌活性及对茄子幼苗的防病促生效应[J].中国生物防治学报, 2017, 33(4):531-536.
LI W, XIAO X O, LI K, et al .. The antibiotic activity offermentation broth produced from streptomyces rochei XL-6and its influence on bacterial wilt control and plant growth ineggplant seedling [J]. Chin. J. Biol. Control, 2017, 33(4):531-536.
[24] 李永丽,王亚红,周洲,等.新疆野苹果内生娄彻氏链霉菌 Am1的鉴定和发酵条件优化及抑菌广谱作用[J].林业科学,2020, 56(7): 70-81.
LI Y L, WANG Y H, ZHOU Z, et al .. Identification andoptimization of fermentation conditions and antibacterialactivity of endophytic Streptomyces rochei A-m1 from thebranch of Malus sieversii [J]. Forestry Sci., 2020, 56(7): 70-81.
(责任编辑:温小杰)
基金项目:内蒙古自治区科技计划项目(2020GG0271);国家糖料产业技术体系建设项目(CARS-170725);内蒙古自治区“ 揭榜挂帅”项目(2022JBGS0029); 内蒙古自治区科技成果转化专项资金项目(2021CG0042)。
