基于RNA-Seq技术对不同品种猪排卵前卵泡差异表达基因的筛选与注释
2024-06-23刘林清李庆岗苏世广周梅张威王重龙
刘林清 李庆岗 苏世广 周梅 张威 王重龙
摘要 [目的]筛选淮猪和大约克猪排卵前卵泡组织差异表达基因。[方法]采集淮猪和大约克猪各3头的排卵前卵泡,提取RNA,个体独立建库。采用RNA测序技术以及GO和pathway方法对所获序列进行显著性富集分析。[结果]测序后,获得的淮猪clean reads数分别为 85 958 912、91 701 082、84 448 828,其中有效Reads数分别达到98.39%、98.59%、96.04%;获得的大约克猪clean reads数分别为87 914 166、80 480 542、85 994 612,其中有效reads数分别达到98.61%、96.95%、98.80%,测序饱和度良好(证明测序数据真实可靠)。结果表明,筛选到上调基因67个,下调基因54个。GO和 Pathway分析发现,差异表达基因富集在繁殖过程、生长过程和代谢过程及WNT信号通路、卵巢类固醇生成通路和类固醇生物合成通路等。[结论]获得了猪排卵前卵泡基因表达谱,并筛选到与繁殖性状相关的关键候选基因。
关键词 淮猪;大约克猪;RNA-Seq;差异表达基因
中图分类号 S828 文献标识码 A 文章编号 0517-6611(2024)11-0076-04
doi:10.3969/j.issn.0517-6611.2024.11.016
Screening and Annotation of Differentially Expressed Genes in Preovulatory Follicles of Different Breeds of Pigs Based on RNA-Seq Technology
LIU Lin-qing, LI Qing-gang, SU Shi-guang et al
(Institute of Animal Husbandry and Veterinary Medicine,Anhui Academy of Agricultural Sciences/Anhui Provincial Key Laboratory of Livestock and Poultry Product Safety Engineering, Hefei, Anhui 230031)
Abstract [Objective]This study aimed to find differentially expressed genes in preovulatory follicles of Huai pig and Yorkshire pig. [Method]This study collected preovulatory follicles from three Huai pig and three Yorkshire pig, respectively, extracted RNA and established individual independent libraries. RNA-Seq technology was used to conduct high-throughput Transcriptome sequencing of the sample library, and the obtained sequences were analyzed for GO and pathway significance enrichment. [Result]The number of clean reads obtained from Huai pigs was 85 958 912,91 701 082,84 448 828, with effective reads reaching 98.39%, 98.59%, and 96.04%, respectively; the number of clean reads obtained from the large Yorkshire pig was 87 914 166,80 480 542,85 994 612, with effective reads reaching 98.61%, 96.95%, and 98.80%, respectively. The high saturation degree of sequencing demonstrated that the data were realistic and reliable.The results showed that 67 upregulated genes and 54 down regulated genes were screened. GO and Pathway analysis found that differentially expressed genes were enriched in the reproductive, growth, and metabolic processes, as well as the WNT signaling pathway, ovarian steroid production pathway, and steroid biosynthesis pathway. [Conclusion]This study obtained the gene expression profiling of porcine preovulatory follicles and identified novel candidate genes for reproductive traits.
Key words Huai pig;Yorkshire pig;RNA-Seq;Differentially expressed genes
基金项目 2022年度畜禽产品安全工程安徽省重点实验室青年人才托举工程创新引导资金(XMT2022-09);安徽省财政农业种质资源保护与利用资金项目;安徽省学术和技术带头人后备人选项目(2022H300);安徽省科技特派团项目;安徽省生猪产业技术体系项目(AHCYJSTX-05-12, AHCYJSTX-05-23)。
作者简介 刘林清(1980—),女,山东莱芜人,助理研究员,博士,从事猪的遗传育种研究。
*通信作者,研究员,博士,从事猪遗传育种和健康养殖研究。
收稿日期 2023-10-17;修回日期 2023-11-13
繁殖性状尤其是产仔数性状是养猪业重要的生产性状,是猪的商业化品系选育中的重要选育指标,直接关系到养猪产业的经济效益。作为复杂的数量性状,产仔数遗传力较低,且影响因素很多。中外猪种在繁殖性状方面存在显著差异[1],随着后基因组时代的来到,应用最广泛的技术之一是转录组学[2]。该技术已经应用于水稻[3]、海鲈鱼[4]、小鼠[5] 等的RNA测序。并有研究者利用该项测序技术筛选出了不同猪种间的差异表达基因,并进行了相应的分析[6]。利用组学技术筛选该类性状的功能候选基因具有重要意义。因此,笔者选取淮猪和大约克猪的卵巢进行了RNA-Seq分析,旨在挖掘在卵泡发育、排卵过程中瞬时表达的关键基因,从而为完善与猪卵泡生长发育、排卵的基因调控及其复杂的调控网络提供科学依据。
1 材料与方法
1.1 试验材料
采集经孕马血清促性腺激素(PMSG)和绒毛膜促性腺激素(HCG)处理后的4月龄淮猪和6月龄大约克猪的成熟卵泡组织各3头,-80 ℃贮存。
1.2 卵泡RNA的提取与测序
将采集的组织直接送交广州基迪奥生物科技有限公司提取RNA,并进行RNA测序。
1.2.1 Trizol 法提取卵泡总RNA。
Trizol 试剂是直接从细胞卵泡组织中提取总RNA 的试剂,其在破碎和溶解细胞时能保持RNA 的完整性。裂解细胞并释放出RNA,加入氯仿后离心,样品分成水样层和有机层。酸性条件可使RNA 与DNA 分离,RNA 存在于水样层中。收集上面的水样层后,RNA 可以通过异丙醇沉淀来还原。
1.2.2 RNA质量检测。
主要进行3种检测,即琼脂糖凝胶电泳、Nanodrop 微量分光光度计检测和Agilent 2100 检测。
1.2.3 RNA-seq文库构建。
通过带有Oligo(dT)的磁珠富集具有polyA尾巴的真核mRNA后,用超声波把mRNA打断。以片段化的mRNA为模版,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成cDNA第1条链,随后用RNaseH降解RNA链,并在DNA polymerase I 体系下,以dNTPs为原料合成cDNA第2条链。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选200 bp左右的cDNA,进行PCR扩增并再次使用AMPure XP beads纯化PCR产物,最终获得文库。文库构建质量检测标准如下:
①琼脂糖凝胶电泳:分析样品RNA完整性及是否存在DNA污染;
②NanoPhotometer spectrophotometer:检测RNA纯度(OD260/280及OD260/230);
③Qubit 2.0 Fluorometer:RNA浓度精确定量;
④Agilent 2100 bioanalyzer:精确检测RNA完整性。
1.3 数据分析
1.3.1 原始数据处理。利用fastp[7]进行质控,并进行reads过滤,步骤如下:
①去除含adapter 的reads;②去除含N 比例大于10%的reads;③去除全部都是A碱基的reads;④去除低质量reads(质量值Q≤20 的碱基数占整条read 的50%以上)。
1.3.2 差异基因的筛选。使用edgeR[8]软件分析获得的read counts数据,筛选FDR<0.05 且|log2FC|>1的基因为显著差异基因。
1.3.3 GO功能显著性富集。利用GO数据库,获得差异表达基因中显著富集的GO条目。
1.3.4 KEGG Pathway显著性富集分析。经过多重检验校正后,可获得差异表达基因中显著富集的Pathway(Q≤0.05)。
2 结果与分析
2.1 差异基因筛选
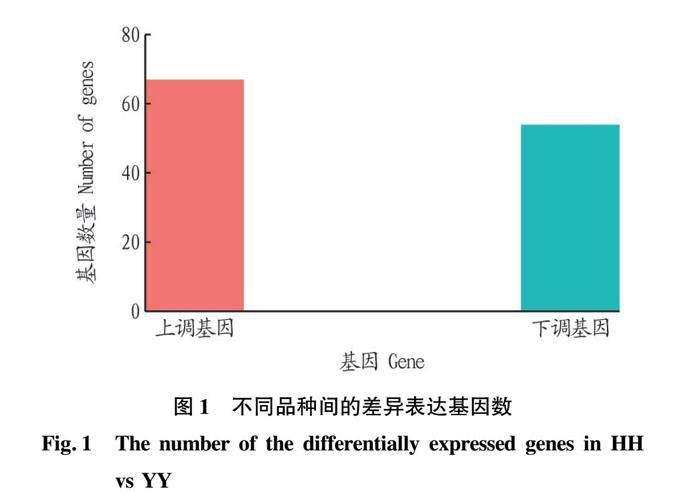
以淮猪为对照,大约克猪与之相比,差异表达基因中有67个上调基因,54个下调基因(图1)。
2.2 差异表达基因的GO功能显著性富集
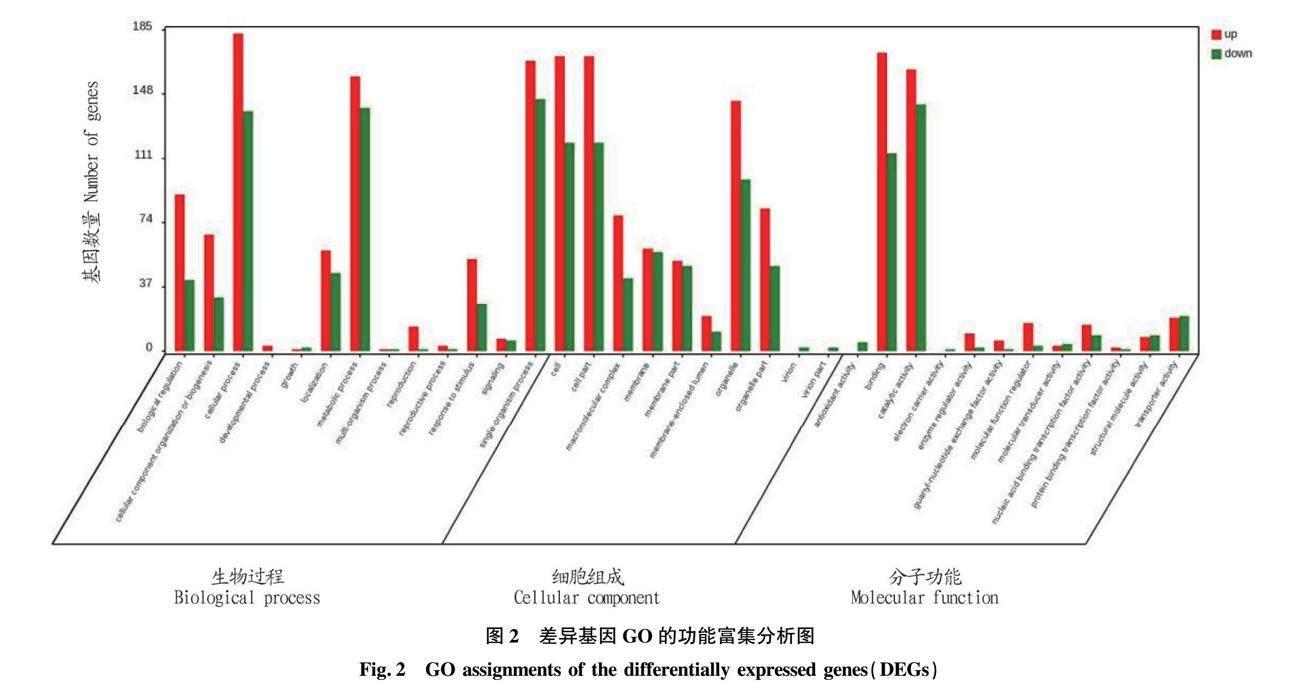
GO广泛应用于转录组数据分析中[9]。通过GO功能显著性富集分析发现,已注释的猪卵泡差异表达基因有745个,其中有336个基因参与生物学过程、所占比例为45.10%,有110个基因参与分子功能,所占比例为14.77%及有299个基因参与细胞组分,所占比例为40.13%。由此可以推测,生物学过程在淮猪和大约克猪繁殖性状差异中起着重要作用。
差异表达基因参与的显著性(P<0.05)生物过程主要包括繁殖过程,生长过程及代谢过程等;细胞组分主要表现在细胞外基质、细胞外复合体等;分子功能主要表现在分子转化活性、分子功能调节及信号转导活性等(图2)。
2.3 差异表达基因的KEGG Pathway功能显著性富集
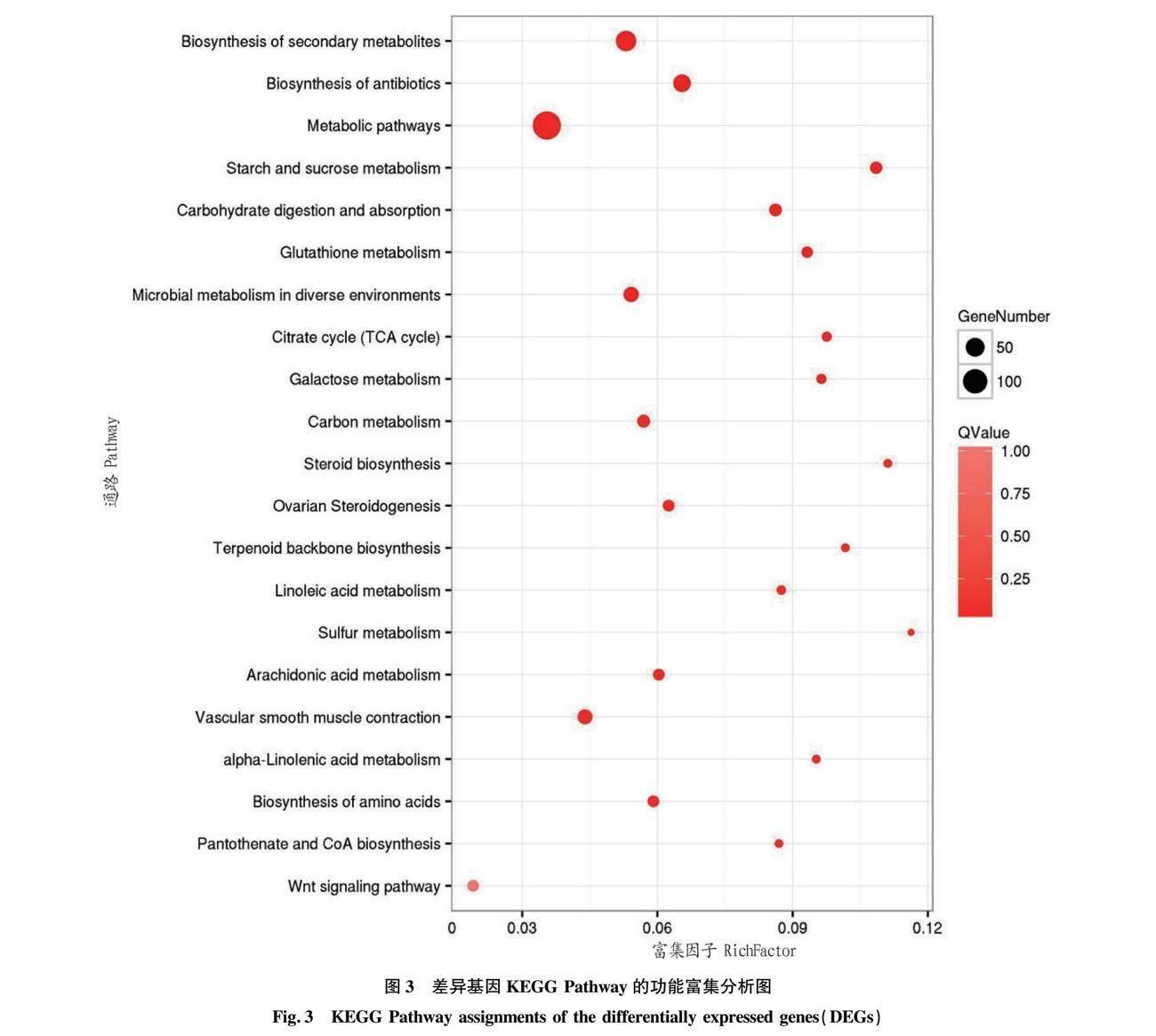
KEGG数据库记录基因产物的相互作用网络[10]。通过KEGG pathway信号通路分析发现,有23 948个差异表达基因,参与了110条生物学代谢通路,其中主要参与繁殖方面的通路包括WNT信号通路、卵巢类固醇生成因子及类固醇生物合成通路等(图3)。
3 讨论
该研究选用在产仔性状等方面存在较大差异的淮猪和大约克猪的卵泡组织进行转录组测序,筛选与繁殖性状相关的基因。结合GO和KEGG pathway对获得的淮猪与大约克猪卵泡组织间差异表达基因进行分析,结果发现:一些显著通路和生物过程如WNT信号通路、卵巢类固醇生成及类固醇生物合成通路等中的差异基因在淮猪与大约克猪中表达差异较大,其可能与淮猪和大约克猪产仔数性状的差异有关。
卵巢类固醇生成通路在猪发情排卵过程中发挥着重要作用,进一步证实高产仔淮猪和低产仔大约克猪在排卵前卵泡间存在激素调节系统方面的差异。在卵巢类固醇生成通路上,高产仔淮猪成熟卵泡组织中的CYP19A3、LDLR、BMP15基因均呈上调表达趋势,即雌二醇被促进生成,母猪产仔数又受到雌二醇表达量的影响[11]。还参与类固醇激素和固醇的生物合成的有细胞色素P450,有研究者表明,细胞色素P450在生殖激素调节中扮演着重要角色[12]。该研究发现,与猪繁殖性能相关的细胞色素P450家族基因有CYP19A3基因在卵巢类固醇生成通路上高表达,说明这个基因对高产仔的淮猪在卵泡生长发育过程中有显著影响。
LDLR基因是一种细胞表面糖蛋白,广泛存在于体内组织细胞中,其在卵巢、睾丸等甾源性组织脂蛋白代谢中发挥着重要作用,但其在各组织或细胞中活性差别较大。大量研究发现,LDLR基因的多态性与血脂水平有密切关系,血脂异常与很多疾病有密切关系[13-14]。有研究表明,LDLR基因对小鼠的卵巢发育方面具有调节作用,并参与卵巢内脂肪代谢的调控[15],还可以在一程度上影响家禽的繁殖能力和蛋品品质[16-18]。卵巢中的载脂蛋白LDLR作为细胞膜表面转运胆固醇的特异性受体,利用血液中的脂蛋白在卵巢中合成胆固醇,而胆固醇是卵泡和黄体分泌激素的重要反应底物,对卵泡的发育以及黄体正常功能的维持起到重要作用[19-20]。
BMP15基因主要参与卵泡生长发育过程。有不同研究者发现,BMP15基因在小鼠的垂体中[21],在蒙古牛的卵巢、子宫、输卵管和肾脏组织中均有表达[22]。BMP15与促卵泡生长激素FSH能够通过 TGFβRII 抑制促卵泡生长激素受体FSHR表达,进而抑制促卵泡生长激素 FSH 的表达[22-24]。BMP15 蛋白是一种卵母细胞分泌因子,在雌性动物卵母细胞中特异性表达,且其表达量与卵泡生长发育相关[25]。BMP15基因作为显著影响羊繁殖性状的主效基因之一,其多态性与多羔性状密切相关[26]。
参考文献
[1] 闻爱友,桑仁富,戴四发,等.定远母猪繁殖性能及其杂种优势研究[J].安徽技术师范学院学报,2005,19(4):5-7.
[2] Lockhart D J,WINZELER E A.Genomics,gene expression and DNA arrays[J].Nature,2000,405(6788):827-836.
[3] ZHANG G J,GUO G W,HU X D,et al.Deep RNA sequencing at single base-pair resolution reveals high complexity of the rice transcriptome[J].Genome research,2010,20(5):646-654.
[4] XIANG L X,HE D,DONG W R,et al.Deep sequencing-based transcriptome profiling analysis of bacteria-challenged Lateolabrax japonicus reveals insight into the immune-relevant genes in marine fish[J].BMC genomics,2010,11(1):1-21.
[5] MORTAZAVI A,WILLIAMS B A,MCCUE K,et al.Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].Nature methods,2008,5(7):621-628.
[6] 杨亚岚.不同品种猪骨骼肌表型差异的全基因组甲基化调控研究[D].北京:中国农业科学院,2013.
[7] CHEN S F,ZHOU Y Q,CHEN Y R,et al.fastp:An ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[8] ROBINSON M D,MCCARTHY D J,SMYTH G K,et al.edgeR:A Bioconductor package for differential expression analysis of digital gene expression data[J].Bioinformatics,2010,26(1):139-140.
[9] CONESA A,GTZ S.Blast2GO:A comprehensive suite for functional analysis in plant genomics[J].International journal of plant genomics,2008,2008:1-13.
[10] KANEHISA M,GOTO S.KEGG:Kyoto encyclopedia of genes and genomes[J].Nucleic acids research,2000,28(1):27-30.
[11] ROBIC A,FARAUT T,PRUNIER A.Pathways and genes involved in steroid hormone metabolism in male pigs:A review and update[J].The journal of steroid biochemistry and molecular biology,2014,140:44-55.
[12] KANDIEL M M M,WATANABE G,TAYA K.Ovarian expression of inhibin-subunits,3β-hydroxysteroid dehydrogenase,and cytochrome P450 aromatase during the estrous cycle and pregnancy of Shiba goats(Capra hircus)[J].Experimental animals,2010,59(5):605-614.
[13] 张明明,马倩,王俊明,等.低密度脂蛋白受体第12外显子基因突变与高胆固醇血症的关系[J].山东医药,2011,51(17):45-46.
[14] 张明明,霍丽静,孙海娟,等.高胆固醇血症患者LDL-R基因Xsp I位点多态性与血清IL-6的关系及意义[J].临床检验杂志,2011,29(8):596-598.
[15] GUO T,ZHANG L,CHENG D,et al.Low-density lipoprotein receptor affects the fertility of female mice[J].Reproduction, fertility and development,2015,27(8):1222-1232.
[16] WALZEM R L,CHEN S E.Obesity-induced dysfunctions in female reproduction:Lessons from birds and mammals[J].Advances in nutrition,2014,5(2):199-206.
[17] HO K J,LAWRENCE W D,LEWIS L A,et al.Hereditary hyperlipidemia in nonlaying chickens[J].Archives of pathology,1974,98(3):161-172.
[18] YAO J F,CHEN Z X,XU G Y,et al.Low-density lipoprotein receptor-related protein 8 gene association with egg traits in dwarf chickens[J].Poultry science,2010,89(5):883-886.
[19] WILTBANK M C,DISKIN M G,FLORES J A,et al.Regulation of the corpus luteum by protein kinase C.II.Inhibition of lipoprotein-stimulated steroidogenesis by prostaglandin F2 alpha.[J].Biology of reproduction,1990,42(2):239-245.
[20] MILLER W L,AUCHUS R J.The molecular biology,biochemistry,and physiology of human steroidogenesis and its disorders[J].Endocrine reviews,2011,32(1):81-151.
[21] OTSUKA F,SHIMASAKI S.A negative feedback system between oocyte bone morphogenetic protein 15 and granulosa cell kit ligand:Its role in regulating granulosa cell mitosis[J].Proceedings of the national academy of sciences of the United States of America,2002,99(12):8060-8065.
[22] 何小龙,高连枝,王峰,等.骨形态发生蛋白15基因mRNA在牛不同组织中的表达分析[J].畜牧与饲料科学,2009,30(2):129-131.
[23] OTSUKA F,INAGAKI K.Unique bioactivities of bone morphogenetic proteins in regulation of reproductive endocrine functions[J].Reproductive medicine and biology,2011,10(3):131-142.
[24] MA X P,YI H S.BMP15 regulates FSHR through TGF-β receptor II and SMAD4 signaling in prepubertal ovary of Rongchang pigs[J].Research in veterinary science,2022,143:66-73.
[25] CHANG H,BROWN C W,MATZUK M M.Genetic analysis of the mammalian transforming growth factor-beta superfamily[J].Endocrine reviews,2002,23(6):787-823.
[26] 冯涛,赵有璋,储明星,等.济宁青山羊多羔性候选基因BMP15的研究[J].畜牧兽医学报,2009,40(4):468-475.
