一株肉种鸡坦布苏病毒的分离鉴定及致病特点研究
2024-06-20王友李培勇段宝敏
王友 李培勇 段宝敏

摘 要:2010年坦布苏病毒传入我国,对我国养鸭业造成损失。随后发现,此病毒也能够感染鸡群,对养鸡场生物安全形成威胁。本研究从发生不明原因产蛋率下降的肉种鸡中分离到一株坦布苏病毒HB20210株,发病鸡群主要剖检病变为卵泡膜出血和卵泡液化等生殖系统病变。将分离株接种到DF-1细胞和SPF鸡胚中,48 h后即可出现明显病变。动物试验结果表明,胸肌注射、颈部皮下注射和灌服的攻毒方式造成的病毒血症持续时间均为5 d。将分离株进行肉种鸡回归试验,卵泡会出现显著病变。E蛋白氨基酸同源性和进化树分析表明,分离株HB202010与活疫苗FX2010-180P株、灭活疫苗DF2株、HB株属于同一分支,均为中国分离株II分支,并且与灭活疫苗DF2株和HB株同源性最高,可达99.0%。HB20210株的分离鉴定为进一步探讨该病毒对种鸡产蛋性能的影响和完善种鸡场防控方法奠定了良好的基础。
关键词:TMUV;肉种鸡;分离鉴定
中图分类号:S858.31文献标识码:B文章编号:1673-1085(2024)06-0017-10
坦布苏病毒(Tembusu virus,TMUV)属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus)恩塔亚(Ntaya virus group)病毒群的一员。该病毒为单股正链RNA病毒,基因组长度为10 990 bp,包含一个开放阅读框(ORF),总共编码3个结构蛋白(核衣壳蛋白、PrM蛋白和囊膜蛋白E)和7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)。其中,E蛋白是TMUV最大的结构蛋白,同时也是该病毒的主要毒力抗原,包含多个抗原决定簇,在病毒的吸附、复制和生物合成过程中发挥着关键作用[1]。
2010年TMUV传入中国,该病主要影响鸭的生殖系统,导致蛋鸭产蛋量显著下降,表现为卵巢出血、卵泡破裂和卵泡膜出血,严重制约着我国水禽养殖业发展。此外,TMUV感染宿主谱扩至鸡、鹅、麻雀和小鼠,对家禽养殖场生物安全和公共卫生安全造成威胁。
本研究从发生不明原因产蛋率下降的肉种鸡场中分离到一株TMUV,接种细胞、SPF鸡胚、肉种鸡后出现明显病变,并对其编码E蛋白的基因进行了同源性和进化树分析,为种鸡场防控TMUV提供参考。
1 材料与方法
1.1 主要材料
1.1.1 病料来源 某规模化肉种鸡场34周龄种鸡出现不明原因产蛋下降,严重的鸡舍产蛋率下降近30%,剖检主要病变为卵泡膜出血和卵泡液化,采集具有明显病变鸡只的气管、肺脏、肝脏、脾脏和卵泡膜等组织进行病原的检测和分离。
1.1.2 SPF鸡胚、细胞系 SPF鸡胚、200日龄SPF鸡购自济南赛斯家禽科技有限公司;200日龄肉种鸡购自北京梅里亚维通实验动物技术有限公司;DF-1细胞系由天津瑞普生物技术股份有限公司保存。
1.1.3 主要试剂与仪器 1PBS、2×Taq Master Mix、One-Step RT-PCR试剂盒和1×TAE电泳缓冲液购自北京全式金生物技术股份有限公司;核酸自动提取仪购自南京诺唯赞生物科技股份有限公司;PCR仪、凝胶电泳仪和凝胶成像仪购自伯乐生命医学产品(上海)有限公司。
1.1.4 引物设计及合成 分别设计新城疫病毒(NDV)、鸡传染性支气管炎病毒(IBV)、禽流感病毒(AIV H9)、鸡滑液囊支原体(MS)、鸡减蛋综合征病毒(EDSV)和坦布苏病毒(TMUV)引物,引物由生工生物工程(上海)股份有限公司合成,具体引物序列、目的基因和片段大小见表1。
PCR程序为:95 ℃预变性5 min;95 ℃变性1 min,60 ℃退火15 s;72 ℃延伸1.5 min,共32个循环;72 ℃延伸10 min。
RT-PCR程序为:50 ℃反转录30 min,95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火35 s,72 ℃延伸1.5 min,共32个循环;72 ℃延伸10 min。
1.2 方法
1.2.1 病料PCR和RT-PCR检测 无菌取气管、肺脏、肝脏、脾脏和卵泡膜等组织,剪碎后加入5 mL无菌PBS进行研磨,-80 ℃反复冻融3次后,12 000 rpm离心10 min,取上清经0.22 m微孔膜过滤。滤液使用全自动核酸提取仪提取DNA和RNA,再进行PCR和RT-PCR检测。PCR产物使用1%琼脂糖凝胶进行电泳,电泳结束后使用凝胶成像仪观察并记录结果。
1.2.2 鸡胚分离病毒 将1.2.1中检测为TMUV阳性的上清液经尿囊腔接种9日龄SPF鸡胚,每胚0.2 mL。接种后放入37 ℃孵化箱,每日照胚,若鸡胚死亡,观察胚体变化,收获胚体和尿囊液。继续传代,连传3代;若鸡胚存活,则在第6天采集胚体和尿囊液继续传代,连传3代。对胚体和尿囊液进行PCR和RT-PCR检测NDV、IBV和TMUV等。
1.2. 3 细胞分离病毒 使用DF-1细胞进行病毒分离,待细胞长满80%时接种1.2.1中检测为TMUV阳性的上清液。接种后每日观察,待细胞病变达到80%以上,收取细胞和上清液,连传3代;若未出现明显细胞病变则每3天传代1次,连传3代。对F3代细胞培养上清液进行PCR和RT-PCR检测NDV、IBV和TMUV等。
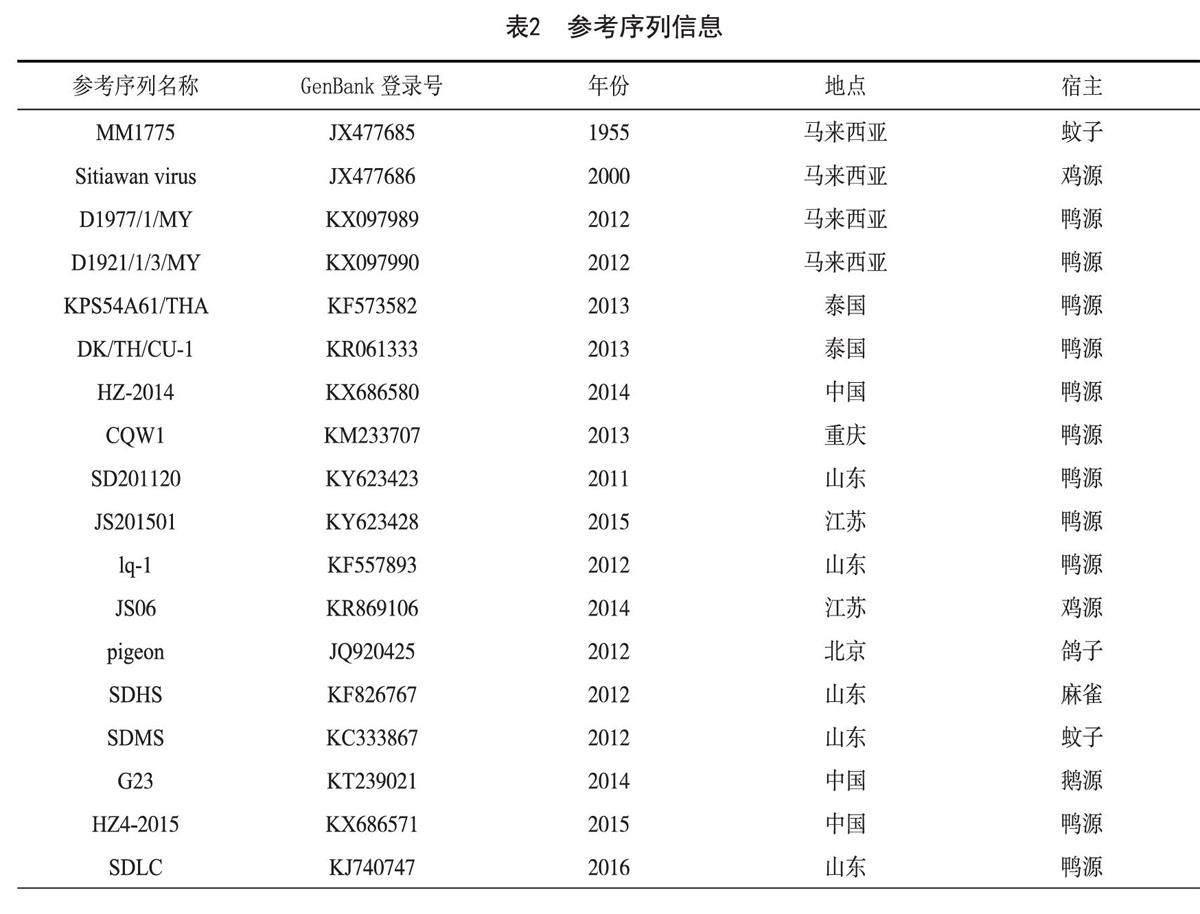
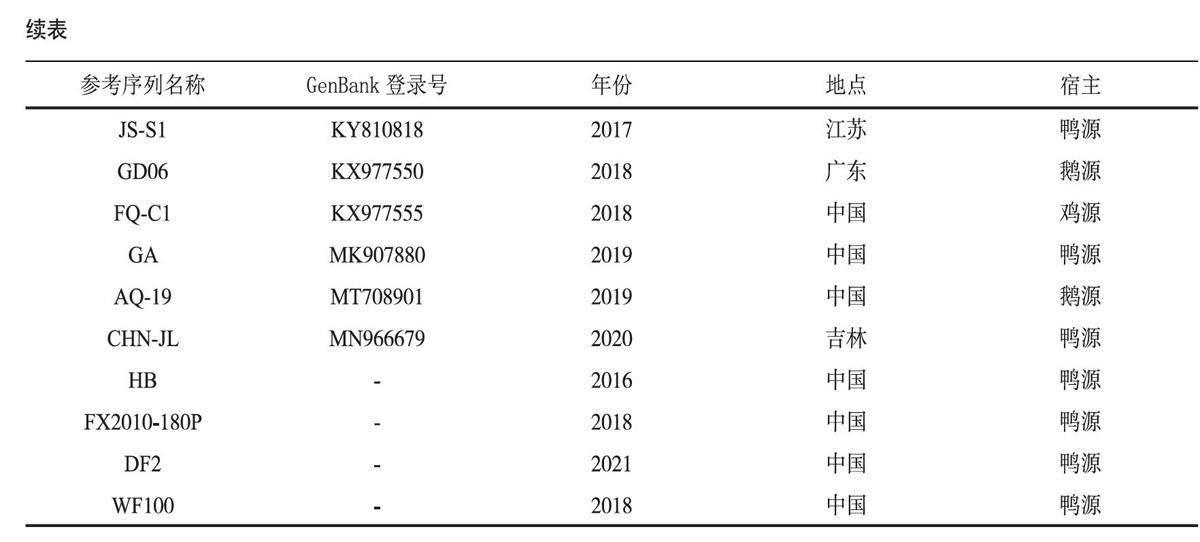
1.2.4 坦布苏病毒E蛋白基因克隆及测序分析 用细胞分离的纯净病毒液提取RNA后进行RT-PCR,回收目的条带,回收产物与pMD18-T载体连接,连接产物转化至DH5α感受态细胞。涂布抗性平板后,37 ℃培养箱过夜培养,挑取阳性菌落进行扩增,经菌液PCR验证后,送至生工生物工程(上海)股份有限公司进行测序。将测序结果进行比对分析,采用Megalign序列比对程序,使用MEGA7软件构建进化树,参考毒株信息见表2。
1.2.5 不同途径感染TMUV病毒血症的持续时间 将30只200日龄的SPF鸡随机分为3组,每组10只,分别通过胸肌注射、颈部皮下注射和灌服的方式进行攻毒。攻毒后一周内,每天采集血液,分离出血清后接种DF-1细胞,进行TMUV的分离鉴定,具体方法参照1.2.3。
1.2.6 动物回归试验 选用200日龄的肉种鸡进行回归试验,4只肉种鸡通过胸肌注射方式进行攻毒,每只鸡注射0.5 mL病毒液,2只肉种鸡胸肌注射等体积生理盐水作为阴性对照组。攻毒后2 d采集血清进行TMUV的分离鉴定,攻毒后8 d进行剖检,记录病变。
2 结果
2.1 发病鸡群临床症状及剖检病变
主要临床症状为产蛋率突然下降,病鸡精神萎顿,食欲不振,拉稀,有绿便和白色粪便。主要剖检病变为心肌充血、心冠脂肪出血(图1A),腹部脂肪出血(图1B),卵泡膜出血(图1C)和卵泡液化(图1D)。
2.2 病料PCR和RT-PCR检测结果
经检测,病料中仅检出TMUV为阳性,NDV、IBV和AIV等病原均为阴性。
2.3 TMUV分离鉴定
SPF鸡胚接种病毒液后,死亡时间为48~120 h,死亡鸡胚可见绒毛尿囊膜水肿,胚体水肿、出血和肝脏肿胀等病变,见图2B。尿囊液和胚体经RT-PCR检测,仅检出TMUV阳性,NDV、IBV和AIV等病原均为阴性。
DF-1细胞接种病毒液后48 h开始出现细胞病变,表现为细胞堆聚,圆缩,直至脱落,见图2D。F3代细胞上清液经RT-PCR检测,仅检出TMUV阳性,NDV、IBV和AIV等病原均为阴性。分离株命名为HB202010株。
2.4 坦布苏病毒E蛋白基因同源性及进化树分析
氨基酸同源性分析表明,分离株HB202010与参考株的同源性在94.4%~99.0%,与活疫苗株WF100同源性最低,与灭活疫苗株DF2和HB同源性最高,见图3。进化树分析表明,分离株HB202010与活疫苗株FX2010-180P和灭活疫苗株DF2、HB属于同一分支,均属于中国分离株II,但与活疫苗WF100株不属于同一分支,见图4。
2.5 不同途径感染TMUV病毒血症的持续时间
血清中TMUV分离鉴定结果表明,三种攻毒方式的病毒血症持续时间均为5 d,并且在2~3 d分离率最高。胸肌注射的方式在攻毒后3 d分离率均保持在100%,结果见图5。
2.6 动物回归试验结果
肉种鸡攻毒后2 d,血清中病毒分离率为100%;攻毒后8 d卵泡病变率为100%,主要表现为卵泡膜出血(图6A)和卵泡液化(图6B)。
3 讨论
2010年4月,一种新型鸭的传染病迅速在我国华东和华北地区传播,以蛋鸭产蛋量急速下降,卵泡膜和卵泡病变为主要特征[2-3]。经研究证实,该疾病是由一种新型黄病毒引起的,并且是国内首次发现对鸭群致病的黄病毒[4-5]。最终在2011年召开第一届水禽疫病防控研讨会期间,中国畜牧兽医学会将该传染病正式统一命名为“鸭坦布苏病毒”。随着研究深入,发现TMUV具有以下突出特点:第一,传播方式的变化。不同于传统的黄病毒大多数通过虫媒传播,TMUV在蚊虫较少的秋冬季仍呈大范围流行。因此,该病的传播不完全依赖于蚊子等虫媒,其传播媒介已经发生改变。2018年,中国农业科学院上海兽医研究所首次阐明我国部分流行病毒株由于第156位氨基酸突变,从而获得了空气传播的能力,证实了TMUV的传播可不完全依赖蚊子[6]。第二,致病性的变化。1955年,TMUV首次在马来西亚吉隆坡的蚊子体内分离得到,之后在马来西亚其他地区以及泰国等东南亚地区也有在家禽上分离到此病毒的报道,但对禽类无显著致病性[7]。自2010年传入我国后,该病毒致病性显著增强,能够导致蛋鸭卵泡膜出血,卵泡变形、萎缩和液化,导致产蛋量急剧下降,给我国养鸭业造成了严重的经济损失。第三,宿主谱的变化。起初TMUV以感染鸭为主,2012年有报道表明也能够感染鸡和鹅等禽类[8-9]。随后研究表明,TMUV也能够感染麻雀,并且推测麻雀可能是TMUV传播的重要媒介[10]。2013年,Li等研究表明,TMUV能够感染哺乳动物小鼠,具有公共卫生安全隐患[11]。同年,Tang等研究显示,在TMUV感染的养鸭场中,工人血清中TMUV抗体阳性率为71.9%,而咽拭子的病毒阳性率达47.7%[12]。本研究从肉种鸡场分离到一株TMUV,发病鸡群主要表现为精神沉郁、食欲不振和产蛋量下降,剖检病变主要为卵泡膜出血和卵泡液化。经检测IBV、EDSV和MS等影响产蛋率的病原均为阴性,最终确定为TMUV感染。这提示我们,对于周围有养鸭场的种鸡场,当出现不明原因产蛋下降,且常规病原无法检出时,TMUV也可以列为主要的排查项。肉种鸡感染TMUV后通常具有以下特点:初产或产蛋高峰期发病,具体表现为27~28周产蛋爬坡速度慢,无产蛋高峰,或是产蛋高峰期出现产蛋率大幅度下降,下降时间20 d左右,下降幅度15%~30%。在同一个鸡场内从第一栋发病鸡群到最后发病鸡群历时一个月左右,传播速度相对较慢。发病期间死亡率会略有上升,日死亡率在0.13%~0.27%,整个发病期死亡率约为2%。
通常情况下,鸡胚、鸭胚都可以用来分离TMUV。据报道,将病毒经尿囊腔或绒毛尿囊膜接种鸡胚或鸭胚后3~6 d,可观察到胚体出血水肿,绒毛尿囊膜水肿,肝肾出血肿大、坏死等病变[3]。研究表明,鸭源的TMUV在鸭胚中连续传代100次,其致病性会增强,但在鸡胚中传代100次,致病性会减弱[13]。本研究使用SPF鸡胚分离病毒,鸡胚在接种后48~120 h之间全部死亡,并且能够在胚体和尿囊液中检出TMUV。死亡鸡胚的主要病变为绒毛尿囊膜水肿,胚体水肿、出血和肝脏肿胀。除鸭胚和鸡胚外,TMUV也可在禽类细胞DF-1、LMH、CEF、DEF和哺乳类细胞Vero、HEK293T、HCT116、A549中增殖[14]。本研究使用DF-1细胞进行病毒的分离,在接种48 h后即可出现典型细胞病变。动物回归试验结果表明,肉种鸡感染TMUV后有卵泡出血和液化等典型病变。此外,本研究结果表明,TMUV感染后病毒血症持续时间为5 d,并且胸肌注射的攻毒方式能够保持较高的病毒分离率。
E蛋白是TMUV的主要表面结构蛋白,是诱导产生中和抗体的主要抗原。有研究表明,E蛋白不仅介导了病毒对宿主细胞的吸附,还能够与宿主细胞膜融合,参与侵入宿主细胞的过程[15]。因此,通常将编码E蛋白的基因作为TMUV进化分析的主要参考基因。于观留对东南亚和我国大陆78株TMUV代表株的开放阅读框(ORF)、E基因、NS1基因、NS3基因和NS5基因进行进化树分析,将当前TMUV主要分为马来西亚(1955)、马来西亚(2012)、泰国(2013)和中国分离株I和中国分离株II五大分支,并且中国分离株II分支为中国流行优势分支[16]。本研究通过对编码E蛋白的基因进行进化树分析,结果表明分离株HB202010同样被分到了中国分离株Ⅱ,并且与同一分支内的其他参考株的氨基酸同源性在97.6%~99.0%,说明此分离株的变异程度不大。
由于目前缺乏治疗TMUV感染的有效药物,除做好严格的生物安全防控措施外,疫苗免疫是阻断TMUV传染的最有效手段。目前我国获批的疫苗有“鸭坦布苏病毒灭活疫苗(HB株和DF2株)”和“鸭坦布苏病毒病活疫苗(WF100株和FX2010-180P株)”。疫苗的应用在保护鸭群免受TMUV感染起到了重要作用。本研究中分离株HB202010与疫苗株HB、DF2和FX2010-180P均属于同一分支。鉴于近年来TMUV感染鸡的报道逐渐增多,对于风险较高的种鸡场可以在开产前进行疫苗免疫,以保证产蛋期抗体滴度能有效抵御TMUV感染。
4 结论
本文分离到一株肉种鸡源TMUV,接种DF-2细胞和SPF鸡胚后会出现明显病变,动物回归试验肉种鸡也会出现卵泡出血和卵泡液化等典型病变。对编码E蛋白的基因进行进化树和同源性分析,结果表明,与中国其他分离株相比,此分离株变异程度不大。本研究为进一步探讨该病毒对种鸡产蛋性能的影响奠定了良好的基础。
参考文献:
[1] Shaozhou W, Li C, Zhang Q, et al. Duck tembusu virus and its envelope protein induce programmed cell death[J]. Virus Genes, 2015, 51 (1): 39-44.
[2] 曹贞贞,张存,黄瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.
[3] 万春和,施少华,程龙飞,等.一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J].福建农业学报,2010,25(6):663-666.
[4] Su J L, Li S, Hu X D, et al. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-related flavivirus[J]. PLoS One, 2011, 6 (3): e18106.
[5] Yan P X, Zhao Y S, Zhang X, et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J]. Virology, 2011, 417(1): 1-8.
[6] Yan D W, Shi Y, Wang H W, et al. A Single Mutation at Position 156 in the Envelope Protein of Tembusu Virus Is Responsible for Virus Tissue Tropism and Transmissibility in Ducks[J]. Journal of Virology, 2018, 92 (17): e00427-18.
[7] Kono Y, Tsukamoto K, Abd Hamid M,et al. Encephalitis and retarded growth of chicks caused by Sitiawan virus, a new isolate belonging to the genus Flavivirus[J]. The American journal of tropical medicine and hygiene, 2000, 63 (1-2): 94-101.
[8] Liu M, Chen S Y, Chen Y H, et al. Adapted Tembusu-like virus in chickens and geese in China[J]. Journal of Clinical Microbiology, 2012 ,50 (8): 2807-9.
[9] Yun T, Zhang D B, Ma X J, et al. Complete genome sequence of a novel flavivirus, duck tembusu virus, isolated from ducks and geese in China[J]. Journal of Virology, 2012, 86 (6): 3406-7.
[10]Tang Y, Diao Y, Yu C, et al. Characterization of a Tembusu virus isolated from naturally infected house sparrows (Passer domesticus) in Northern China[J]. Transboundary and Emerging Diseases, 2013, 60 (2): 152-8.
[11] Li S, Li X X, Zhang L J,et al. Duck Tembusu virus exhibits neurovirulence in BALB/c mice[J]. Virology Journal, 2013, 10: 260.
[12] Tang Y, Gao X, Diao Y, et al. Tembusu virus in human, China[J]. Transboundary and Emerging Diseases, 2013, 60 (3): 193-6.
[13]梁雨萌,马勇,陈志杰,等.坦布苏病毒Du/CH/LSD/110128株原代毒及其鸡胚传代致弱毒在不同物种细胞中毒性和增殖能力的检测[J].黑龙江畜牧兽医,2020(5):7.
[14] 梁雨萌.坦布苏病毒体外感染模型研究[D].北京:中国农业科学院,2019.
[15]Modis Y, Ogata S, Clements D, et al. Structure of the dengue virus envelope protein after membrane fusion[J]. Nature, 2004, 427 (6972): 313-9.
[16]于观留.坦布苏病毒感染对鸭胚成纤维细胞生物学功能的影响及其机制研究[D].泰安:山东农业大学,2019.
Isolation, Identification and Pathogenic Characteristics of a Strain of Tembusu Virus from Chicken Breeds
WANG You*, LI Peiyong*, DUAN Baomin
(Tianjin Ringpu Bio-technology Co., Ltd., Tianjin 300000, China)
Abstract: In 2010, Tembusu virus was introduced into China, causing significant losses to the duck farming industry. Subsequently, it was found that Tembusu virus could also infect chickens, posing a threat to the biosafety of chicken farms. In this study, a strain of Tembusu virus, designated as HB202010, was isolated from a chicken breed flock experiencing unexplained egg production drop. Lesions observed in the organs and tissues of infected chicken breeds specifically unveiled reproductive system abnormalities, including follicular membrane bleeding and follicular liquefaction. The isolated strain was inoculated into DF-1 cells and SPF chicken embryos, resulting in noticeable pathological changes within 48 hours. Animal experimental results indicated that virus viremia durations were consistently 5 days following intramuscular injection, subcutaneous injection in the neck, and oral administration of the challenge. Moreover, upon reintroduction of the isolated strain of Tembusu virus into chicken breed, significant lesions in the follicles were observed. Amino acid homology and phylogenetic tree analysis of the E protein indicated that the isolated strain HB202010 belonged to the same branch as the live vaccine strain FX2010-180P, and inactivated vaccine strains DF2 and HB, all falling under the China Isolate II branch. The isolated strain exhibited the highest homology with inactivated vaccine strains DF2 and HB, reaching 99.0%. The isolation and identification of Tembusu virus from chicken breeder lay a solid foundation for further exploring the impact of this virus on the egg production performance of chicken breeder and improving preventive and control measures in chicken breeder farms.
Keywords: Tembusu virus; chicken breeder; isolation and identification