食管可视化联合电位监测预防阵发性心房颤动射频消融术后食管损伤并发症的有效性与安全性
2024-06-18李军王慧俐李娜孙跃晖邵新王海雄
李军 王慧俐 李娜 孙跃晖 邵新 王海雄

摘要 目的:探讨食管可视化联合电位监测预防阵发性心房颤动射频消融术后食管损伤并发症的有效性及安全性。方法:选取2020年1月—2022年1月在山西省心血管病医院预行消融手术的阵发性心房颤动病人20例作为试验组,筛选同期基线资料相似的常规消融病人40例作为对照组。全身麻醉,气管插管,在CARTO3系统下,试验组在食管可视化联合电位监测辅助下完成双肺静脉隔离消融,对照组在左心房三维重建后完成双肺静脉隔离消融。结果:在CARTO3系统辅助下三维重建左心房及食管走形,食管走形位于左侧肺静脉处占70%。左心房后壁与食管前壁对应位置电位振幅差值与两点距离呈正相关(r=0.829,P<0.05)。试验组出现消化道症状2例(10.0%),对照组出现消化道症状14例(35.0%),试验组消化道症状发生率低于对照组(10.0%与35.0%,χ2=4.261,P=0.039)。试验组手术成功17例(85.0%),对照组手术成功33例(82.5%),两组手术成功率比较差异无统计学意义(P=0.806)。结论:通过食管走形可视化(CARTO3系统)联合电位监测来判断食管与左心房最近的部位并调整消融路径,可以减少消化道症状,不影响心房颤动消融效果。
关键词 心房颤动;食管可视化;电位监测;射频消融术;食管损伤
doi:10.12102/j.issn.1672-1349.2024.11.031
心房颤动是规则有序的心房电活动丧失,代之以快速无序的颤动波,是严重的心房电活动紊乱。心房颤动是脑卒中和心力衰竭的独立危险因素。近年来,指南推荐将导管射频消融作为阵发性心房颤动的一线治疗方法[1],但是Pappone等[2]报道心房颤动导管消融相关的心房-食管瘘[2],一旦出现心房-食管瘘会引起严重并发症,因此,消融左心房后壁时存在顾虑从而影响消融效果。鉴于食管调搏时可以在食管内记录到左房电位,不同部位电位的振幅不同。本研究拟通过食管走形可视化(CARTO3系统)联合电位监测来判断食管与左房相对最近的部位,调整消融策略,以期减少心房颤动射频消融术后食管损伤并发症的发生。
1 资料与方法
1.1 一般资料
选取2020年1月—2022年1月我院心血管内科收治的阵发性心房颤动病人20例作为试验组,采用食管可视化结合食管电位设计消融路径,筛选同期基线资料相似的行常规消融病人40例作为对照组。排除心脏瓣膜病及甲状腺功能亢进等继发心房颤动病人,所有病人均签署知情同意书,本研究经我院伦理委员会批准。两组一般资料比较见表1。
1.2 方法
试验组:在CARTO3系统下行心房颤动射频消融术,全身麻醉,气管插管,心电监护,将消融导管(强生Smart Touch)送至食管内进行FAM(fast anatomy
基金项目 山西省心血管病医院科研激励计划项目(No.XYS20200112)
通讯作者 王海雄,E-mail:cz1976whx@126.com
引用信息 李军,王慧俐,李娜,等.食管可视化联合电位监测预防阵发性心房颤动射频消融术后食管损伤并发症的有效性与安全性[J].中西医结合心脑血管病杂志,2024,22(11):2077-2080.
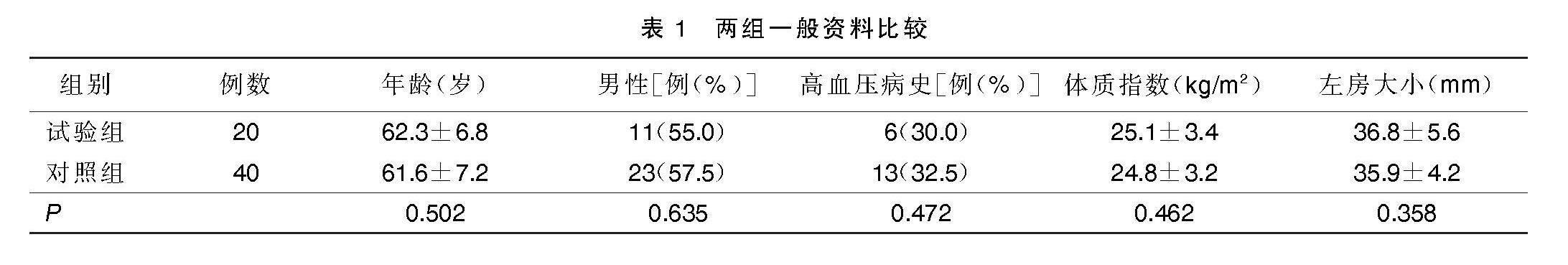
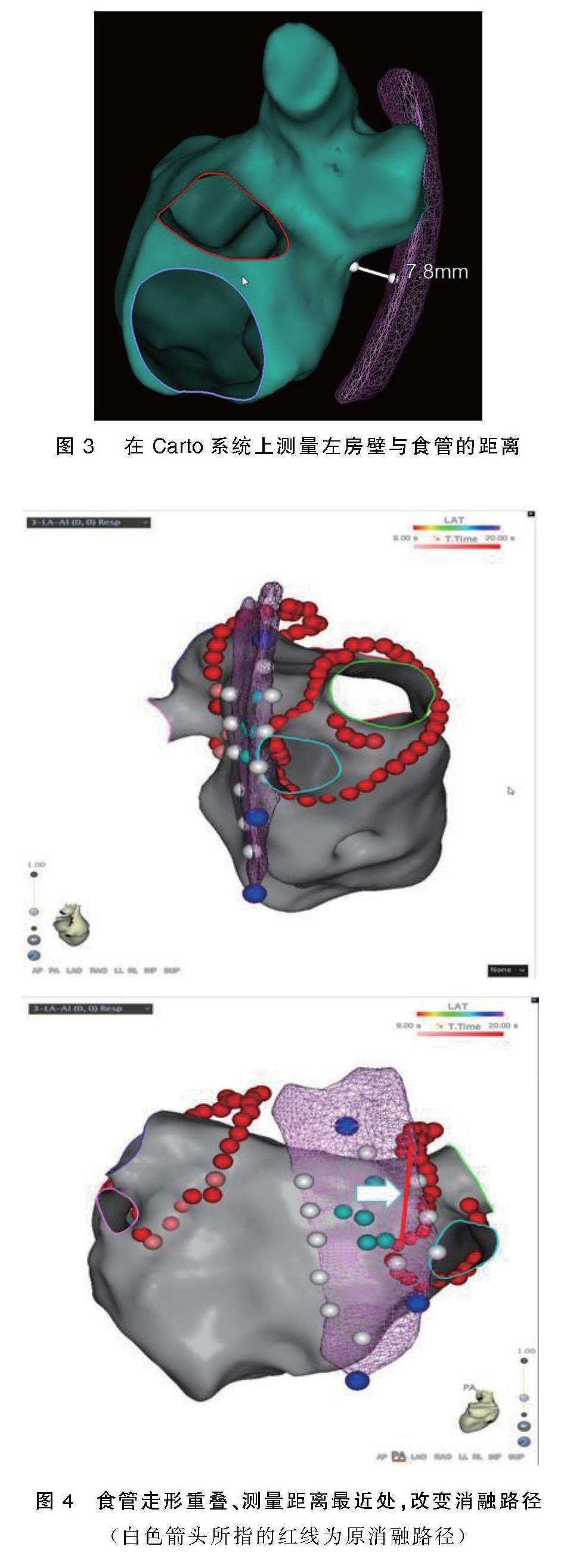
mapping)重建其走向,保持压力5~10 g,常规消毒,铺无菌单,穿刺股静脉,行房间隔穿刺,再用环形标测导管(强生 Lasso Nav Eco)行左房FAM重建,并与食管FAM匹配,在食管FAM中线上,上缘(由上及下出现电位处)和下缘(由上及下电位消失处)之间均匀取5个点,标记为A、B、C、D、E(见图1),并记录食管侧与左心房侧电位振幅并取点(见图2),再测量两点之间的距离(见图3),距离最近的地方改变消融路径(见图4),完成双侧肺静脉前庭消融并实现双向隔离。对照组:在CARTO3下行心房颤动射频消融术,全身麻醉,气管插管,心电监护,常规消毒,铺无菌单,穿刺股静脉,行房间隔穿刺,再用环形标测导管行左房FAM重建,完成双侧肺静脉前庭消融并实现双向隔离。 观察两组病人术后1个月内出现消化系统症状(腹痛、腹胀、纳差、恶心、呕吐等)情况。
1.3 统计学处理
采用SPSS 16.0软件进行统计分析。符合正态分布的定量资料以均数±标准差(x±s)表示,采用t检验;定性资料以例数、百分比(%)表示,采用χ2检验。相关性分析采用线性相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 食管走形与左心房位置的关系
位于左侧肺静脉处14例(70.0%),居中位置4例(20.0%),位于右侧肺静脉处2例(10.0%)。详见图5。
(A为食管走形位于左肺静脉侧;B为食管走形位于居中位置;C为食管走形位于右肺静脉侧)
2.2 相关性分析
左心房后壁与食管前壁对应位置电位振幅差值与两点距离呈正相关(r=0.895,P<0.05),差值增大,距离显著增加。
2.3 疗效观察
试验组出现消化道症状2例,发生率为10.0%,对照组出现消化道症状14例,发生率为35.0%,试验组消化道症状发生率低于对照组(χ2=4.261,P=0.039)。详见表2。
2.4 手术效果观察
随访1年,分别于第3个月、第6个月、第12个月时行动态心电图检查,超过30 s的心房颤动发作认为心房颤动术后复发,试验组手术成功17例(85.0%),对照组手术成功33例(82.5%),两组手术成功率比较差异无统计学意义(P=0.806)。
3 讨 论
心房颤动是21世纪心脏病学的最大挑战之一,我国的心房颤动病人约1 500万人。心房颤动是脑卒中和心力衰竭的独立危险因素。近年来,指南推荐将导管消融作为阵发性心房颤动的一线治疗方法[1]。Pappone等[2]最早报道心房颤动导管消融相关的心房-食管瘘,心房-食管瘘的发生是罕见的,但是其致死率高达80%[3-5],在此之后临床开始关注心房颤动消融后引起食管损伤,损伤程度从红斑到溃疡不等[6-7],还有研究表明左心房与食管存在大面积接触,接触部位垂直距离4.4 cm左右,左房后壁与食管前壁平均距离为2.6(1.4~6.0)mm,这样的解剖关系使得消融左房后壁时热传导容易损伤食管[8]。Ghia等[9]在美国进行的一项全国性调查显示,20 425例行左心房消融病人中6例发生食管-心房瘘(0.03%),所有病人均发生脑卒中,其中5例死亡,1例存活者遗留有偏瘫。为了预防和减少心房颤动射频术后食管损伤和食管心房-食管瘘的发生,Pappone等[2]提出了消融过程中持续监测食管温度,严格控制射频能量理念,Sherzer等[10]报道采用不透光的标测电极置入食管内作为食管标识,可提醒术者在食管走形部位高能量、长时间消融。Tsuchiya等[11]采用食管冷水灌注球囊可有效降低消融时食管温度,理论上可减少食管损伤程度,进而减轻食管损伤的发生。近年来也有学者尝试通过高功率短时长消融来减少食管损伤[12-13]。但目前尚无CARTO3系统下显示食管走形和消融术中监测食管电位的文献报道。本研究通过CARTO3系统联合电位监测来调整消融策略,以减少心房颤动射频消融术后食管损伤并发症的发生。
Biase等[7]研究认为全身麻醉状态下行心房颤动射频消融术增加食管损伤的发生率,全身麻醉状态下抑制了食管蠕动。那么研究在CARTO3系统辅助下三维重建左心房及食管走形,可使食管走形可视化,使左心房与食管的解剖关系明确,食管的走形多数毗邻左侧肺静脉。食管内温度监测是心房颤动射频消融时避免食管损伤最常用的方法,但是食管内的温度不能准确反映食管壁的温度[14],探索电位变化判断左房后壁与食管的距离具有重要价值,于左房后壁、食管前壁取点,并测量其电位振幅及两点之间的距离,每例病人自上而下取5组点位,考虑到每个人左房电位振幅不等,且心房与食管之间的组织厚度不同,不能较好反映振幅与距离的关系,所以采用左心房到食管电位振幅的衰减程度即左心房与食管记录到电位的振幅差值,探讨两点之间距离与电位振幅衰减的关系。分析显示左心房后壁与食管前壁对应位置电位振幅差值与两点距离呈正相关,差值增大,距离显著增加。对应位置电位振幅的衰减可以间接反映左心房后壁与食管前壁的距离。根据左心房与食管走形的解剖关系,联合电位变化来判断左心房与食管的距离并精准调整消融路径,证实减少心房颤动射频消融术后食管损伤相关症状的发生率,随访1年的心房颤动消融的成功率相似[15]。
综上所述,通过食管走形可视化(CARTO3系统)联合电位监测来判断食管与左心房最近的部位并调整消融路径,可以减少消化道症状,且不影响心房颤动消融效果。
参考文献:
[1] 刘旭.心房颤动导管消融学[M].2版.上海:上海交通大学出版社,2013:26-27.
[2] PAPPONE C,ORAL H,SANTINELLI V,et al.Atrio-esophageal fistula as a complication of percutaneous transcatheter ablation of atrial fibrillation[J].Circulation,2004,109(22):2724-2726.
[3] HALBFASS P,PAVLOV B,MLLER P,et al.Progression from esophageal thermal asymptomatic lesion to perforation complicating atrial fibrillation ablation:a single-center registry[J].Circulation Arrhythmia and Electrophysiology,2017,10(8):e005233.
[4] KAPUR S,BARBHAIYA C,DENEKE T,et al.Esophageal injury and atrioesophageal fistula caused by ablation for atrial fibrillation[J].Circulation,2017,136(13):1247-1255.
[5] TSCHABRUNN C M,SILVERSTEIN J,BERZIN T,et al.Comparison between single-and multi-sensor oesophageal temperature probes during atrial fibrillation ablation:thermodynamic characteristics[J].EP Europace,2015,17(6):891-897.
[6] SCHMIDT M,NLKER G,MARSCHANG H,et al.Incidence of oesophageal wall injury post-pulmonary vein antrum isolation for treatment of patients with atrial fibrillation[J].EP Europace,2008,10(2):205-209.
[7] BIASE L D,SAENZ L C,BURKHARDT D J,et al.Esophageal capsule endoscopy after radiofrequency catheter ablation for atrial fibrillation:documented higher risk of luminal esophageal damage with general anesthesia as compared with conscious sedation[J].Circulation Arrhythmia and Electrophysiology,2009,2(2):108-112.
[8] HELMS A,WEST J J,PATEL A,et al.Real-time rotational ICE imaging of the relationship of the ablation catheter tip and the esophagus during atrial fibrillation ablation[J].Journal of Cardiovascular Electrophysiology,2009,20(2):130-137.
[9] GHIA K K,CHUGH A,GOOD E,et al.A nationwide survey on the prevalence of atrioesophageal fistula after left atrial radiofrequency catheter ablation[J].Journal of Interventional Cardiac Electrophysiology,2009,24(1):33-36.
[10] SHERZER A I,FEIGENBLUM D Y,KULKARNI S,et al.Continuous nonfluoroscopic localization of the esophagus during radiofrequency catheter ablation of atrial fibrillation[J].Journal of Cardiovascular Electrophysiology,2007,18(2):157-160.
[11] TSUCHIYA T,ASHIKAGA K,NAKAGAWA S,et al.Atrial fibrillation ablation with esophageal cooling with a cooled water-irrigated intraesophageal balloon:a pilot study[J].Journal of Cardiovascular Electrophysiology,2007,18(2):145-150.
[12] KOTADIA I D,WILLIAMS S E,O′NEILL M.High-power,short-duration radiofrequency ablation for the treatment of AF[J].Arrhythmia & Electrophysiology Review,2020,8(4):265-272.
[13] HALBFASS P,WIELANDTS J Y,KNECHT S,et al.Safety of very high-power short-duration radiofrequency ablation for pulmonary vein isolation:a two-centre report with emphasis on silent oesophageal injury[J].EP Europace,2022,24(3):400-405.
[14] CUMMINGS J E,BARRETT C D,LITWAK K N,et al.Esophageal luminal temperature measurement underestimates esophageal tissue temperature during radiofrequency ablation within the canine left atrium:comparison between 8 mm tip and open irrigation catheters[J].J Cardiovasc Electrophysiol,2008,19:641-644.
[15] WYSE D G,WALDO A L,DIMARCO J P,et al.A comparison of rate control and rhythm control in patients with atrial fibrillation[J].New England Journal of Medicine,2002,347(23):1825-1833.
(收稿日期:2023-10-17)
(本文编辑郭怀印)
