酶-超声波辅助提取海蜇胶原蛋白及其组成分析
2024-06-17薛宇鑫于阔跃董高缘袁颖吕艳芳季广仁李颖畅
薛宇鑫 于阔跃 董高缘 袁颖 吕艳芳 季广仁 李颖畅
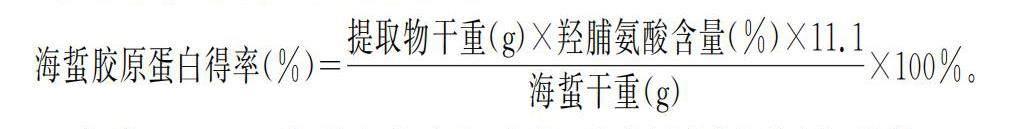


摘要:为确定酶-超声波辅助提取海蜇胶原蛋白的最佳工艺,采用单因素实验和响应面实验对工艺进行优化,考察胃蛋白酶添加量、提取时间、超声时间、超声功率对海蜇胶原蛋白得率的影响,并对胶原蛋白的氨基酸组成和结构进行分析。结果表明,酶-超声波辅助提取海蜇胶原蛋白的最佳条件为胃蛋白酶添加量1%、提取时间48 h、超声时间32 min、超声功率318 W,此时海蜇胶原蛋白得率为38.03%。甘氨酸是海蜇胶原蛋白中的主要氨基酸,为24.96%,海蜇胶原蛋白的紫外吸收峰位于235 nm处。在酰胺A、B带以及Ⅰ、Ⅱ、Ⅲ带中,有海蜇胶原蛋白的典型红外光谱特征吸收峰。该研究为海蜇深加工提供了理论基础。
关键词:海蜇;胶原蛋白提取;胃蛋白酶;超声波
中图分类号:TS254.9
文献标志码:A
文章编号:1000-9973(2024)06-0070-07
Extraction of Collagen from Jellyfish Using Enzyme-Ultrasound Assisted
Extraction Method and Analysis of Its Composition
XUE Yu-xin1, YU Kuo-yue1, DONG Gao-yuan1, YUAN Ying1,
LYU Yan-fang1, JI Guang-ren2, LI Ying-chang1*
(1.National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, College of Food Science and
Engineering, Bohai University, Jinzhou 121013, China; 2.Jinzhou Bijiashan
Food Co., Ltd., Jinzhou 121007, China)
Abstract: To determine the optimal process of enzyme-ultrasound assisted extraction of collagen from jellyfish, the process is optimized using single factor experiment and response surface experiment. The effects of pepsin addition amount, extraction time, ultrasound time and ultrasound power on the yield of jellyfish collagen are studied, and the composition of amino acids and structure of collagen are analyzed. The results show that the optimal conditions for enzyme-ultrasound assisted extraction of collagen from jellyfish are 1% pepsin, extraction time of 48 h, ultrasound time of 32 min and ultrasound power of 318 W, at this time, the yield of jellyfish collagen is 38.03%. Glycine is the main amino acid in jellyfish collagen, and the content is 24.96%. The UV absorption peak of jellyfish collagen is at 235 nm. There are typical infrared spectral characteristic absorption peaks of jellyfish collagen in amide A and B bands as well as Ⅰ, Ⅱ and Ⅲ bands. This study has provided a theoretical basis for the deep processing of jellyfish.
Key words: jellyfish; collagen extraction; pepsin; ultrasound
收稿日期:2023-12-11
基金项目:基层科普行动计划项目(JCKPXDJH2023);辽宁省区域创新联合基金(2020-YKLH-25)
作者简介:薛宇鑫(2000—),女,硕士研究生,研究方向:水产品加工与贮藏。
*通信作者:李颖畅(1973—),女,教授,博士,研究方向:水产品加工与贮藏。
被誉为“海产八珍”之一的海蜇(Rhopilema esculentum Kishinouye)属于暖水性水母类,为白色、青色或微黄色,具有药食两用的功效,有很高的经济价值和药用价值[1-3]。海蜇蛋白质占总干重质量的50%,其中胶原蛋白含量最高[4]。胶原蛋白主要来源于陆生动物,但由于这类胶原蛋白可能会引起人畜共患病,研究人员将目光转向水产类胶原蛋白。当前市场上已涌现出多种以鱼肉和鱼皮为原料的胶原蛋白产品[5-6]。胶原蛋白的提取方法主要分为酸法提取、酶法提取、碱法提取、热水提取、盐溶液提取。酸法提取容易破坏蛋白质结构,碱法提取会使蛋白质发生消旋现象[7]。其他提取胶原蛋白的方法会导致胶原组织分解不彻底,胶原蛋白得率较低。超声波是一种频率介于20 kHz~100 MHz之间的机械波,低强度的超声波作为一种安全高效的物理辅助方式,可以引起溶液的机械振动,使溶剂更好地进入物质内部,引发串联式作用,促进反应快速发生[8-9]。衣程远等[10]采用低强度超声波辅助提取大豆蛋白,蛋白得率优于碱溶酸沉法。李朝蕊等[11]也发现超声处理可促进蛋白溶解,在蛋白乳化中也可发挥作用。本研究采用低强度超声波和酶法辅助提取海蜇胶原蛋白,以期提高海蜇胶原蛋白得率,并对所得海蜇胶原蛋白组成进行分析,为海蜇的深加工提供了理论基础,拓宽了水产胶原蛋白的应用范围。
1 材料与方法
1.1 材料与试剂
海蜇皮(食用级):锦州市林西水产市场;乙酸(36%,分析纯)、羟脯氨酸试剂盒:上海阿拉丁生化科技股份有限公司;胃蛋白酶(≥3 000 U/mg):上海麦克林生化科技股份有限公司;透析袋:上海源叶生物科技有限公司。
1.2 仪器与设备
Scientz-ⅡD超声波细胞粉碎机 宁波新芝生物科技股份有限公司;FreeZone 2.5 L真空冷冻干燥机 美国Labconco公司;UV-2550紫外可见分光光度计 岛津仪器(苏州)有限公司;L-8900全自动氨基酸分析仪 日立高新技术有限公司;8H-3数显磁力加热搅拌器 锦州药业(集团)器化玻有限公司;Scimitar 2000傅里叶变换红外光谱仪 美国安捷伦公司;MS105DU电子分析天平 梅特勒-托利多仪器(上海)有限公司;Thermo X1R高速冷冻离心机 美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 海蜇皮前处理
将盐渍海蜇皮用自来水反复冲洗,冲洗后的海蜇皮浸泡在超纯水中12 h,每3 h换一次水,将超纯水浸泡后的海蜇皮沥干水分,放入密封袋中置于4 ℃冰箱中备用。将脱盐处理后的海蜇皮放入0.1 mol/L NaOH溶液中,用磁力搅拌器缓慢搅拌3 d,搅拌过程中每8 h更换一次氢氧化钠溶液,之后将海蜇皮捞出,用蒸馏水反复清洗至中性,切分成2 cm×2 cm×0.5 cm大小方块后沥干备用。
1.3.2 海蜇胶原蛋白提取方法
将上述处理后的海蜇皮浸泡在0.5 mol/L乙酸溶液中,料液比为1∶1,加入一定量胃蛋白酶进行消解后离心,以10 000 r/min离心20 min(4 ℃),随后将上清液装入透析袋中,于0.02 mol/L Na2HPO4溶液中进行透析,透析液的量为透析袋内溶液体积的15~20倍,透析过程中每6 h更换一次透析液,透析3 d后以10 000 r/min离心,弃上清液,将沉淀复溶于0.5 mol/L乙酸溶液中,冻干后于-80 ℃冰箱中保存。
1.3.3 海蜇中胶原蛋白含量的测定
胶原蛋白中含有一种独特的氨基酸,即羟脯氨酸。因此通常采用羟脯氨酸的含量来确定胶原蛋白的含量。羟脯氨酸含量采用羟脯氨酸试剂盒测定。海蜇胶原蛋白得率计算公式如下:
海蜇胶原蛋白得率(%)=提取物干重(g)×羟脯氨酸含量(%)×11.1海蜇干重(g)×100%。
式中:11.1为胶原蛋白水解为羟脯氨酸的系数。
1.3.4 单因素实验
在海蜇胶原蛋白提取实验中,分别设置胃蛋白酶添加量为0%、0.25%、0.5%、0.75%、1%、1.25%,提取时间为0,12,24,36,48,60 h,超声时间为0,10,20,30,40,50 min,超声功率为0,100,200,300,400,500 W,平行3次,以海蜇胶原蛋白得率为指标分析胃蛋白酶添加量、提取时间、超声时间、超声功率对海蜇胶原蛋白得率的影响。
1.3.5 响应面优化
基于Box-Behnken实验设计,选取酶添加量(A)、提取时间(B)、超声时间(C)和超声功率(D)4个因素对海蜇胶原蛋白提取工艺进行优化,响应面实验设计见表1。
1.3.6 氨基酸组成分析
参考GB 5009.124—2016中食品氨基酸检测方法[12],将上述制备好的海蜇胶原蛋白试样取40 mg溶于15 mL 6 mol/L盐酸溶液中,加苯酚3滴,置于蒸煮袋内真空密封,放入110 ℃的环境中振荡22 h,振荡结束后取出,然后用氨基酸自动分析仪对其进行分析。
1.3.7 紫外光谱分析
将冻干的海蜇胶原蛋白样品溶解于0.5 mol/L的醋酸溶液中,得到胶原蛋白溶液,以 10 000 r/min离心5 min,收集上清液。用紫外分光光度计在 200~400 nm的波长范围内进行扫描,以乙酸溶液为空白对照。
1.3.8 傅里叶变换红外光谱分析
参考Zhu等[13]的方法,将制备的海蜇胶原蛋白样品与经过干燥处理的溴化钾粉末磨碎混合,用压力机将其压成薄片,置于傅里叶变换红外光谱仪中,在500~4 000 cm-1的波长范围内进行扫描。
1.4 数据分析
数据采用SPSS数据分析软件进行统计分析,并用Origin软件制作相关图表。
2 结果与分析
2.1 酶添加量对海蜇胶原蛋白得率的影响
由图1可知,随着酶添加量的增加,海蜇胶原蛋白得率呈现先上升后下降的趋势。当酶添加量为1%时,胶原蛋白得率最高,达到32.38%;当酶添加量超过1%并持续增加时,酶对胶原蛋白非螺旋区域产生作用,造成胶原蛋白得率略有降低,所以酶添加量初步确定为0.75%~1.25%。
2.2 提取时间对海蜇胶原蛋白得率的影响
由图2可知,随着提取时间的延长,海蜇胶原蛋白得率增加,48 h后胶原蛋白得率趋于平衡。由于胶原蛋白溶出过程是溶质、溶剂双向传递过程,未达到平衡前,溶剂中胶原蛋白含量随着时间的延长而不断增加,达到平衡后,一部分胶原蛋白和酶相互作用水解成胶原蛋白多肽,使得率略有降低,在48 h时胶原蛋白得率高达33.1%。所以,提取时间初步确定为36~60 h。
2.3 超声时间对海蜇胶原蛋白得率的影响
由图3可知,随着超声时间的延长,胶原蛋白得率呈现先上升后下降的趋势。超声时间为10 min时胶原蛋白得率显著升高,表明超声波能提高胶原蛋白得率并缩短提取时间。同时,超声波作用30 min时得率最高,此时海蜇胶原蛋白几乎全部溶解于提取液中;超声时间持续增加所引起的热效应造成局部高温状态,促使胶原蛋白水解成多肽,使海蜇胶原蛋白得率呈降低趋势,所以超声时间可初步确定为20~40 min。
2.4 超声功率对海蜇胶原蛋白得率的影响
由图4可知,随着超声功率的增加,海蜇胶原蛋白得率基本呈增加趋势。超声功率从0 W上升到100 W的过程中胶原蛋白得率升高最快,海蜇胶原蛋白多数已经溶解在提取液中。随着超声功率不断增加,胶原蛋白得率上升缓慢,超声功率达到300 W时胶原蛋白得率最高,达到32.38%,所以超声功率初步确定为200~400 W。
2.5 响应面实验设计与结果
采用响应面分析法对海蜇胶原蛋白的提取工艺进行优化,并基于Box-Behnken实验设计,选取酶添加量(A)、提取时间(B)、超声时间(C)和超声功率(D)4个因素进行四因素三水平响应面实验。响应面实验设计和结果见表2。
回归方程方差分析结果见表3。
通过Design-Expert 10.0.3软件对实验数据进行分析,得到海蜇胶原蛋白得率的二次多项回归方程:Y=37.209 9-0.069 166 7A+1.339 92B+2.563 32C+2.752 87D-1.597 6AB+0.976 022AC+0.810 054AD-4.526 59BC-1.819 01BD-2.498 28CD-2.741 91A2-4.085 04B2-5.055 12C2-6.210 55D2。
F值代表各变量对响应值的影响程度,且变量和响应值之间的关系为正相关。模型的F=28.16,P<0.01,表明建立的模型达到极显著水平;在显著性检验概率P<0.05的情况下,得出模型具有统计学意义。失拟项的F=3.86,P=0.102 5>0.05,失拟项不显著,表明二次多项模型的拟合程度良好。其中,该模型中的一次项C、D,交互项BC、CD,二次项A2、B2、C2、D2对海蜇胶原蛋白得率的影响极显著;一次项B、交互项AB、BD对海蜇胶原蛋白得率的影响显著。由表3可知,4个因素对海蜇胶原蛋白得率的影响程度排序为D>C>B>A,即超声功率>超声时间>提取时间>酶添加量。模型的决定系数R2为0.965 7,表明该模型具有较高显著性,回归方程有较好的相关性;变异系数RAdj2=0.931 4,表明该回归模型中93.14%的响应值随自变量发生变化,且与预测相关系数RPred2接近,说明此实验模型与真实数据的拟合程度良好,具有实践指导意义,由此可以采用该模型分析和预测得率最优的提取工艺。
2.6 响应面分析
由图5可知,酶添加量和提取时间的交互作用对胶原蛋白的得率影响趋势表现为抛物曲面,曲面总体纵向跨度大,等高线表现为明显的椭圆形,说明两者交互作用显著影响胶原蛋白得率。胶原蛋白得率随着酶添加量和提取时间的增加均呈先上升后下降变化趋势。酶添加量为0.875%~1.125%、提取时间为48~54 h时可显著提高胶原蛋白得率。
由图6可知,提取时间和超声时间的交互作用等高线呈现椭圆形,3D曲面纵向跨度较大,说明提取时间和超声时间的交互作用对胶原蛋白得率的影响显著。在提取时间低于48 h的情况下,胶原蛋白得率和提取时间呈正相关关系;当提取时间超过48 h后,它们之间的相关关系出现转折,取临界最佳工艺参数,当提取时间接近48 h时,胶原蛋白得率最高,同理胶原蛋白得率最高临界最佳工艺参数约为30~35 min。
由图7可知,提取时间和超声功率的交互作用对胶原蛋白得率的影响呈抛物曲面,二者交互作用显著,超声功率是影响胶原蛋白得率的敏感因子,随着超声功率和超声时间的提高,胶原蛋白得率呈先上升后下降的趋势,提取时间为42~54 h、超声功率为300~350 W时对胶原蛋白得率的提高有利。
由图8可知,超声时间和超声功率的交互作用响应曲面陡峭趋势明显,二者交互作用等高线呈现椭圆形,表明超声时间与超声功率均对海蜇胶原蛋白得率有显著影响,随着超声时间的延长和超声功率的增大,胶原蛋白得率先升高后降低。超声时间30~40 min、超声功率300~350 W时可显著提高胶原蛋白得率。
采用Design-Expert 10.0.3软件对海蜇胶原蛋白的提取工艺进行优化,得出在酶添加量、提取时间、超声时间和超声功率这4个因素相互影响下,海蜇胶原蛋白得率最优的提取工艺为酶添加量1.014%、提取时间47.916 h、超声时间32.171 min和超声功率318.219 W。在该条件下,预测模型的胶原蛋白得率为37.733%。
根据上述模型预测结果及海蜇胶原蛋白实际工艺操作可行性,采用酶添加量1%、提取时间48 h、超声时间32 min、超声功率318 W为海蜇胶原蛋白提取条件。进行3次平行实验,海蜇胶原蛋白平均得率为38.03%,与模型的预测结果高度吻合,表明基于该响应面模型优化海蜇胶原蛋白提取工艺有效可行。
2.7 氨基酸组成分析
由表4可知,海蜇胶原蛋白所含的氨基酸种类较多,主要有缬氨酸、苯丙氨酸、苏氨酸、异亮氨酸、赖氨酸、蛋氨酸和亮氨酸7种必需氨基酸。主要氨基酸为甘氨酸,占海蜇胶原蛋白氨基酸总量的24.96%。甘氨酸的侧链由单独的氢原子组成,存在于海蜇胶原蛋白螺旋结构的中间位置,促使胶原蛋白的3个螺旋缠绕形成超螺旋结构,对超螺旋结构的稳定发挥着重要作用[14]。研究表明,胶原蛋白中的羟脯氨酸可在链间通过羟基形成氢键,同时与同为亚氨基酸的脯氨酸在限制肽链二级结构变化中发挥重要作用[15],更好地维持海蜇胶原蛋白超螺旋结构的稳定。
2.8 紫外光谱分析
由图9可知,海蜇胶原蛋白的最大吸收峰在235 nm处,这主要与海蜇胶原蛋白中含有的羰基、羧基基团有关[16-18],且胶原蛋白中肽链弯曲会导致由CO引起的吸收峰发生红移;与其他来源的水产类胶原蛋白的吸收特征一致。另外,在275 nm处有一微弱吸收峰,与氨基酸分析相结合,推测是胶原蛋白分子中所含酪氨酸残基上共轭双键造成的[19]。
2.9 傅里叶红外光谱分析结果
由图10可知,酰胺A带位于3 279.61 cm-1处,表明海蜇胶原蛋白中存在氢键,氮氢键的伸缩振动范围为3 390~3 420 cm-1,当与胶原蛋白中羰基结合形成氢键后,其波数会移至3 300 cm-1附近。酰胺B带位于2 923.15 cm-1处,是碳氢键的不对称伸缩振动导致的。此外,海蜇胶原蛋白的氨基酸序列和三螺旋结构与酰胺Ⅰ、Ⅱ带和Ⅲ带的伸缩振动密切相关[20]。在1 645.21 cm-1处酰胺Ⅰ带表现出最强的吸收能力,这是由于海蜇胶原蛋白处于交联状态时,肽链中碳氧双键的伸缩振动导致的[21]。
酰胺Ⅱ带位于1 550~1 600 cm-1处[22],酰胺Ⅱ带位于1 543.17 cm-1处,是由氮氢键的弯曲振动以及碳氮键的耦合引起的。酰胺Ⅲ带位于1 000~1 400 cm-1处,酰胺Ⅲ带呈现出明显的特征峰,而在酰胺A、B带以及Ⅰ、Ⅱ、Ⅲ带中,可以观察到海蜇胶原蛋白的典型红外光谱特征吸收峰。
3 结论
通过单因素实验和响应面优化确定了海蜇胶原蛋白提取的最佳实验条件为酶添加量1%、提取时间48 h、超声时间32 min、超声功率318 W,此时海蜇胶原蛋白得率为38.03%。氨基酸分析结果表明,海蜇胶原蛋白中含有缬氨酸、苯丙氨酸、苏氨酸、异亮氨酸、赖氨酸、蛋氨酸、亮氨酸7种必需氨基酸,主要氨基酸为甘氨酸,占氨基酸总量的24.96%;紫外光谱与傅里叶红外光谱结果表明海蜇胶原蛋白结构具有典型的胶原蛋白特征。海蜇胶原蛋白的提取过程采用胃蛋白酶-超声辅助提取方法,提高了海蜇胶原蛋白得率,提升了海蜇的应用价值。
参考文献:
[1]WRIGHT R M, QU? R? C L, BUITENHUIS E, et al. Role of jellyfish in the plankton ecosystem revealed using a global ocean biogeochemical model[J].Biogeosciences,2021(4):1291-1320.
[2]JAMES R, BRODEUR R D, KRISTIN C, et al. Examining the ecological role of jellyfish in the Eastern Bering Sea[J].ICES Journal of Marine Science,2019(2):791-802.
[3]WU P X, YANG Z, XIN L, et al. The impact of giant jellyfish Nemopilema nomurai blooms on plankton communities in a temperate marginal sea[J].Marine Pollution Bulletin,2019(12):1-8.
[4]庄永亮,李八方,赵雪,等.酶解海蜇胶原蛋白制备抗氧化肽工艺[J].农业工程学报,2009,25(1):129-133.
[5]LI P H, LU W C, CHAN Y J, et al. Extraction and characterization of collagen from sea cucumber (Holothuria cinerascens) and its potential application in moisturizing cosmetics[J].Aquaculture,2020,515:734590.
[6]AHMED R J, HAP M, CHUN B S. Characterization of marine derived collagen extracted from the by-products of bigeye tuna (Thunnus obesus)[J].International Journal of Biological Macromolecules,2019,135:668-676.
[7]MOMEN S, ALAVI F, AIDER M. Alkali-mediated treatments for extraction and functional modification of proteins: critical and application review[J].Trends in Food Science & Technology,2021,110:778-797.
[8]TRINDADE A S N, DANTAS A F, LIMA D C, et al. Multivariate optimization of ultrasound-assisted extraction for determination of Cu, Fe, Ni and Zn in vegetable oils by high-resolution continuum source atomic absorption spectrometry[J].Food Chemistry,2015,185:145-150.
[9]赖红芳,黄秀香,陆俊宇.超声波辅助提取山豆根中的黄酮和多糖工艺优化[J].食品与机械,2014,30(1):196-198,223.
[10]衣程远,孙冰玉,刘琳琳,等.超声处理对大豆蛋白结构及性质的影响研究进展[J].中国调味品,2022,47(12):197-200.
[11]李朝蕊,韩馨蕊,范鑫,等.超声对豌豆分离蛋白结构及乳化性能的调控效应[J].中国农业科学,2021,54(22):4894-4905.
[12]国家食品药品监督管理总局,国家卫生和计划生育委员会.食品安全国家标准 食品中氨基酸的测定:GB 5009.124—2016[S].北京:中国标准出版社,2016.
[13]ZHU S C, YUAN Q J, YANG M T, et al. A quantitative comparable study on multi-hierarchy conformation of acid and pepsin-solubilized collagens from the skin of grass carp (Ctenopharyngodon idella)[J].Materials and Engineering,2019,96(3):446-457.[14]BAE I, OSATOMI K, YOSHIDA A, et al. Biochemical properties of acid-soluble collagens extracted from the skins of underutilise fishes[J].Food Chemistry,2008,108(1):49-54.
[15]REGENSTEIN J M, ZHOU P. Maximising the Value of Marine By-Products[M].Cambridge:Woodhead Publishing,2007:197-229.
[16]NALINANON S, BENJAKUL S, KISHIMURA H, et al. Type I collagen from the skin of ornate threadfin bream (Nemipterus hexodon): characteristics and effect of pepsin hydrolysis[J].Food Chemistry,2011,125(2):500-507.
[17]BAIRATI A, GIORIA M. Collagen fibrils of an invertebrate (Sepia officinalis) are heterotypic: immunocytochemical demonstration[J].Journal of Structural Biology,2004,147(2):159-165.
[18]FOEGEDING E A, LANIER T C, HULTIN H O. Characteristics of edible muscle tissues. In: Owen Fennema R (Ed.)[J].Food Chemistry,1996,3(15):879-942.
[19]VEERURAJ A, ARUMUGAM M, BALASUBRAMANIAN T. Isolation and characterization of thermostable collagen from the marine eel-fish (Evenchelys macrura)[J].Process Biochemistry,2013,48(10):1592-1602.
[20]沈同,王镜岩.生物化学(第二版)[M].北京:中国环境科学出版社,2007:320-323.
[21]STANI C, VACCARI L, MITRI E, et al. FTIR investigation of the secondary structure of type Ⅰ collagen: new insight into the amide Ⅲ band[J].Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2020,229:118006.
[22]JEONGH S, VENKATESAN J, KIM S K. Isolation and characterization of collagen from marine fish (Thunnus obesus)[J].Biotechnology and Engineering,2013,18(6):1185-1191.
