东北酸菜发酵过程中细菌菌群与亚硝酸盐长消变化关系
2024-06-17张庆芳袁文涛孙溪魏振勇周姝静迟乃玉于爽
张庆芳 袁文涛 孙溪 魏振勇 周姝静 迟乃玉 于爽

摘要:为探究东北酸菜发酵过程中细菌菌群与亚硝酸盐长消变化关系,实验设立了两种封闭发酵系统,即未添加亚硝酸盐(自然发酵组)、添加亚硝酸盐(对照组),结合主要理化指标(亚硝酸盐、pH值等)对两个系统内不同发酵阶段的酸菜发酵液(相对丰度排名前30)中的菌属进行比对分析。实验研究了不同发酵阶段有、无添加亚硝酸盐样品的菌群变化,结果表明,添加亚硝酸盐对整个发酵周期中细菌的生长都具有影响,亚硝酸盐使优势乳酸菌菌属(Lactococcus、Leuconostoc、Lactobacillus)、α-变形菌菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、Aureimonas、Brevundimonas、Methylobacterium、Sphingomonas)、β-变形菌菌属(Acidovorax、Aquabacterium、Comamonas、Delftia、Herbaspirillum、Methylophilus、Methylovorus)、CFB类菌属(Dyadobacter、Pedobacter、Sphingobacterium)和未培养菌属(Brassica_napus_rape、uncultured_bacterium_f_Chitinophagaceae、uncultured_bacterium_f_env.OPS_17、uncultured_bacterium_o_Chloroplast)在发酵初期相对丰度增加;使致病菌菌属(Acinetobacter、Alkanindiges、Chryseobacterium、Enterococcus、Serratia、uncultured_bacterium_f_Burkholderiaceae、uncultured_bacterium_f_Enterobacteriaceae、uncultured_bacterium_f_Xanthobacteraceae)相对丰度始终处于低水平状态。在S系统内,发酵前期为亚硝酸盐积累阶段,此时Lactococcus、Leuconostoc为优势乳酸菌菌属,而达到发酵中后期时Lactobacillus成为绝对优势乳酸菌菌属;在发酵初期,Acinetobacter、Enterococcus、Serratia、uncultured_bacterium_f_Enterobacteriaceae等致病菌大量繁殖,导致亚硝酸盐大量积累,而积累的亚硝酸盐使这些致病菌的相对丰度始终处于低水平状态,其中对Serratia的生长影响最显著。
关键词:东北酸菜;亚硝酸盐;细菌菌群;优势乳酸菌;致病菌
中图分类号:TS255.53
文献标志码:A
文章编号:1000-9973(2024)06-0050-14
Relationships Between Bacterial Flora and Growth and Decline of Nitrite
During Fermentation of Northeast Sauerkraut
ZHANG Qing-fang1,2, YUAN Wen-tao1,2, SUN Xi1,2, WEI Zhen-yong1,2,
ZHOU Shu-jing1,2, CHI Nai-yu1,2*, YU Shuang1,2*
(1.College of Life and Health, Dalian University, Dalian 116622, China; 2.Engineering and Technology
Research Center for Marine Microorganism in Liaoning Province, Dalian 116622, China)
Abstract: To investigate the relationship between bacterial flora and growth and decline of nitrite during fermentation of northeast sauerkraut, in this experiment, two closed fermentation systems are set up, namely, nitrite is not added (natural fermentation group) and nitrite is added (control group). In combination with the main physicochemical indexes (nitrite, pH value and so on), the bacterial species in the fermentation broth of sauerkraut at different fermentation stages (relative abundance ranking top 30) in the two systems are compared and analyzed. In this experiment, the changes of the bacterial flora of samples with and without nitrite at different fermentation stages are investigated. The results show that the addition of nitrite has an effect on the growth of bacteria throughout the fermentation cycle, and that nitrite makes the relative abundance of the dominant Lactobacillus genera (Lactococcus, Leuconostoc, Lactobacillus), α-Proteus (Allorhizobium-Neorhizobium-Parararhizobium-Rhizobium, Aureimonas, Brevundimonas, Methylobacterium, Sphingomonas), β-Proteus (Acidovorax, Aquabacterium, Comamonas, Delftia, Herbaspirillum, Methylophilus, Methylovorus), CFB genera (Dyadobacter, Pedobacter, Sphingobacterium) and uncultured genera (Brassica_napus_rape, uncultured_bacterium_f_Chitinophagaceae, uncultured_bacterium_f_env.OPS_17, uncultured_bacterium_o_Chloroplast) increase in the early stages of fermentation; and it makes the relative abundance of pathogenic bacteria genera (Acinetobacter, Alkanindiges, Chryseobacterium, Enterococcus, Serratia, uncultured_bacterium_f_Burkholderiaceae, uncultured_bacterium_f_Enterobacteriaceae, uncultured_bacterium_f_Xanthobacteraceae) always stay in a low-level state.In the S system,the early stage of fermentation is the nitrite accumulation stage. At this time, Lactococcus and Leuconostoc are the dominant Lactobacillus, and Lactobacillus becomes the absolute dominant Lactobacillus at the middle and late stages of fermentation. In the early stage of fermentation, the pathogenic bacteria such as Acinetobacter, Enterococcus, Serratia and uncultured_bacterium_f_Enterobacteriaceae proliferates largely, leading to a large accumulation of nitrite, and the accumulated nitrite keeps the relative abundance of these pathogenic bacteria always at a low-level state, with the most significant effect on the growth of Serratia.
Key words: northeast sauerkraut; nitrite; bacterial flora; dominant Lactobacillus; pathogenic bacteria
收稿日期:2023-11-28
基金项目:国家重点研发计划(2018YFC0311100)
作者简介:张庆芳(1965—),女,教授,博士,研究方向:微生物及酶工程的基础理论与应用。
*通信作者:迟乃玉(1965—),男,教授,博士,研究方向:微生物及酶工程的基础理论与应用;
于爽(1986—),男,教授,博士,研究方向:微生物及酶工程的基础理论与应用。
东北酸菜(northeast sauerkraut)是一种以大白菜为原材料的发酵蔬菜,口味咸酸,有开胃健食、润肠通便、杀菌抗炎、促进消化的效果,营养价值丰富[1]。在东北酸菜发酵期间,除乳酸菌之外的一些杂菌生长繁殖产生的硝酸盐还原酶会将蔬菜本身含有的硝酸盐还原成亚硝酸盐[2-3],亚硝酸盐是一种潜在的致癌物质,同时也是一种常用的食品防腐剂。所以,控制发酵蔬菜食品中的亚硝酸盐含量对于提高发酵蔬菜食品的安全性至关重要。但无法分析东北酸菜在发酵过程中产生的一定含量的亚硝酸盐对细菌菌群的影响,从而不能得出两者之间的明确关系。
随着科学技术的不断发展,人们已经对发酵蔬菜中微生物多样性开展了多方位的研究。Wu等[4]利用DGGE分析东北酸菜发酵过程中的微生物多样性,鉴定出14种细菌。Yang等[5]对来自3个不同家庭的酸菜进行了微生物群落动态分析,发现魏斯氏菌属、乳杆菌属、梭状芽孢菌属、肠杆菌属是酸菜中菌群结构的主要部分。刘长根[6]通过高通量测序分析得出东北酸菜微生物中有17个门,35个纲,77个目,145个科,408个属,283个种和1 414个OTU。Yang等[7]研究发现萝卜泡菜中细菌多样性随着发酵的进行而显著下降。Chen等[8]、Gou等[9]、Huang等[10]、Liu等[11]、Ren等[12]、Shen等[13]、Yun等[14]对不同酒曲和原料发酵的酒类微生物的多样性进行了研究。Shan等[15]研究表明,云南宣威火腿核心发酵菌属为孢囊放线菌属、乳酸杆菌、棒状杆菌属、小单孢菌属、链霉菌。Lin等[16]和Xiang等[17]研究发现Lactobacillus能减少4种苦味氨基酸的含量,具有降低发酵蔬菜苦味的功效,还能提高发酵蔬菜的感官品质和风味。Liang等[18]和Peng等[19]也发现Lactobacillus参与碳水化合物、氨基酸、脂类的代谢,从而形成风味物质。Guo等[20]利用宏基因组技术在白酒窖泥中发现乳酸菌、芽孢杆菌和梭菌等细菌与乳酸、乙酸等有机酸及乙醇、酯类等风味化合物产生有关,而半乳酵母、青霉菌和曲霉菌等真菌微生物在白酒发酵中可以产生葡萄糖淀粉酶和α-淀粉酶,这对糖酵解过程影响显著并可将淀粉等大分子物质降解为小分子糖。虽然目前已有大量发酵蔬菜及其他发酵食品中微生物多样性和呈味物质的相关研究,但通过高通量测序结合OD600 nm值和理化指标进行监测进而探究亚硝酸盐对发酵蔬菜不同发酵阶段细菌菌群影响的研究尚少。
本研究以东北酸菜为研究对象,采用一种东北酸菜小型发酵体系[21],即使用无菌且统一规格的矿泉水瓶作为发酵容器。将发酵温度和腌渍方式进行优化后,确定25 ℃为本研究发酵体系中的最适发酵温度。并基于Illumina NovaSeq测序平台,采用16S rRNA高通量测序技术,对生渍法发酵条件下有、无添加亚硝酸盐的东北酸菜发酵过程中不同发酵时间点的细菌菌群进行分析;同时对细菌菌群生长(OD600 nm)及生理代谢相关的主要理化指标(pH、总酸、亚硝酸盐)进行监测,进而探究东北酸菜不同发酵阶段亚硝酸盐与菌群的关系。本研究旨在探究亚硝酸盐对东北酸菜不同发酵阶段菌群的影响,从而为东北酸菜及其他发酵蔬菜的开发提供更多的基础理论依据,并消除了人们对东北酸菜中亚硝酸盐安全性的疑虑。
1 材料与方法
1.1 材料与试剂
新鲜大白菜;硼砂、亚铁氰化钾、乙酸锌、亚硝酸钠、对氨基苯磺酸、盐酸萘乙二胺、氢氧化钠、酚酞、胰蛋白胨、酵母浸膏、葡萄糖、琼脂(均为分析纯):上海麦克林生化科技股份有限公司;DP812土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;16S rRNA基因V3~V4区引物合成及建库测序:由北京百迈客生物科技有限公司完成。
1.2 仪器与设备
PHS-3E型pH计 上海仪电科学仪器股份有限公司;CRY-2112恒温摇床 上海茸研仪器有限公司;DK-S26电热恒温水浴锅 上海精宏实验设备有限公司;Thermo Multiskan 1510酶标仪 芬兰Labsystems公司;AL204电子天平 梅特勒-托利多仪器(上海)有限公司;UV-1200型紫外可见分光光度计 上海美谱达仪器有限公司。
1.3 实验方法
1.3.1 酸菜的制作工艺流程及操作要点
制作工艺流程:挑选新鲜大白菜→清洗→沥水→切丝混匀→装瓶→注盐水→封盖→恒温发酵→酸菜成品。
操作要点:设置添加亚硝酸盐(亚硝酸钠:100 mg/L)组和未添加亚硝酸盐组,其中未添加亚硝酸盐组为对照组。挑选新鲜大白菜,清理好外层叶片,将白菜顺着菜帮掰成若干片后,用清水清洗干净,沥干表面水分后将白菜切成0.5~1 cm的均匀细丝。注意保证不同部位的白菜细丝混匀,选用统一规格的555 mL PET材料制备的东北酸菜发酵容器若干瓶,每瓶分装160 g混匀的白菜丝,再注入1.5%盐水至满瓶,最终形成封闭发酵体系,将全部酸菜放置于25 ℃恒温培养箱中发酵一定时间,得到酸菜成品。
1.3.2 酸菜理化指标的测定
每瓶酸菜代表一个独立的时间点,从1 h开始取样测量,然后分别在13 h、25 h、73 h、15 d取样一次。将添加亚硝酸盐组中发酵1 h、13 h、25 h、73 h、15 d的样本依次命名为YS1、YS2、YS3、YS4、YS5,YS1~YS5的分组命名为Y组;将未添加亚硝酸盐组中发酵1 h、13 h、25 h、73 h、15 d的样本依次命名为S1、S2、S3、S4、S5,S1~S5的分组命名为S组。
将瓶内酸菜与发酵液倒入烧杯中,将其全部研磨后制成匀浆,分别称取10 g酸菜匀浆作为待测样品,进行理化指标的检测[22-24]。pH的测定:使用pH计;总酸含量的测定:参照GB 12456—2021《食品安全国家标准 食品中总酸的测定》中的酸碱滴定法;亚硝酸盐含量的测定:参照GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》中的盐酸萘乙二胺法;OD600 nm值的测定:采用紫外分光光度计测定在波长600 nm处的吸光度值。所有实验重复测定3次取平均值。
1.3.3 16S rRNA高通量测序技术
高通量测序技术(high-throughput sequencing)也称“下一代”测序技术(“next-generation” sequencing technology,NGS),能够一次性完成海量DNA分子的测序任务。如今,基于高通量测序的扩增子测序技术已在微生物多样性分析研究中普及,根据待测样品的不同又分为16S、ITS、18S扩增子测序,细菌主要是基于16S区,真菌主要基于18S区或ITS区(内转录间隔区)[25]。
按照土壤基因组DNA提取试剂盒说明书提取样本DNA,以其为模板,采用引物对338F(5′-ACTCCTAC-GGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGG-TWTCTAAT-3′)进行PCR扩增,PCR扩增产物委托北京百迈克生物科技有限公司完成建库测序。
1.3.4 生物信息学分析
首先利用Trimmomatic软件和Cutadapt软件对初始序列进行质量过滤;然后利用Usearch软件和Uchime软件对序列进行拼接和筛选,得到最终有效数据。使用QIIME 2软件分析样本中的Alpha多样性(Alpha diversity)和Beta多样性(Beta diversity),并比较S组和Y组中菌群丰度的差异[26-29]。
2 结果与分析
2.1 酸菜样本理化指标及OD600 nm值的检测
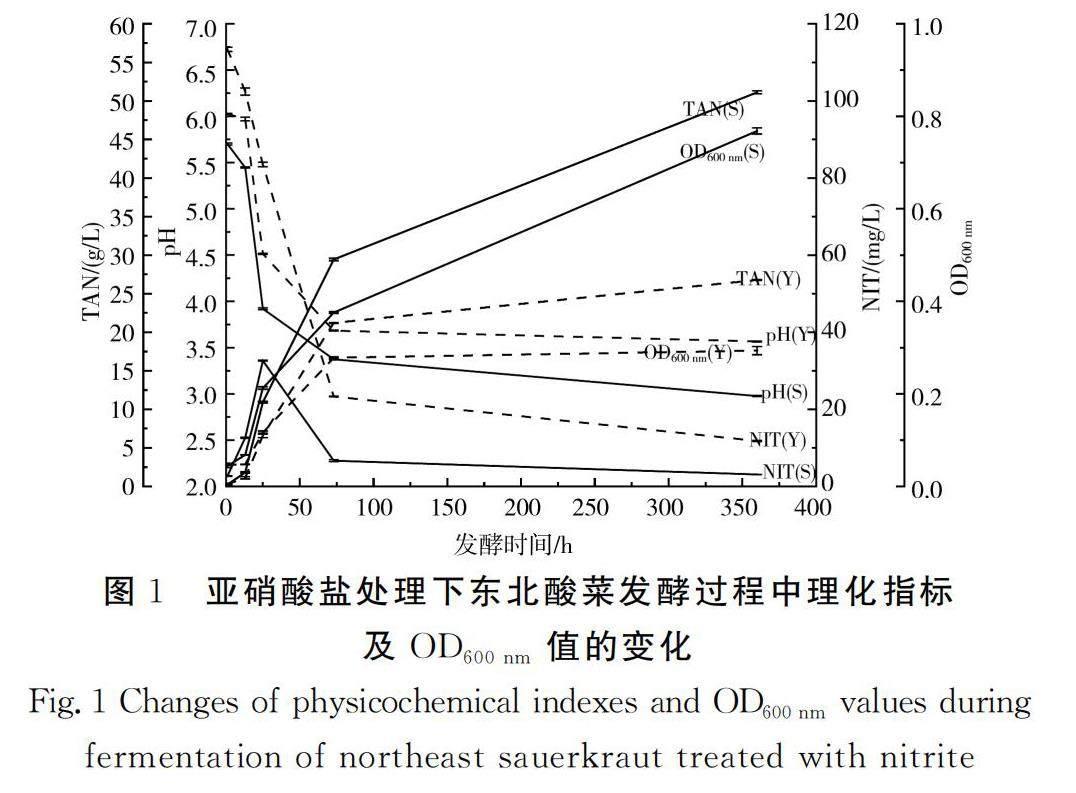
pH能反映酸菜的发酵进程,总酸(TAN)含量能体现出酸菜发酵后的酸香味,亚硝酸盐(NIT)含量反映了发酵蔬菜的安全性,OD600 nm值在一定程度上可以反映酸菜中的菌群浓度[30]。
由图1可知,添加亚硝酸盐与未添加亚硝酸盐这两种发酵条件下,pH均呈整体下降趋势,但添加亚硝酸盐组的pH整体大于未添加亚硝酸盐组。由此可知,添加亚硝酸盐会影响整个发酵过程中pH的变化,导致pH整体偏高。添加亚硝酸盐组与未添加亚硝酸盐组的TAN均呈整体上升趋势,但添加亚硝酸盐组的TAN含量整体小于未添加亚硝酸盐组,由此可知,添加亚硝酸盐会影响整个发酵过程中TAN含量的变化,导致TAN含量整体偏低,该结果与pH的变化情况相吻合。发酵时间为25 h时未添加亚硝酸盐组达到“亚硝峰”,此时添加亚硝酸盐组的NIT含量为33.50 mg/L,当发酵时间为25~73 h时,添加亚硝酸盐组的NIT含量下降趋势更剧烈。添加亚硝酸盐与未添加亚硝酸盐这两种发酵条件下OD600 nm值均呈整体上升趋势,但添加亚硝酸盐组的OD600 nm值整体小于未添加亚硝酸盐组,由此可知,添加亚硝酸盐影响了整个发酵过程中的菌群浓度,在相同时间点抑制了发酵系统内菌群的生长。
2.2 酸菜样本的生物信息学分析
2.2.1 酸菜样本细菌微生物高通量测序结果及质量评估
S1~S5、YS1~YS5样本细菌微生物的高通量测序结果见表1。
由表1可知,从两个酸菜样本中共获得891 634条原始序列,双端序列质控、拼接后共得到888 590条高质量序列,最终将高质量序列通过拼接、过滤和嵌合后共得到有效序列839 128条,序列平均碱基长度为423 bp,样本平均GC含量为52.70%。此外,各酸菜样本的测序质量值Q20>98%、Q30>95%,有效序列占比>91%,说明测序结果数据质量良好。
2.2.2 酸菜样本细菌菌群的Alpha多样性分析
Alpha多样性主要的衡量指标包括Chao 1指数、ACE指数、Shannon指数、Simpson指数、覆盖率[31]。Chao 1和ACE指数衡量物种的丰度,指数越大,丰度越高;Simpson指数和Shannon指数反映了物种的多样性,Simpson指数越小,Shannon指数越大,多样性越高[32]。两个酸菜样本细菌菌群的Alpha多样性指数分析结果见表2。
由表2可知,样本S1和S2的物种丰度均高于样本YS1和YS2,多样性均低于YS1和YS2,样本S3、S5的物种丰度和多样性均高于样本YS3,样本S4的物种丰度低于YS4、多样性高于YS4。两个样本的覆盖率均≥0.999 4,表示测序覆盖率达到了99%,样本中物种几乎全部被检测出来。根据10个样本的理化指标进行推断:第一,在未添加亚硝酸盐的样本中,S2达到了整个发酵周期菌群多样性峰值,此时酸菜中细菌丰度最大;随着发酵进程的推进,S4中细菌的多样性和丰度值逐渐减少至平稳。第二,在添加亚硝酸盐的样本中,随着发酵进程的推进,YS5达到了整个发酵周期菌群多样性峰值,此时酸菜中细菌丰度最大。由此可知,在S组中S2的物种丰度最高,S1的物种多样性最高;在Y组中YS5的物种丰度最高,YS1的物种多样性最高。发现无论是否添加亚硝酸盐,在发酵1 h即发酵初始时的物种多样性均最高。S组内S1~S3的物种丰度大于Y组内YS1~YS3,分析原因为添加亚硝酸盐抑制了发酵过程中多种细菌菌群的生长繁殖。
2.2.3 酸菜样本细菌菌群的Beta多样性分析
本研究采用主坐标分析(principal coordinates analysis,PCoA)和非度量多维尺度分析(non-metric multidimensional scaling,NMDS)对S组和Y组间细菌菌群结构的差异进行分析。PCoA将标记出的特征值和向量统一排序,在降维的思想中选择排列在前几名的主要特征值,基于加权UniFrac距离和未加权UniFrac距离的计算结果找到距离矩阵中最主要的坐标,以观察两组间的差异[33]。NMDS分析是一种非线性模型,其基本特征是将样本间的相似或相异性数值看作一种以点之间距离来表示的单调函数,在保持初始数据排序关系的前提下,用相同排序的新数值代替初始数据来完成度量多维尺度分析,从而分辨样本间的差异性[34]。在两种分析方法中,样本在坐标图上距离越近,表明相似性越高,样本的聚集程度越高,细菌菌群结构越相似;样本离散程度越大,细菌菌群结构差异越大。
由图2可知,第一主成分PC1和第二主成分PC2的贡献率分别为39.67%和20.21%,表明PCoA可以高度解释原始测序信息的差异。S组内仅S1分布于PC1的负坐标区域,组内其他样本均分布于PC1的正坐标区域,而Y组内5个样本均分布于PC1的负坐标区域。说明发酵1 h时细菌菌群结构与其他样本的差异最大,分析原因为发酵环境内原料、水携带的菌群导致此时菌群结构复杂多样。
由图3可知,Y组整体的离散程度大于S组。在S1与YS1、S2与YS2、S3与YS3、S4与YS4、S5与YS5 5组样本的间距中,发现S1与YS1的间距最近,说明随着发酵时间的延长,添加亚硝酸盐对发酵体系内菌群结构的影响越来越显著。
2.3 东北酸菜发酵系统中细菌菌群与亚硝酸盐长消变化关系
2.3.1 发酵系统中优势乳酸菌菌属与亚硝酸盐长消变化关系
由图4可知,随着发酵进程的推进,发酵体系内的优势乳酸菌菌属的相对丰度不断升高,发酵过程中乳酸菌不断产生亚硝酸盐还原酶和H+,导致TAN含量不断升高,pH不断降低,使亚硝酸盐不断降解至安全值;乳酸菌在发酵过程中逐渐占据主导地位,在发酵中后期成为发酵体系内的优势菌群,导致OD600 nm值迅速升高[35]。在发酵时间点2以后,Y组中优势乳酸菌的相对丰度远远高于S组,说明添加的亚硝酸盐影响了Y组中优势乳酸菌的生长,使其相对丰度不断增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,S组与Y组中优势乳酸菌的相对丰度有所降低但都出现回升现象。由此可知,亚硝酸盐对优势乳酸菌的生长具有明显影响,使其在发酵中后期相对丰度增加。
由图5可知,在发酵时间点2以后,Y组中Lactococcus、Leuconostoc的相对丰度远远高于S组,说明添加的亚硝酸盐影响了Y组中Lactococcus、Leuconostoc的生长,使其相对丰度不断增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,S组与Y组中Lactococcus的相对丰度开始降低,而Y组中Leuconostoc的相对丰度有所降低但又出现回升现象,S组中Leuconostoc的相对丰度产生波动后降低。在发酵过程中,Y组中Lactobacillus的相对丰度始终低于S组,说明添加的亚硝酸盐影响了Y组中Lactobacillus的生长,使其相对丰度始终处于低水平状态;在S组中,发酵系统内不断生成的亚硝酸盐影响了Lactobacillus的生长,使其相对丰度先升高后降低,同时Lactobacillus迎来了第一个低峰值;当到达发酵时间点4时,由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,Lactobacillus的相对丰度不断增加,并将迎来第二个更高的峰值。结果表明,亚硝酸盐对Lactococcus、Leuconostoc和Lactobacillus的生长具有明显影响,使Lactococcus、Leuconostoc在发酵中后期相对丰度增加;使Lactobacillus的相对丰度始终处于低水平状态。
2.3.2 发酵系统中α-变形菌菌属与亚硝酸盐长消变化关系
由图6可知,在发酵时间点1~3之间,Y组中α-变形菌的相对丰度明显高于S组,说明添加的亚硝酸盐影响了Y组中α-变形菌的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,α-变形菌的相对丰度不断降低,并处于低水平状态。由此可知,亚硝酸盐对α-变形菌的生长具有明显影响,使其在发酵初期相对丰度升高,在发酵中后期相对丰度不断降低。
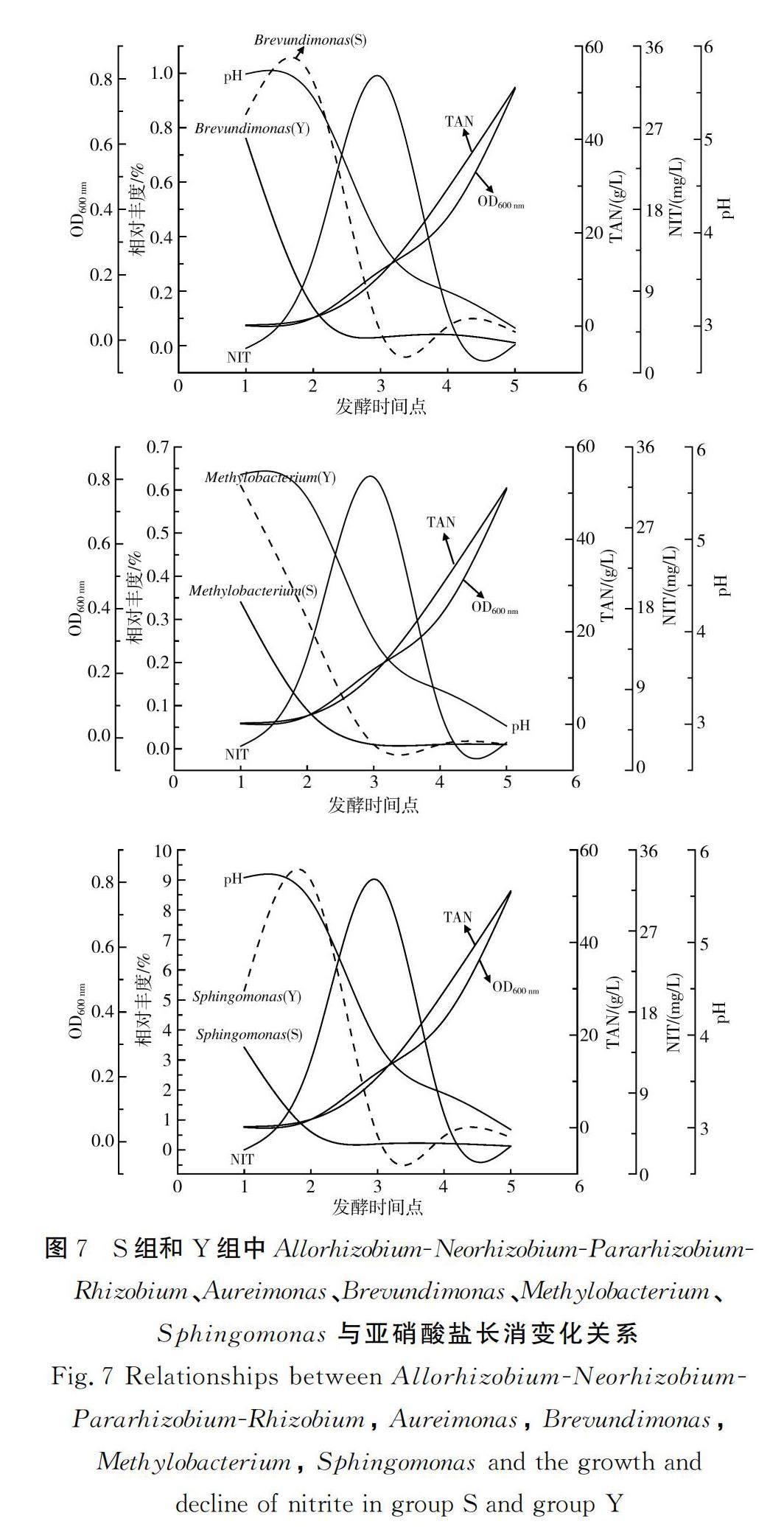
由图7可知,在发酵时间点1~3之间,Y组中Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、Aureimonas、Brevundimonas、Methylobacterium、Sphingomonas的相对丰度明显高于S组,说明添加的亚硝酸盐影响了Y组中Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、Aureimonas、Brevundimonas、Methylobacterium、Sphingomonas的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、Aureimonas、
Brevundimonas、Methylobacterium、Sphingomonas的相对丰度不断降低,并处于低水平状态。由此可知,亚硝酸盐对Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、
Aureimonas、Brevundimonas、Methylobacterium、Sphingomonas
的生长具有明显影响,使其在发酵初期相对丰度增加。
2.3.3 发酵系统中β-变形菌菌属与亚硝酸盐长消变化关系
由图8可知,在发酵时间点1~3之间,Y组中β-变形菌的相对丰度明显高于S组,说明添加的亚硝酸盐影响了β-变形菌的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,β-变形菌的相对丰度不断降低,并处于低水平状态。由此可知,亚硝酸盐对β-变形菌的生长具有明显影响,使其在发酵初期相对丰度增加。
由图9可知,在发酵时间点1~3之间,Y组中Acidovorax、Aquabacterium、Delftia、Herbaspirillum、Methylophilus、Methylovorus的相对丰度明显高于S组,说明添加的亚硝酸盐影响了Y组中Acidovorax、Aquabacterium、Delftia、Herbaspirillum、Methylophilus、Methylovorus的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,Acidovorax、Aquabacterium、Delftia、Herbaspirillum、Methylophilus、Methylovorus的相对丰度不断降低,并处于低水平状态。随着发酵进程的推进,S组与Y组中Comamonas的相对丰度呈现基本相同的变化趋势,但除发酵时间点3~4之间,Y组中Comamonas的相对丰度明显高于S组,说明添加的亚硝酸盐影响了Y组中Comamonas的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,Comamonas的相对丰度不断降低,虽有所回升但仍处于低水平状态。由此可知,亚硝酸盐对Acidovorax、Aquabacterium、Delftia、Herbaspirillum、Methylophilus、Methylovorus、Comamonas的生长具有明显影响,使其在发酵初期相对丰度增加。
2.3.4 发酵系统中CFB类菌属与亚硝酸盐长消变化关系
由图10可知,在发酵时间点1~3之间,Y组中CFB类菌属的相对丰度明显高于S组,说明添加的亚硝酸盐影响了Y组中CFB类菌属的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,CFB类菌属的相对丰度不断降低,并处于低水平状态。由此可知,亚硝酸盐对CFB类菌属的生长具有明显影响,使其在发酵初期相对丰度增加。
由图11可知,在发酵时间点1~3之间,Y组中Dyadobacter、Pedobacter、Sphingobacterium的相对丰度明显高于S组,说明添加的亚硝酸盐影响了Y组中Dyadobacter、Pedobacter、Sphingobacterium的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,Dyadobacter、Pedobacter、Sphingobacterium的相对丰度不断降低,并处于低水平状态。由此可知,亚硝酸盐对Dyadobacter、Pedobacter、Sphingobacterium的生长具有明显影响,使其在发酵初期相对丰度增加。
2.3.5 发酵系统中未培养菌属与亚硝酸盐长消变化关系
由图12可知,随着发酵进程的推进,S组与Y组中未培养菌属的相对丰度都呈现下降趋势,在发酵时间点1~3之间,Y组中未培养菌属的相对丰度明显高于S组,说明添加的亚硝酸盐影响了Y组中未培养菌属的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,未培养菌属的相对丰度不断降低,并处于低水平状态。由此可知,亚硝酸盐对未培养菌属的生长具有明显影响,使其在发酵初期相对丰度增加。
由图13可知,在发酵时间点1~3之间,Y组中Brassica_napus_rape、uncultured_bacterium_f_Chitinophagaceae、uncultured_bacterium_f_env.OPS_17、uncultured_bacterium_o_Chloroplast的相对丰度明显高于S组,说明添加的亚硝酸盐影响了Y组中Brassica_napus_rape、uncultured_bacterium_f_Chitinophagaceae、uncultured_bacterium_f_env.OPS_17、uncultured_bacterium_o_Chloroplast的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,Brassica_napus_rape、uncultured_bacterium_f_Chitinophagaceae、uncultured_bacterium_f_env.OPS_17、uncultured_bacterium_o_Chloroplast的相对丰度不断降低,并处于低水平状态。由此可得,亚硝酸盐对Brassica_napus_rape、uncultured_bacterium_f_Chitinophagaceae、uncultured_bacterium_f_env.OPS_17、uncultured_bacterium_o_Chloroplast的生长具有明显影响,使其在发酵初期相对丰度增加。
2.3.6 发酵系统中致病菌菌属与亚硝酸盐长消变化关系
由图14可知,除发酵初始外,Y组中致病菌的相对丰度始终低于S组,说明添加的亚硝酸盐影响了Y组中致病菌的生长,使其相对丰度始终处于低水平状态。在S组中,发酵系统内不断生成的亚硝酸盐影响了致病菌的生长,使其相对丰度先升高后降低,同时致病菌迎来了第一个低峰值;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,S组中致病菌的相对丰度仍不断降低。这意味着无论是Y组还是S组,在发酵后期致病菌菌属的相对丰度都处于低水平状态,此时东北酸菜不会对人体健康构成危害,为可食用状态。由此可知,亚硝酸盐对致病菌的生长具有明显影响,使其相对丰度始终处于低水平状态。
由图15可知,在发酵时间点1~2之间,Y组中Alkanindiges的相对丰度明显高于S组,在发酵时间点1~3之间,Y组中uncultured_bacterium_f_Burkholderiaceae的相对丰度高于S组,说明添加的亚硝酸盐影响了Y组中Alkanindiges、uncultured_bacterium_f_Burkholderiaceae的生长,使其相对丰度增加;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,Y组中Alkanindiges、uncultured_bacterium_f_Burkholderiaceae的相对丰度一直处于低水平状态。Y组中Acinetobacter、Chryseobacterium的相对丰度始终处于低水平状态,且在发酵时间点1~3之间Acinetobacter、Chryseobacterium的相对丰度远远低于S组,说明添加的亚硝酸盐影响了Y组中Acinetobacter、Chryseobacterium的生长,使其相对丰度始终处于低水平状态;在S组中,发酵系统内不断生成的亚硝酸盐影响了S组中Acinetobacter、Chryseobacterium的生长,使其相对丰度先升高后降低;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,导致乳酸菌大量积累,S组中Acinetobacter、Chryseobacterium的相对丰度仍处于低水平状态。在整个发酵过程中,Y组中Enterococcus、Serratia、uncultured_bacterium_f_Enterobacteriaceae的相对丰度处于低水平状态且明显低于S组,说明添加的亚硝酸盐显著影响了Y组中Enterococcus、Serratia、uncultured_bacterium_f_Enterobacteriaceae的生长,使其相对丰度始终处于低水平状态;由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,导致乳酸菌大量积累,Enterococcus的相对丰度仍处于低水平状态;在发酵时间点1~2之间,分析S组中的Serratia由于具有硝酸盐还原酶,而促进了亚硝酸盐的生成;在发酵时间点2~3之间,该阶段表现为亚硝酸盐影响了Serratia的生长,使其相对丰度降低,由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,乳酸菌大量积累,Serratia的相对丰度有所回升,但其相对丰度始终处于处于低水平状态;uncultured_bacterium_f_Enterobacteriaceae是肠杆菌科中具有硝酸盐还原酶的一种细菌,可将发酵体系中存在的硝酸盐还原成亚硝酸盐,在S组发酵前期,发酵体系内含氧量较高,uncultured_bacterium_f_Enterobacteriaceae不断消耗发酵系统中的氧气并随之不断增长,同时将原料所携带的硝酸盐不断地转化成亚硝酸盐,导致发酵体系内亚硝酸盐含量不断升高,随着发酵系统中乳酸菌大量积累、pH不断降低、TAN不断升高,发酵体系内呈现出缺氧的酸性环境,以Lactobacillus为代表的乳酸菌在发酵体系中逐渐占据主导地位,使得uncultured_bacterium_f_Enterobacteriaceae的相对丰度在发酵后期不断下降,并处于低水平状态。在发酵时间点1~2之间,Y组uncultured_bacterium_f_Xanthobacteraceae的相对丰度明显低于S组,说明添加的亚硝酸盐显著影响了Y组中uncultured_bacterium_f_Xanthobacteraceae的生长,使其相对丰度降低;在发酵时间点2~3之间,发酵过程中不断生成亚硝酸盐,从而使uncultured_bacterium_f_Xanthobacteraceae的相对丰度继续降低,同时其迎来了第一个低峰值,由于发酵系统内亚硝酸盐不断降解,TAN含量不断升高,pH不断降低,uncultured_bacterium_f_Xanthobacteraceae的相对丰度有所回升,但仍处于低水平状态。由此可知,亚硝酸盐对Alkanindiges、uncultured_bacterium_f_Burkholderiaceae、Acinetobacter、Chryseobacterium、Enterococcus、Serratia、uncultured_bacterium_f_Enterobacteriaceae、uncultured_bacterium_f_Xanthobacteraceae的生长具有明显影响,使Alkanindiges、uncultured_bacterium_f_Burkholderiaceae在发酵初期相对丰度增加;使Acinetobacter、Chryseobacterium、Enterococcus、Serratia、uncultured_bacterium_f_Enterobacteriaceae的相对丰度始终处于低水平状态;使uncultured_bacterium_f_Xanthobacteraceae在发酵前期相对丰度降低。
3 讨论
图1展示了添加亚硝酸盐组(Y组)与未添加亚硝酸盐组(S组)中pH、TAN、NIT和OD600 nm值的变化情况,发现Y组的pH始终大于S组,Y组的NIT含量始终小于S组,该现象与张庆芳等[36]在亚硝酸盐对Lactobacillus brevis 4903发酵中亚硝酸菌对乳酸菌的发酵有抑制作用的研究结果一致。Y组发酵体系内产酸量较低,推测原因可能是乳酸菌产生亚硝酸还原酶将亚硝酸盐还原成氨气,氨气与乳酸菌所产的乳酸反应,导致发酵环境中pH偏高,TAN含量偏低,有利于发酵早期乳球菌属的生长与积累。
Alpha多样性结果表明,添加亚硝酸盐对各样本中共有的菌属的相对丰度有显著影响。Beta多样性结果表明,发酵时间点1时,S组内S1的菌群结构与组内其他样本的差异最大,随着发酵时间的延长,添加亚硝酸盐对发酵体系内菌群结构的影响越来越显著。
本文研究表明S组和Y组中共含有Enterococcus、Lactococcus、Leuconostoc和Lactobacillus 4种乳酸菌菌属,其中Lactococcus、Leuconostoc和Lactobacillus为S组中的优势乳酸菌菌属。与S组相比,Y组中Lactococcus与Leuconostoc的相对丰度分别增加了18.55%和8.05%,而Lactobacillus的相对丰度减少了14.79%,说明添加亚硝酸盐使Lactococcus与Leuconostoc的相对丰度升高,但使Lactobacillus的相对丰度降低;随着发酵进程的推进,亚硝酸盐被大量降解,亚硝酸盐对Lactobacillus的发酵影响开始解除。发酵前期为亚硝酸盐积累阶段,发酵时间点2时亚硝酸盐含量达到12.62 mg/L,此时Lactococcus、Leuconostoc为S组中的优势乳酸菌菌属,而当发酵25 h时达到亚硝峰(32.63 mg/L)后,Lactobacillus成为S组中的绝对优势乳酸菌菌属;Lactococcus和Leuconostoc为Y组中的优势乳酸菌菌属,且亚硝酸盐使Leuconostoc和Lactococcus的相对丰度升高,使Lactobacillus的相对丰度降低,此结果与Huang等[37]的研究结果相同。在发酵73 h时,Y组中亚硝酸盐含量达到23.33 mg/L,为S组中亚硝酸盐含量(6.66 mg/L)的3.5倍;在发酵15 d时,Y组中亚硝酸盐含量达到11.80 mg/L,为S组亚硝酸盐含量(3.09 mg/L)的3.8倍,由此可知,在发酵73 h后Y组中亚硝酸盐对Lactobacillus的生长仍具有影响,而S组中亚硝酸盐基本不影响Lactobacillus的生长。乳酸菌具有抗菌、抗氧化、免疫、调节人体脂代谢、治疗高血压等功效[38]。Chryseobacterium、Enterococcus、Serratia和uncultured_bacterium_f_Enterobacteriaceae是东北酸菜中比较有代表性的致病菌菌属,观察S组和Y组中几种致病菌菌属的变化情况,发现YS2中Chryseobacterium的相对丰度(15.94%)比S2(32.93%)低16.99%,YS2中Enterococcus的相对丰度(0.22%)比S2(0.47%)低0.25%,YS2中uncultured_bacterium_f_Enterobacteriaceae的相对丰度(0.35%)比S2(28.31%)低27.96%,YS2中Serratia的相对丰度(0.01%)比S2(0.28%)低0.27%,其中Serratia在YS3、YS4、YS5中相对丰度均为0,说明亚硝酸盐对Serratia的生长影响最显著,使其相对丰度始终处于极低水平状态。以上均证明亚硝酸盐可防止发酵过程中出现过多杂菌引起腐败现象,保证了发酵的顺利进行。此外,本研究发现无论是否人为添加亚硝酸盐,东北酸菜中亚硝酸盐的残留量均会随着时间的延长降至远低于国标值,因此在科学的生产工艺下,东北酸菜不会对人体健康产生危害。
东北酸菜的原料大白菜中含有一定量的硝酸盐,在东北酸菜的发酵过程中,发酵前期存在多种具有硝酸还原酶的细菌,白菜自身所携带的硝酸盐会被发酵体系内的杂菌还原成亚硝酸盐,亚硝酸盐最终又会被乳酸菌逐渐降解至安全值[39]。由此可知,食用科学工艺所生产的东北酸菜具有一定的安全性。由本研究中的两个发酵系统中各菌属相对丰度变化情况可知,在东北酸菜的整个发酵周期中,发酵前期pH较高,发酵系统内Lactococcus大量增长,其产生的亚硝酸盐还原酶使发酵体系内的亚硝酸盐大量降解;发酵后期Lactobacillus大量增长,其产生大量的乳酸导致发酵系统内pH始终处于较低水平状态,此时发酵体系内的H+发挥作用导致亚硝酸盐不断降解。以上结果与张庆芳等[35]、王一茜等[40]的研究结果相符合。
4 结论
以25 ℃生渍法发酵的东北酸菜发酵液为研究对象,在添加亚硝酸盐与未添加亚硝酸盐这两组中选取的10个样本进行高通量测序,得到以下结论:10个样本共注释得到13个门的142个属,Y组中YS4的物种丰度大于S4,S组中S1的物种多样性大于YS1。通过研究添加亚硝酸盐组与未添加亚硝酸盐组这两种发酵条件下各理化指标和微生物指标变化情况,由pH、TAN含量、NIT含量和OD600 nm值的变化可知,添加亚硝酸盐会对酸菜整个发酵体系内的菌群结构产生一定的影响。综上所述,无论是否添加亚硝酸盐,两个发酵体系中酸菜样本的细菌总数均呈现先上升后下降的趋势。发酵开始后,添加亚硝酸盐对整个发酵周期中细菌的生长都具有影响,亚硝酸盐使优势乳酸菌菌属(Lactococcus、Leuconostoc、Lactobacillus)、α-变形菌菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、Aureimonas、Brevundimonas、Methylobacterium、Sphingomonas)、β-变形菌菌属(Acidovorax、Aquabacterium、Comamonas、Delftia、Herbaspirillum、Methylophilus、Methylovorus)、CFB类菌属(Dyadobacter、Pedobacter、Sphingobacterium)和未培养菌属(Brassica_napus_rape、uncultured_bacterium_f_Chitinophagaceae、uncultured_bacterium_f_env.OPS_17、uncultured_bacterium_o_Chloroplast)在发酵初期相对丰度增加;使致病菌菌属(Acinetobacter、Alkanindiges、Chryseobacterium、Enterococcus、Serratia、uncultured_bacterium_f_Burkholderiaceae、uncultured_bacterium_f_Enterobacteriaceae、uncultured_bacterium_f_Xanthobacteraceae)的相对丰度始终处于低水平状态。东北酸菜发酵过程中乳酸菌逐渐占据主导地位,在发酵中后期成为发酵体系内的优势菌群;在S系统内,发酵前期为亚硝酸盐积累阶段,此时Lactococcus、Leuconostoc为优势乳酸菌菌属,而达到发酵中后期时Lactobacillus成为绝对优势乳酸菌菌属;在发酵初期,Acinetobacter、Enterococcus、Serratia、uncultured_bacterium_f_Enterobacteriaceae等致病菌大量繁殖,导致亚硝酸盐大量积累,而积累的亚硝酸盐使Acinetobacter、Enterococcus、Serratia、uncultured_bacterium_f_Enterobacteriaceae等致病菌的相对丰度始终处于低水平状态,其中对Serratia的生长影响最显著。
5 展望
发酵蔬菜因其独特的风味深受人们喜爱,但其中的亚硝酸盐含量一直是食品安全问题的热点。本文对东北酸菜发酵过程中相对丰度排名前30的菌属与亚硝酸盐长消变化关系进行了研究,为后期调控东北酸菜发酵环境中菌群结构、提高东北酸菜发酵品质奠定了基础,为含有亚硝酸盐的不同发酵蔬菜的开发与研究提供了新的理论依据和方向。
参考文献:
[1]FONSECA S, RIVAS I, ROMAGUERA D, et al. Association between consumption of fermented vegetables and COVID-19 mortality at a country level in Europe[J].MedRxiv,2020(7):
20147025.
[2]肖珍,谢笔钧,孙智达.莲房原花青素对紫甘蓝泡菜亚硝酸盐的抑制作用[J].食品工业科技,2018,39(11):67-73.
[3]燕平梅,王炫月,赵文婧.泡菜中亚硝酸盐形成、还原相关微生物的研究[J].中国调味品,2020,45(9):77-80.
[4]WU R N, YU M L, LIU X Y, et al. Changes in flavour and microbial diversity during natural fermentation of suan-cai, a traditional food made in Northeast China[J].International Journal of Food Microbiology,2015,211:23-31.
[5]YANG X Z, HU W Z, XIU Z L, et al. Microbial dynamics and volatilome profiles during the fermentation of Chinese northeast sauerkraut by Leuconostoc mesenteroides ORC2 and Lactobacillus plantarum HBUAS51041 under different salt concentrations[J].Food Research International,2020,130:108926.
[6]刘长根.我国传统发酵蔬菜微生物多样性比较[D].南昌:南昌大学,2019.
[7]YANG Y L, FAN Y, LI T, et al. Microbial composition and correlation between microbiota and quality-related physiochemical characteristics in Chongqing radish paocai[J].Food Chemistry,2022,369:130897.
[8]CHEN G M, HUANG Z R, WU L, et al. Microbial diversity and flavor of Chinese rice wine (Huangjiu): an overview of current research and future prospects[J].Current Opinion in Food Science,2021,77:37-43.
[9]GOU M, WANG H, YUAN H, et al. Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].Journal of the Institute of Brewing,2015,121(4):620-627.
[10]HUANG Z R, HONG J L, XU J X, et al. Exploring core functional microbiota responsible for the production of volatile flavour during the traditional brewing of Wuyi Hong Qu glutinous rice wine[J].Food Microbiology,2018,76:487-496.
[11]LIU Z B, WANG Z Y, SUN J Y, et al. The dynamics of volatile compounds and their correlation with the microbial succession during the traditional solid-state fermentation of Gutian Hong Qu glutinous rice wine[J].Food Microbiology,2020,86:103347.
[12]REN Q, SUN L, WU H, et al. The changes of microbial community and flavor compound in the fermentation process of Chinese rice wine using Fagopyrum tataricum grain as feedstock[J].Scientific Reports,2019,9(1):3365.
[13]SHEN X, YAN X, XU J. Fatty acid profiles in muscle of large yellow croakers (Larimichthys crocea) can be used to distinguish between the samples of Dai-qu stock and Min-yuedong stock[J].Biochemical Systematics and Ecology,2018,77:37-43.
[14]YUN J H, KIM J H, LEE J E. Surface film formation in static-fermented rice vinegar: a case study[J].Mycobiology,2019,47(2):250-255.
[15]SHAN L, LI Y, ZHENG S, et al.Analysis of the bacterial floral structure and diversity of Xuanwei ham by 16S rDNA sequencing[J].Journal of Food Safety,2020,40(4):12800.
[16]LIN L J, ZENG J, TIAN Q M, et al.Effect of the bacterial community on the volatile flavour profile of a Chinese fermented condiment—red sour soup during fermentation[J].Food Research International,2022,155:111059.
[17]XIANG W, ZHANG N, LU Y, et al. Effect of Weissella cibaria co-inoculation on the quality of Sichuan pickle fermented by Lactobacillus plantarum[J].LWT-Food Science and Technology,2020,121:108975.
[18]LIANG H, CHEN H, JI C, et al. Dynamic and functional characteristics of predominant species in industrial Paocai as revealed by combined DGGE and metagenomic sequencing[J].Frontiers in Microbiology,2018,9:2416.
[19]PENG Q, JIANG S, CHEN J, et al. Unique microbial diversity and metabolic pathway features of fermented vegetables from Hainan, China[J].Frontiers in Microbiology,2018,9:399.
[20]GUO M Y, HOU C J, BIAN M H, et al. Characterization of microbial community profiles associated with quality of Chinese strong-aromatic liquor through metagenomics[J].Journal of Applied Microbiology,2019,127(3):750-762.
[21]周姝静,孙全敏,迟乃玉,等.东北酸菜发酵前后期细菌菌群多样性分析[J].中国酿造,2022,41(5):42-46.
[22]迟雪梅,王一茜,乔慧,等.发酵蔬菜硝酸盐、亚硝酸盐消长变化及其相关性的研究[J].食品与发酵工业,2018,44(1):25-30.
[23]丛敏.酸菜自然发酵过程中化学成分及乳酸菌变化规律的研究[D].沈阳:沈阳农业大学,2016.
[24]李欣蔚.东北地区自然发酵酸菜中乳酸菌时空分布规律的研究[D].沈阳:沈阳农业大学,2017.
[25]FILIPPIS F D, PARENTE E, ZOTTA T, et al. A comparison of bioinformatic approaches for 16S rRNA gene profiling of food bacterial microbiota[J].International Journal of Food Microbiology,2018,265:9-17.
[26]PARKS D H, TYSON G W, HUGENHOLTZ P, et al. STAMP: statistical analysis of taxonomic and functional profiles[J].Bioinformatics,2014,30(21):3123-3124.
[27]SUL W J, COLE J R, JESUS E D, et al. Bacterial community comparisons by taxonomy-supervised analysis independent of sequence alignment and clustering[J].Proceedings of the National Academy of Sciences,2011,108(35):14637-14642.
[28]陈浩,何国庆.乳酸菌对发酵豆豉品质的影响[J].食品安全质量检测学报,2017,8(12):4516-4523.
[29]张庆芳,杨超,于爽,等.黄海海域海洋沉积物细菌多样性分析[J].微生物学通报,2020,47(2):370-378.
[30]高凤.东北酸菜发酵过程亚硝酸盐微生物酶降解机制及应用[D].镇江:江苏大学,2019.
[31]王琪琪,田界先,潘宗东,等.基于Illumina MiSeq分析贵州凯里酸汤独特风味的优势菌群[J].食品与发酵工业,2020,46(14):40-47.
[32]周艺萍,熊智,李选文,等.盐分对新平酸腌菜主发酵期细菌多样性的影响[J].中国酿造,2021,40(4):26-32.
[33]孙炜宁.基于高通量测序的泸酒酒醅和酸菜中细菌区系的研究[D].天津:天津大学,2017.
[34]RIVAS M N, BURTON O T, WISE P, et al. A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis[J].Journal of Allergy and Clinical Immunology,2013,131(1):201-212.
[35]张庆芳,迟乃玉,郑燕,等.乳酸菌降解亚硝酸盐机理的研究[J].食品与发酵工业,2002(8):27-31.
[36]张庆芳,迟乃玉,薛景珍,等.亚硝酸盐影响Lactobacillus brevis 4903发酵的研究[J].微生物学杂志,2005(3):25-27.
[37]HUANG Y, LIU D, JIA X, et al. Whole genome sequencing of Lactobacillus plantarum DMDL 9010 and its effect on growth phenotype under nitrite stress[J].LWT-Food Science and Technology,2021,149:111778.
[38]孙钰薇,张诗瑶,刘志佳,等.发酵食品中乳酸菌的健康功效研究进展[J].食品与发酵工业,2021,47(23):280-287.
[39]迟雪梅,张庆芳.食品中常见乳酸菌高效降解NO2-发酵性能评价[J].食品与发酵工业,2017,43(6):78-84.
[40]王一茜,荣金诚,王晓辉,等.常见乳酸菌降解亚硝酸盐机理探讨[J].食品与发酵工业,2019,45(8):50-56.
