基于聚A单链DNA模板合成金纳米簇快速检测化妆品中的氯霉素*
2024-05-30曾希珂杨丽霞黄小贝
曾希珂,易 姿,杨丽霞,黄小贝,2,赵 佳
(1 长沙市食品药品检验所,湖南 长沙 410036;2 国家酒类产品质量检验检测中心,湖南 长沙 410036)
氯霉素(CAP)是一种广谱抗生素,具有杀菌消炎的作用,使用后能明显改善皮肤状态[1]。然而,长期使用添加氯霉素的化妆品会产生严重的副作用,可能引起皮疹、过敏等不良反应,表现为红斑、水肿、糜烂、灼热、脱屑等,还会诱发再生障碍性贫血、骨髓抑制[2-5]等疾病,对人体健康构成严重危害。因此,我国《化妆品安全技术规范》[6]规定氯霉素为化妆品禁用组分。目前,检测化妆品中氯霉素的常用方法有高效液相色谱法[7-8]、液相色谱-质谱联用法[9-10]、酶联免疫法[11]等,这些方法可以实现对氯霉素高灵敏度检测,但大都依赖大型精密贵重仪器,样品前处理复杂,基质干扰较强,分析时间长,不利于快速筛查。因此,寻找一种简单快速且可靠的方法检测氯霉素具有重要意义。
贵金属纳米簇由于其发光效率高、合成简便、低毒性及生物相容性好等优点,为生物传感领域提供了一种新型高效的分析方法[12]。其中,金纳米簇光学稳定性好、发光性能优良,具有广泛的应用前景。Wang等[13]以聚A(腺嘌呤)为模板的单链DNA可以简单快速的合成金纳米簇,且发光性能良好。欧丽娟等[14]利用聚A单链DNA为模板合成金纳米簇,建立了一种检测汞离子的荧光方法,该方法简单快速,灵敏度高,选择性好。
基于此,本文利用聚A单链DNA为模板合成的金纳米簇作为荧光探针,构建一种新的荧光生物传感方法用于检测化妆品中的氯霉素,以期为化妆品中氯霉素的快捷检测提供参考。
1 实 验
1.1 试剂与仪器
A30-DNA单链、氯金酸(HAuCl4)、10×PBS缓冲液:生工生物工程(上海)股份有限公司;
青霉素、头孢氨苄、链霉素、卡那霉素、盐酸林可霉素:USP级,生工生物工程(上海)股份有限公司;
五水合硫酸铜、柠檬酸三钠、甘氨酸、精氨酸、葡萄糖、麦芽糖、蔗糖、氯化钙、氯化镁等:分析纯,国药集团化学试剂有限公司;
试验用水:超纯水(电阻率>18.2 MΩ·cm),超纯水系统SMARTPLUS-N;
LS-55型荧光分光光度计,珀金埃尔默股份有限公司;
ME204电子天平,瑞士Mettler Toledo公司。
1.2 金纳米簇的合成
取10 μmol/L A30-DNA模板40 μL,1 mmol/L氯金酸溶液60 μL,50 mmol/L柠檬酸钠溶液100 μL混合后,加入800 μL超纯水,最终反应总体积为1 mL。将混合液置于90 ℃水浴锅里反应30 min后迅速放入4 ℃冰箱里避光保存,得到荧光金纳米簇溶液。
1.3 检测条件的优化
由于反应温度、加入氯霉素的反应时间、缓冲液pH值是影响氯霉素检测的重要参数,采用单一变量原则,对3个参数进行了优化。
1.3.1 反应温度的优化
取AuNCs溶液80 μL,3 mmol/L氯霉素溶液10 μL,10×PBS缓冲液10 μL混合均匀成100 μL体系,考察反应温度(5,15,25,35,45,55 ℃)对体系荧光强度的影响。
1.3.2 反应时间的优化
取AuNCs溶液80 μL,3 mmol/L氯霉素溶液10 μL,10×PBS缓冲液10 μL混合均匀成100 μL体系,考察加入氯霉素反应时间(0,1,2,3,4,5,6,7,8 min)对体系荧光强度的影响。
1.3.3 缓冲液pH值的优化
取AuNCs溶液80 μL,3 mmol/L氯霉素溶液10 μL,10×PBS缓冲液10 μL混合均匀成100 μL体系,考察缓冲液pH值(5,5.5,6,6.5,7,7.5,8)对体系荧光强度的影响。
1.4 氯霉素的检测
按照1.2的方法合成荧光金纳米颗粒,再按照1.3最优条件对终浓度为0,0.01,0.1,10.0,20.0,30.0,40.0,50.0,60.0,80.0,100.0,150.0,200.0,300.0,400.0 μmol/L的氯霉素进行测定。使用荧光分光光度计测量荧光,激发波长290 nm,狭缝宽度10 nm,扫描范围400~560 nm,发射波长475 nm。
1.5 氯霉素检测的特异性
为了验证方法的特异性,按照1.4的试验方法对浓度为50 mmol/L的青霉素、头孢氨苄、链霉素、卡那霉素、盐酸林可霉素、甘氨酸、精氨酸等多种目标物进行测定,使用荧光分光光度计测量荧光。
1.6 样品中氯霉素的测定
化妆品样品前处理方法参照标准GB/T 24800.1-2009[15]略作修改:称取1 g化妆品样品置于50 mL离心管中,加入20 mL甲醇,超声提取20 min后于涡旋混匀仪上混匀1 min,以6 000 r/min离心5 min,吸取1 mL上清液氮吹至干,加纯水定容至10 mL,过0.22 μm滤膜后用于样品分析。采用标准加入法进行化妆品样品中氯霉素的分析。
2 结果与分析
2.1 实验原理
试验方法的检测原理如图1所示,以聚A单链DNA为模板,氯金酸为金源,柠檬酸钠为还原剂,将金离子还原成零价金后富集在聚A-DNA单链上,形成强荧光的金纳米簇稳定存在于溶液中。加入氯霉素后,氯霉素与金纳米簇结合,通过强吸电子作用阻碍电子转移进程,从而淬灭金纳米簇荧光强度,实现对氯霉素的检测[16]。
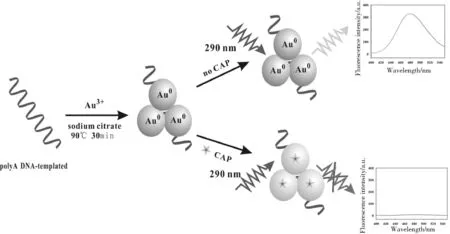
图1 基于聚A单链DNA模板金纳米簇检测氯霉素的原理图Fig.1 Schematic of CAP detection based on A30-DNA template AuNCs
2.2 检测方法的可行性
为了检验该方法用于化妆品中氯霉素检测的可行性,即判断氯霉素的加入对金纳米簇荧光强度的影响,分别测定了氯霉素存在与不存在时金纳米簇的荧光值。如图2所示,不存在氯霉素时,检测到强荧光值(a),而加入氯霉素后,荧光值显著降低(b)。由此表明该方法适用于氯霉素的检测。
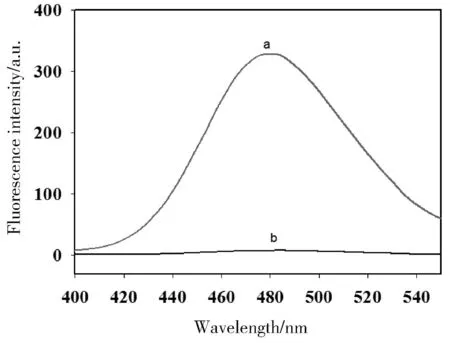
图2 不同条件下A30-DNA模板金纳米簇的荧光发射光谱图Fig.2 Fluorescence emission spectra of AuNCs under different conditions
2.3 试验条件优化
2.3.1 反应温度的优化
如图3所示,金纳米簇的荧光强度随温度的升高先下降后升高,当温度为25 ℃时,荧光强度最低。因此,选择25 ℃为最佳反应温度。

图3 温度对金纳米簇荧光强度的影响Fig.3 The effect of temperature on the fluorescence intensity of AuNCs
2.3.2 反应时间的优化
如图4所示,加入氯霉素后金纳米簇的荧光强度迅速下降,当反应时间超过5 min后荧光强度趋于平稳。因此,选择5 min为最佳反应时间。

图4 时间对金纳米簇荧光强度的影响Fig.4 The effect of time on the fluorescence intensity of AuNCs
2.3.3 缓冲液pH值的优化
如图5所示,缓冲液pH值为5.5时,加入氯霉素后,金纳米簇的荧光强度降到最低,因此,选择pH值为5.5作为后续试验的缓冲体系。

图5 pH值对金纳米簇荧光强度的影响Fig.5 The effect of pH on the fluorescence intensity of AuNCs
2.4 检测方法的性能
在优化的试验条件下,对0.01~400 μmol/L范围内的氯霉素浓度进行了检测,结果见图6。由图6(a)所示,随着氯霉素浓度的增加,金纳米簇荧光强度逐渐降低。图6(b)显示了氯霉素浓度与475 nm处的荧光强度之间的关系。在0.01~80 μmol/L的浓度范围内,金纳米簇荧光强度和氯霉素浓度之间呈良好的线性关系,线性回归方程为:y=-3.419 5CCAP+318.88,线性回归系数R2=0.996 6,根据空白响应的3倍标准偏差原则确定检测限为7.0 nmol/L。

图6 不同浓度氯霉素的荧光发射光谱图Fig.6 Fluorescence emission spectra with different concentration of CAP
2.5 检测方法的特异性
为了验证检测方法的特异性,检测了其他可能产生干扰的抗生素、氨基酸、金属离子、糖类等对金纳米簇荧光强度的影响,结果如图7所示。从图7可以明显看出,只有氯霉素能有效的淬灭金纳米簇的荧光,其他干扰物对荧光强度基本无影响,说明该方法对氯霉素的检测具有高选择性。
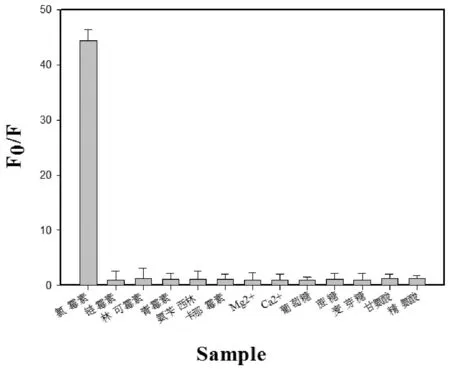
图7 传感器的特异性Fig.7 Specificity analysis of the sensor for CAP
2.6 实际样品分析
为探讨化妆品实际样品中氯霉素测定方法的可行性,对爽肤水、面膜、玻尿酸三种化妆品样品采用标准加入法评价该方法的实用性,结果见表1,爽肤水样品中,3个加标水平的平均回收率在98.22%~108.40%,相对标准偏差(RSD,n=6)为3.28%~8.82%;面膜样品中,3个加标水平的平均回收率在98.12~105.28%,相对标准偏差(RSD,n=6)为2.32%~8.57%;玻尿酸样品中,3个加标水平的平均回收率在98.55%~107.23%,相对标准偏差(RSD,n=6)为3.21%~7.57%,方法的准确度和精密度较好,可以用于样品中氯霉素的检测。
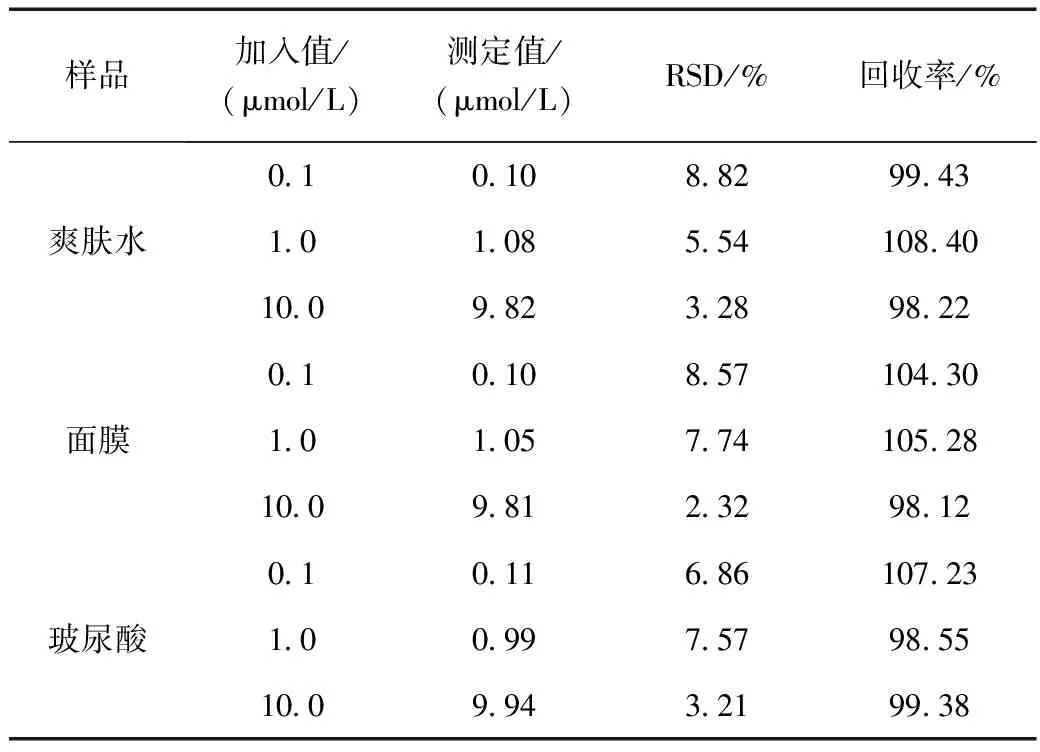
表1 实际样品中氯霉素的加标回收率Table 1 Recovery of CAP in real samples
3 结 论
本研究以A30单链DNA为模板,制备了具有强荧光的金纳米簇探针。基于氯霉素和金纳米簇之间强的结合作用可以猝灭金纳米簇的荧光,提出了以金纳米簇为荧光探针快速检测化妆品中氯霉素的方法。该方法选择性好,灵敏度高,操作简单快速,检测成本低,时间短,在化妆品实际样品中的检测具有良好的应用前景。
