Fe2O3@Co3O4核壳催化剂活化过一硫酸盐高效降解有机物
2024-05-30杜鑫洁李昕玥范璐平
杜鑫洁,陈 哲,李昕玥,范璐平
(华北电力大学,北京 102206)

在催化研究领域,双组分催化剂的协同催化效应是普遍存在的,在双组分催化剂中,某些助催化组分的引入显著提高了主催化组分的催化性能,两种催化组分互相作用,通过改变催化剂的表面形貌[8]、电子结构[9]、或优化催化剂的对反应物的吸附性能来增强其反应活性。构建核壳纳米结构是使制备双组分催化剂以增强其在给定催化反应中的性能的有效方法之一,例如:Cao等[10]成功制备了CdS@CuS核壳纳米棒,有效提高了电荷分离效率,提高了光催化析氢反应速率。
本文成功制备了高活性核壳催化剂Fe2O3@Co3O4用于活化PMS降解水体中有机污染物。在碱性环境下,Co2+生成Co(OH)2沉淀在普鲁士蓝纳米块上获得PB@ Co(OH)2前体,后通过煅烧获得Co3O4纳米粒子包覆在Fe2O3纳米块的复合型催化剂Fe2O3@Co3O4;核壳结构的催化剂Fe2O3@Co3O4具有相较于Co3O4、Fe2O3单一催化剂更优异的催化性能,同时它能够活化PMS降解不同污染物,具有优异的普遍适用性;通过自由基掩蔽实验我们发现,硫酸根自由基和羟基自由基是最主要的活性基团,对污染物的氧化还原起到了关键性作用。
1 实 验
1.1 试 剂
亚铁氰化钾;聚乙烯吡咯烷酮;盐酸(HCl,36wt%~38wt%);碳酸钠;六水合硝酸钴;乙醇;甲醇;过一硫酸氢钾(PMS);上述所有试剂均购于国药集团化学试剂北京有限公司,规格均为市售分析纯。双酚A;领氯苯酚;对氯苯酚;2,4-二氯酚;2,4,6-三氯酚;苯酚;购于西格玛奥德里奇化学试剂有限公司,上述使用的试剂均为分析级,并溶解于超纯水中使用。
1.2 材料制备
PB的制备:参考Han[11]的制备方案进行了微小改动,称取3.8 g聚乙烯吡咯烷酮、0.11 g亚铁氰化钾溶解于50 mL 0.1 mol/L盐酸溶液,搅拌30 min至溶液澄清透明,随后将得到的溶液放入80 ℃烘箱,反应24 h后冷却至室温得到蓝色混合物,然后用去离子水和乙醇离心洗涤三次得到蓝色沉淀物,将沉淀物冷冻干燥12 h,得到普鲁士蓝(PB)立方体。
Fe2O3@Co3O4的制备:称取200 mg PB溶于20 mL 1.25 mol/L Na2CO3溶液中,超声30 min,然后向上述溶液中缓慢加入20 mL 0.37 mol/L的Co(NO3)2溶液,磁力搅拌12 h,然后将得到的沉淀物用超纯水离心洗涤3遍后60 ℃烘干得到产物PB@Co(OH)2,然后将PB@Co(OH)2放入马弗炉中400 ℃煅烧4 h,得到产物Fe2O3@Co3O4。
对比材料Fe2O3的制备:直接称取1 g PB放入马弗炉中400 ℃煅烧4 h,得到产物Fe2O3。
对比材料Co3O4的制备:将20 mL 0.37 mol/L的Co(NO3)2溶液加入20 mL 1.25 mol/L Na2CO3溶液中,磁力搅拌12 h,然后将得到的沉淀物用超纯水离心洗涤3遍后60 ℃烘干得到产物Co(OH)2,然后将Co(OH)2放入马弗炉中400 ℃煅烧4 h,得到产物Co3O4。
1.3 催化性能测试
类芬顿催化反应过程:将10 mg催化剂分散于25 mL污染物(20 mg/L)溶液中。将烧杯包裹在锡箔中并搅拌30 min以达到吸附平衡。然后加入0.4 g/L PMS于上述溶液中。在一定的时间间隔内,用塑料注射器取0.8 mL样品,通过0.45 μm PTFE膜过滤器过滤到含有0.5 mL甲醇的色谱瓶中用,通过高效液相色谱仪(HPLC)(Agilent,1260 Infinity II)实时测量反应过程中污染物浓度。不同污染物的检测方法如表1所示。

表1 各种有机物的测试方法Table 1 Test methods of various organic compounds
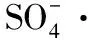
1.4 材料表征
通过使用D/MAX-2500V X射线衍射仪(XRD)对样品的物相结构进行分析鉴定,该衍射仪使用Cu Kα辐射(λ=1.541 8Å),工作电压为40 mA和40 kV。使用日立FESEM JSM-6700F扫描电子显微镜(SEM)在10 kV的加速电压下观察各种样品的表面形貌。
2 结果与讨论
2.1 XRD物相分析
图1为实验过程中所有材料的XRD图。图1(a)为亚铁氰化铁(普鲁士蓝PB)的XRD图,对应的JCPDS编号为87-0721;图1(b)为对比材料Fe2O3的XRD特征峰,对应JCPDS编号为33-0664;图1(c)为对比材料Co3O4的XRD特征峰,对应JCPDS编号为74-2120;图1(d)为催化剂Fe2O3@Co3O4的XRD图,31.3°、36.9°、44.8°、55.7°、59.4°特征峰分别对应Co3O4的(220)、(311)、(400)、(422)、(200)和(511)面,33.2°、35.6°、49.5°、54.1°等特征峰对应Fe2O3的(104)、(110)、(024)和(116)面,图1(d)说明我们成功地制备了Fe2O3@Co3O4复合催化剂。

图1 普鲁士蓝(a),Fe2O3(b),Co3O4(c), Fe2O3@Co3O4(d)的XRD图谱Fig.1 XRD pattern of Prussian blue(a),Fe2O3(b),Co3O4(c) and Fe2O3@Co3O4(d)
2.2 SEM形貌分析
图2为催化剂及其对比材料的SEM图,图2(a)为普鲁士蓝的SEM图,可知其为形貌为均匀的正方体纳米块,表面光滑;图2(b)为对比材料Fe2O3的SEM图,可以看出,煅烧后的PB生成的Fe2O3基本保持了PB的正方体形貌,但是经过煅烧,部分正方体结构发生坍塌,且表面不光滑;图2(c~d)为催化剂Fe2O3@Co3O4的SEM图,可以看出,Co3O4呈现小颗粒状均匀包覆在Fe2O3纳米块上生成了核壳结构的Fe2O3@Co3O4催化剂。

图2 普鲁士蓝(a),Fe2O3(b),Fe2O3@Co3O4(c~d)的SEM图Fig.2 SEM diagram of Prussian blue(a),Fe2O3(b) and Fe2O3@Co3O4(c~d)
2.3 催化性能
图3探索了催化剂Fe2O3@Co3O4在不同条件下的催化性能。图3(a)显示Fe2O3@Co3O4、Fe2O3、Co3O4都对BPA均有40%~50%的吸附量,但随着PMS的加入,BPA浓度大幅下降,当以Fe2O3为催化剂时,BPA 10 min降解率达到了78.7%,以Co3O4为催化剂时,BPA 10 min降解率达到了96.7%,但是当以复合材料Fe2O3@Co3O4为催化剂时,污染物BPA仅在4 min就完成了100%降解,说明复合材料Fe2O3@Co3O4的催化性能优于Co3O4、Fe2O3,Co3O4和Fe2O3复合后具有较好的协同催化性能;图3(b)对比了催化剂Fe2O3@Co3O4在有无PMS的反应条件下降解BPA的实验结果,本组实验添加了仅含有PMS的BPA体系用于对比,经过10 min的反应,BPA的浓度几乎没有变化,说明仅有PMS不会降解有机污染物;在加入催化剂Fe2O3@Co3O4不加PMS的BPA催化体系,BPA浓度在吸附解析平衡后几乎没有继续降解,而加入PMS的催化体系BPA浓度瞬间开始下降,说明了催化剂Fe2O3@Co3O4可以较好地激活PMS,且具有高效的催化反应性能。图3(c)验证了Fe2O3@Co3O4活化PMS降解不同污染物(邻氯苯酚、对氯苯酚、2,4-二氯酚、2,4,6-三氯酚、苯酚)的反应速率,结果表明,Fe2O3@Co3O4/PMS体系对不同污染物均有较好的催化性能,说明催化剂Fe2O3@Co3O4活化PMS降解污染物具有广泛的适用性。

图3 不同反应条件下的对BPA的降解曲线Fig.3 Degradation curves of BPA under different reaction conditions
2.4 催化机理

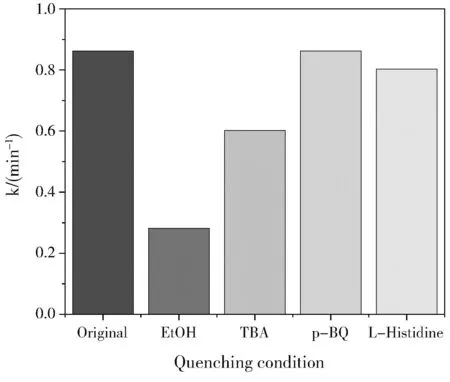
图4 不同淬灭剂下催化反应速率(k)的变化Fig.4 Changes of catalytic reaction rate (k) with different quench agents
3 结 论
该实验成功地制备了核壳结构的复合催化剂Fe2O3@Co3O4,在活化PMS的类芬顿反应条件下具有较好的催化性能,4 min即可完成100%降解,且对不同污染物具有一定的普遍适用性,核Fe2O3和壳层Co3O4的复合展现了良好的协同催化效应;Fe2O3@Co3O4活化PMS降解有机物的过程中,硫酸根自由基和羟基自由基是主要的活性物种。
