七氟烷后处理对大鼠脑缺血再灌注损伤保护作用的研究
2024-05-29毛艺锟王士雷吴秀云赵芹李瑜
毛艺锟 王士雷 吴秀云 赵芹 李瑜

[摘要] 目的 探討七氟烷后处理对大鼠脑缺血再灌注(I/R)损伤的保护作用及其机制。
方法选择SPF级成年健康雄性SD大鼠80只,随机分为假手术组(S组)、脑缺血再灌注组(I/R组)、脑I/R+七氟烷后处理组(ISP组)、脑I/R+七氟烷后处理+核因子E2相关因子2(Nrf2)抑制剂组(ISPB组),每组20只。除S组外,其余组大鼠均用线栓法闭塞大脑中动脉2 h并再灌注24 h的方法制备脑I/R损伤大鼠模型(S组大鼠只在大脑中动脉下穿线不结扎)。ISP组大鼠于再灌注即刻吸入3%七氟烷30 min,ISPB组在缺血前30 min腹腔注射Nrf2抑制剂鸦胆子苦醇(2 mg/kg),其余处理同ISP组。建模成功后通过神经功能评分评估各组大鼠神经功能损害程度。随后获取大鼠左心室血及脑组织病理切片,以2,3,5-氯化三苯基四氮唑(TTC)染色测定各组大鼠脑梗死体积百分比,采用酶联免疫吸附试验检测大鼠血清中炎症因子白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和氧化应激相关因子丙二醛(MDA)及超氧化物歧化酶(SOD)水平,采用免疫印迹实验检测大鼠脑组织中凋亡相关蛋白B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关联x(Bax)、半胱胺酸天冬氨酸蛋白酶-3(Caspase-3)及Nrf2信号通路相关蛋白Nrf2和血红素加氧酶1(HO-1)表达,采用免疫荧光实验检测大鼠脑组织细胞核内外Nrf2表达。
结果与I/R组相比,ISP组大鼠神经功能缺损评分、脑梗死体积百分比,以及血清IL-1β、TNF-α、MDA水平和脑组织总蛋白Bax、Caspase-3水平均下降(t=5.76~18.39,P<0.05);血清中SOD水平及脑组织总蛋白Nrf2、HO-1、Bcl-2水平均升高(t=5.73~14.08,P<0.05),Nrf2免疫荧光强度增强。与ISP组相比,ISPB组神经功能缺损评分、脑梗死体积百分比,以及血清中IL-1β、TNF-α、MDA水平和脑组织总蛋白Bax、Caspase-3水平均升高(t=3.06~8.19,P<0.05);血清中SOD水平和脑组织总蛋白Nrf2、HO-1、Bcl-2水平均下降(t=2.67~9.01,P<0.05),Nrf2免疫荧光强度减弱。
结论七氟烷后处理可以通过激活Nrf2信号通路抑制氧化应激、炎症反应和细胞凋亡,减轻大鼠脑I/R损伤。
[关键词] 七氟烷;缺血后处理;脑缺血;再灌注损伤;NF-E2相关因子2;信号传导;大鼠,Sprague-Dawley
[中图分类号] R619.9;R743.31
[文献标志码] A
Protective effect of sevoflurane postconditioning against cerebral ischemia/reperfusion injury in rats
MAO Yikun, WANG Shilei, WU Xiuyun, ZHAO Qin, LI Yu
(Department of Anesthesiology, The Affiliated Hospital of Qingdao University, Qingdao 266555, China)
;[ABSTRACT] Objective To investigate the protective effect of sevoflurane postconditioning against cerebral ischemia/reperfusion (I/R) injury in rats and its mechanism of action.
Methods A total of 80 specific pathogen-free healthy adult male Sprague-Dawley rats were selected and randomly divided into sham-operation group (S group), cerebral I/R group (I/R group), cerebral I/R+sevoflurane postconditioning group (ISP group), and cerebral I/R+sevoflurane
postconditioning+nuclear factor ery-throid 2-related factor 2 (Nrf2) inhibitor group (ISPB group), with 20 rats in each group. All rats except those in the S group were used to establish a rat model of cerebral I/R injury using the suture method for occlusion of the middle cerebral artery for 2 h, followed by reperfusion for 24 h, and for the rats in the S group, threading was performed below the middle cerebral artery without ligation. The rats in the ISP group were given inhalation of 3% sevoflurane immediately after reperfusion for 30 min, and those in the ISPB group were given intraperitoneal injection of the Nrf2 inhibitor brusatol (2 mg/kg) at 30 min before ischemia in addition to the treatment in the ISP group. After successful modeling, neurological deficit score was used to eval-
uate the degree of neurological impairment. Left ventricular blood samples and pathological sections of brain tissue were obtained, and 2,3,5-triphenyltetrazolium chloride staining was used to determine the percentage of cerebral infarct volume; enzyme-linked immunosorbent assay was used to measure the serum levels of inflammatory factors (interleukin-1β [IL-1β] and tumor necrosis factor-α [TNF-α]) and oxidative stress-related factors (malondialdehyde [MDA] and superoxide dismutase [SOD]); Western blotting was used to mea-sure the expression of apoptosis-related proteins (B-cell lymphoma-2 [Bcl-2], Bcl-2 related x [Bax], and Caspase-3) and Nrf2 signaling pathway-related proteins (Nrf2 and heme oxygenase-1 [HO-1]) in brain tissue; immunofluorescence assay was used to measure the expression of Nrf2 inside and outside the nucleus of brain tissue cells.
Results Compared with the I/R group, the ISP group had significant reductions in neurological deficit score, the percentage of cerebral infarct volume, the serum levels of IL-1β, TNF-α, and MDA, and the levels of Bax and Caspase-3 in brain tissue (t=5.76-18.39,P<0.05) and significant increases in the serum level of SOD and the levels of Nrf2, HO-1, and Bcl-2 in brain tissue (t=5.73-14.08,P<0.05), as well as a significant increase in Nrf2 immunofluorescence intensity. Compared with the ISP group, the ISPB group had significant increases in neurological deficit score, the percentage of cerebral infarct volume, the se-
rum levels of IL-1β, TNF-α, and MDA, and the levels of Bax and Caspase-3 in brain tissue (t=3.06-8.19,P<0.05) and significant reductions in the serum level of SOD and the levels of Nrf2, HO-1, and Bcl-2 in brain tissue (t=2.67-9.01,P<0.05), as well as a reduction in Nrf2 immunofluorescence intensity.
Conclusion Sevoflurane postconditioning can inhibit oxidative stress, inflammatory response, and cell apoptosis by activating the Nrf2 signaling pathway, thereby alleviating cerebral I/R injury in rats.
[KEY WORDS] Sevoflurane; Ischemic postconditioning; Brain ischemia; Reperfusion injury; NF-E2-related factor 2; Signal transduction; Rats, Sprague-Dawley
腦缺血再灌注(I/R)损伤大多发生在大脑主要动脉闭塞的情况下,缺血后血管再通往往会给机体造成更大损害。大量实验均采用大脑中动脉闭塞(MCAO)模型来研究脑I/R的机制[1]。当前,缺血性脑卒中在临床中的发生率和致残率仍较高,其病理损伤所涉及的分子机制复杂多样,例如炎症反应、细胞自噬、线粒体自噬、氧化应激、内质网应激、钙超载、血脑屏障破坏等[2-3],因此临床上目前缺少针对脑I/R损伤的有效治疗方案。
核因子E2相关因子2(Nrf2)是碱性亮氨酸拉链蛋白家族的成员之一,也是维持组织和细胞动态平衡的重要防御因子。有研究表明在脑I/R损伤等中枢神经系统急性损伤的病理过程中,Nrf2发挥了重要的神经保护作用,其中包括抑制氧化应激反应,减轻炎症反应,抑制细胞凋亡等[4]。既往有研究证实,脑组织中Nrf2的上调可一定程度改善缺血后脑神经损伤[5]。七氟烷作为吸入麻醉剂,因其起效快、诱导平稳等优点,在临床得到广泛应用。许多研究表明I/R开始时对缺血组织进行七氟烷处理(即七氟烷后处理)具有抑制活性氧的过度释放、抑制氧化应激平衡失调、减轻炎症反应、防止细胞内钙超载、减少神经元凋亡和稳定神经细胞膜等神经保护作用[6-7],但七氟烷保护作用的具体机制尚未完全清楚。本研究拟通过建立大鼠MCAO模型,探讨七氟烷对大鼠脑I/R损伤的保护作用及其机制。
1 材料与方法
1.1 实验材料
SPF级成年健康雄性SD大鼠80只(体质量230~250 g)购自济南朋悦实验动物繁育有限公司,鸦胆子苦醇购自北京索莱宝科技有限公司,2,3,5-氯化三苯基四氮唑(TTC)染色液购自上海源叶生物科技有限公司,血清超氧化物歧化酶(SOD)及丙二醛(MDA)ELISA试剂盒购江苏苏酶科生物科技有限公司,肿瘤坏死因子-α(TNF-α)及白细胞介素-1β(IL-1β)的ELISA试剂盒购自武汉爱博泰克生物科技有限公司,B细胞淋巴瘤-2(Bcl-2)购自英国Abcam公司,Nrf2及Bcl-2相关联x(Bax)购自武汉三鹰生物技术有限公司,半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)购买自北京博奥森生物技术有限公司,β-actin购自武汉伊莱瑞特生物科技有限公司。
1.2 分组与处理
将大鼠饲养在SPF动物房中,12 h/12 h晝夜环境,温度控制在(22±2)℃,可以自由获取水和食物。按简单随机分组将大鼠分为假手术组(S组)、脑I/R组(I/R组)、脑I/R+七氟烷后处理组(ISP组)、脑I/R+七氟烷后处理+Nrf2抑制剂组(ISPB组),每组20只。
将各组大鼠禁食12 h,麻醉后仰卧位固定,常规暴露并分离大鼠的右侧颈总动脉、颈外动脉和颈内动脉。动脉夹夹闭颈外动脉,结扎颈总动脉和颈内动脉,间隔为1 cm左右。I/R、ISP及ISPB组大鼠于两结扎点中间动脉段上剪一小口,将备好的线栓插入至大脑中动脉起始处,线栓插入深度为17~18 mm,S组大鼠结扎中间不做处理,结扎消毒后缝合各组大鼠组织皮肤。MCAO 2 h后将线栓拔出,使头端退到颈总动脉,即可恢复血流再灌注,大鼠出现偏瘫症状视为造模成功。ISP组大鼠再灌注开始时暴露于3%七氟烷30 min,ISPB组大鼠MCAO前30 min腹腔注射Nrf2信号通路抑制剂鸦胆子苦醇(溶于1 mL生理盐水中)2 mg/kg,再灌注开始时暴露于3%七氟烷30 min。
1.3 神经功能缺损评分
再灌注24 h后,每组中随机选取4只大鼠,参照Zea-longa评分标准[8]评估神经功能缺损情况。
1.4 脑梗死体积百分比测定
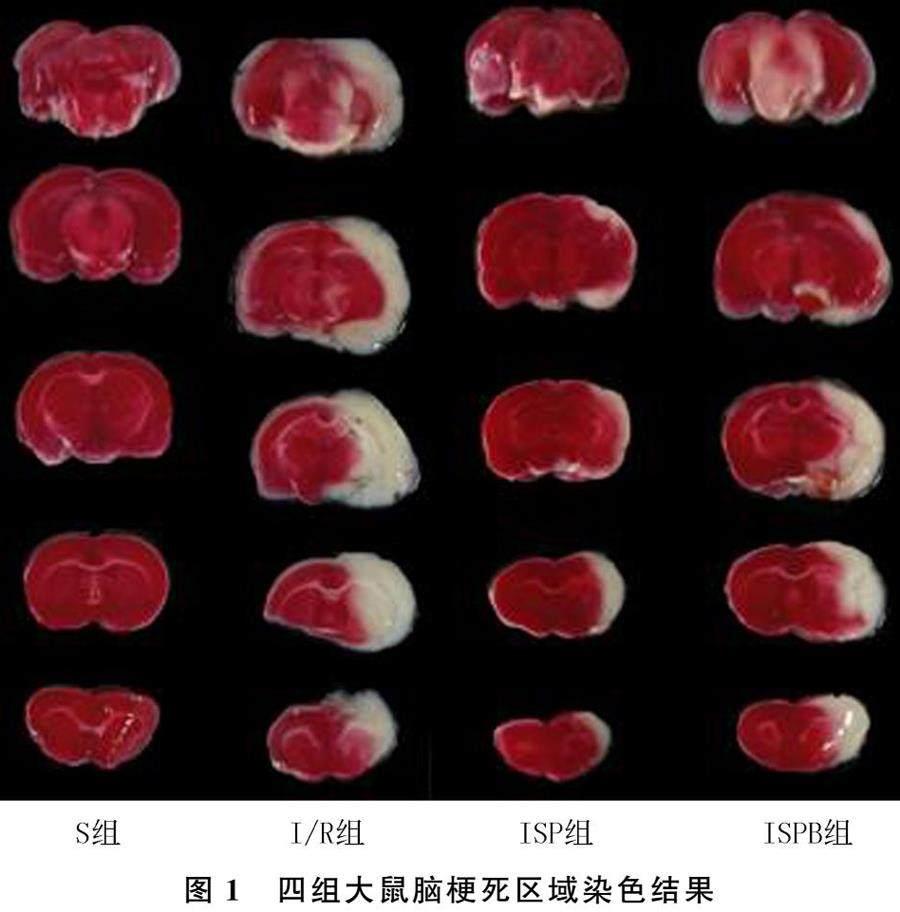
再灌注24 h后麻醉各组大鼠,左心室采血(每只3~5 mL),置于离心机中以3 500 r/min离心15 min,取上清液保存备用;随后使用PBS对大鼠进行心脏灌注,待大鼠肺和口唇黏膜等由红润变为苍白,心脏和肝脏等由深红变为浅红时结束灌注,冰上断头取脑备用。每组随机选取3只大鼠的脑组织,置于-20 ℃冰箱冷冻30 min后,由前向后间隔2 mm进行冠状切片,共切5片。将切片置于2% TTC染色液中,37 ℃下避光孵育30 min,切片变色后将其置于4%多聚甲醛中固定并拍照。用Image J软件计算每层的梗死体积,并计算脑梗死体积百分比。脑梗死体积百分比(%)=梗塞体积/(梗塞体积+非梗塞体积)×100%。
1.5酶联免疫吸附试验检测大鼠血清中氧化应激相关因子SOD、MDA以及炎症因子TNF-α、IL-1β水平 每组随机采集4只大鼠的血清,按照ELISA试剂盒按照说明书要求测定各组大鼠血清中SOD、MDA、TNF-α及IL-1β水平。
1.6免疫印迹法检测脑组织中Nrf2、HO-1、Bcl-2、Bax、Caspase-3表达
每组随机选取4只大鼠脑组织,切片后选取梗死部位,加入含蛋白酶抑制剂的组织裂解液将脑组织裂解,并提取脑梗死区域总蛋白。使用BCA试剂盒测定蛋白浓度,上样30 μg蛋白,80 V下于凝胶中电泳30 min,待蛋白到达分离胶后,调整为120 V下于凝胶中电泳60 min;通过湿转法按290 mA、120 min将蛋白转至PVDF膜,用含体积分数0.05脱脂奶粉的TBST缓冲液于室温封闭2 h,洗膜后分别加入Nrf2(1∶5 000)、Bax(1∶15 000)、Bcl-2(1∶2 000)及Caspase-3(1∶1 000)一抗,4 ℃下孵育过夜;次日加入辣根过氧化物酶标记的山羊抗兔多克隆抗体(1∶5 000)或者抗鼠多克隆抗体(1∶5 000)室温孵育1.5 h,条带上滴加ECL化学发光液置于凝胶成像仪显影。用Image J软件测定蛋白条带灰度值,以目的蛋白条带灰度值和内参β-actin(1∶1 000)条带灰度值比值代表各目的蛋白的相对表达水平。
1.7免疫荧光实验检测脑组织中Nrf2表达
每组随机选取4只大鼠脑组织,在冠状平面由前向后以4 μm厚切片,石蜡包埋并脱水,用EDTA抗原修复缓冲液将脱水后的组织切片进行抗原修复;再用体积分数0.10的驴血清封闭30 min,甩干封闭液后加入Nrf2一抗(1∶500),4 ℃下孵育过夜;洗涤之后再加入Cy3标记山羊抗兔二抗(1∶300),避光室温孵育1 h;再加入DAPI染液,避光室温下孵育10 min,甩干后封片,将切片置于荧光显微镜下观察并采集图像。
1.8 统计学方法
采用GraphPad Prism 8.0软件对数据进行统计学分析。符合正态分布的计量资料以 ±s表示,多组间比较采用单因素方差分析,两两比较采用Tukey检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 四组大鼠神经功能缺损评分和脑梗死体积百分比比较
S组、I/R组、ISP组及ISPB组大鼠的神经功能缺损评分分别为0、(3.70±0.61)、(1.10±0.10)、(2.43±0.49)分,以上四组脑梗死体积百分比分别为0、(33.44±2.55)%、(12.50±0.88)%和(24.47±2.67)%。I/R组大鼠神经功能缺损评分及脑梗死体积百分比均显著高于S组及ISP组(F=49.67、176.20,t=7.31~22.74,P<0.05),ISP组神经功能缺损评分以及脑梗死体积百分比显著低于ISPB组(t=4.59、7.37,P<0.05)。见图1。
2.2四组大鼠血清中IL-1β、TNF-α、MDA、SOD水平比较
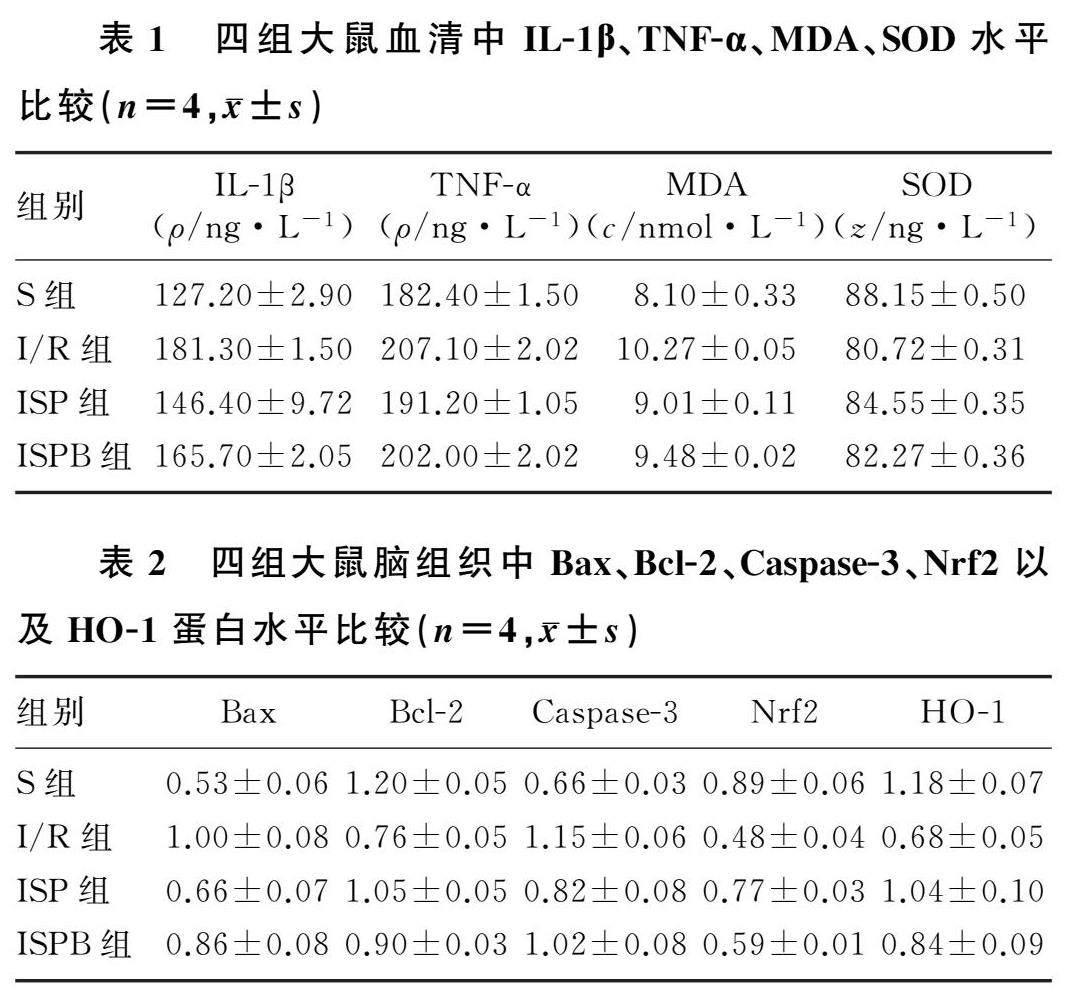
I/R组大鼠血清中IL-1β、TNF-α和MDA水平显著高于S、ISP组(F=60.58~126.70,t=6.16~28.74,P<0.05),SOD水平显著低于S、ISP组(F=208.00,t=14.08、21.90,P<0.05);ISP组IL-1β、TNF-α和MDA水平显著低于ISPB组(t=3.06~8.19,P<0.05),SOD水平则显著高于ISPB组(t=7.79,P<0.05)。见表1。
2.3四组大鼠脑组织当中Bax、Bcl-2、Caspase-3、Nrf2、HO-1蛋白水平比较
I/R组大鼠脑组织中Bax、Caspase-3蛋白的水平显著高于S、ISP组(F=26.05、31.95,t=5.44~12.19,P<0.05),Bcl-2、Nrf2、HO-1蛋白水平低于S组、ISP组(F=23.55~65.14,t=5.73~11.43,P<0.05);ISP组Bax、Caspase-3蛋白水平显著低于ISPB组(t=3.06、3.41,P<0.05),Bcl-2、Nrf2、HO-1蛋白水平显著高于ISPB组(t=2.67~9.01,P<0.05)。见表2、图2。
2.4四组大鼠脑组织中Nrf2表达的比较
免疫荧光实验检测结果显示,ISP组大鼠脑组织中Nrf2免疫荧光强度高于S、ISP及ISPB组。见图3。
3 讨 论
脑I/R损伤会造成机体一系列应激反应,如氧化应激平衡失调、炎症反应发生、细胞出现凋亡和自噬等。既往研究表明,I/R模型造模前30 min腹腔注射Nrf2抑制剂鸦胆子苦醇会减少脑组织中Nrf2的表达[9],本课题组前期的预实验也得出了同样结论,因此本研究参考以上结论设置了ISPB组。
本研究结果显示,与ISP组相比,ISPB组大鼠的神经功能缺损评分增加,脑梗死体积百分比增加,血清中MDA、IL-1β以及TNF-α水平均升高,SOD水平降低,脑组织总蛋白Bax、Caspase-3水平升高,Bcl-2、Nrf2和HO-1水平降低,脑组织Nrf2免疫荧光强度下降,提示七氟烷后处理可以通过激活Nrf2信号通路,从而抑制氧化应激、炎症反应和细胞凋亡,减轻大鼠脑I/R损伤。
正常情况下,机体内活性氧(ROS)的生成与细胞抗氧化机制相平衡。当暴露于有害刺激时,ROS会大量生成而打破平衡,导致氧化应激平衡失调。氧化应激通过多种不同途径参与脑缺血损伤,破坏细胞结构,损害细胞正常功能,进而导致细胞坏死和凋亡。抗氧化系统的激活是机体对各类氧化损伤的反应机制,以减少氧化应激带来的损害。SOD和谷胱甘肽等通过维持细胞和组织的氧化还原平衡发挥抗氧化作用[10]。SOD和MDA是衡量氧化应激反应的两个重要的指标,SOD能够清除体内的氧自由基,MDA則是衡量膜脂过氧化程度的常用指标之一[8]。ROS能够导致细胞膜脂质的过氧化,生成MDA,进而加重血脑屏障等结构的损伤[11]。脑I/R损伤可以引起炎症级联反应,包括氧化应激、免疫细胞浸润和炎症因子产生等。被激活的免疫细胞中促炎M1表型小胶质细胞能够释放TNF-α、IL-1β和IL-6等炎症因子,加剧脑损伤[12-13]。作为碱性亮氨酸家族成员之一,Nrf2可结合抗氧化反应元件激活转录因子(如HO-1等),募集炎症细胞促进抗炎过程,Nrf2的上调能够抑制TNF-α和IL-1β等炎症因子的过度产生,并遏制慢性炎症性疾病进程。Nrf2也参与细胞及组织氧化还原平衡的调节过程,Nrf2能够激活多种抗氧化蛋白的表达,减少ROS导致的细胞损伤[14]。有研究表明,脑I/R损伤后,Nrf2被激活,一系列抗氧化基因开始转录,HO-1等表达增加[15]。HO-1可催化氧化性血红素分解代谢的关键步骤[16],增强脑组织对缺血导致氧化损伤的耐受程度[17]。既往研究表明,Nrf2和HO-1的表达能够抑制细胞炎症反应,在脑I/R过程中发挥神经保护作用[18]。本研究中,与I/R组相比,ISP组大鼠血清中MDA水平下降,SOD水平上升,血清中IL-1β和TNF-α水平下降,脑组织总蛋白Nrf2和HO-1水平上升,脑组织Nrf2免疫荧光强度增强,表明在脑I/R损伤过程中,七氟烷后处理激活了大鼠Nrf2信号通路,减弱了I/R导致的炎症反应,并在一定程度上抑制了氧化应激反应。
I/R过程可通过细胞凋亡导致细胞死亡,而细胞凋亡则导致缺血组织产生大量炎症反应[19]。细胞凋亡分为内源性和外源性两种途径,其中外源性途径是指在病理条件下,细胞膜表面被激活的死亡配体与受体结合诱发的一系列级联反应。脑I/R损伤引起的炎症反应和氧化应激能够激活巨噬细胞,巨噬细胞分泌TNF-α,其与细胞表面Toll样受体结合后,激活Caspase-8,Caspase-8进一步激活Caspase-3,引发外源性细胞凋亡[20]。细胞内部的多种因素如DNA损伤、存活因子缺少或内质网应激等均可引起内源性凋亡,促凋亡蛋白Bax和抗凋亡蛋白Bcl-2是内源性凋亡途径中的关键蛋白,其平衡在I/R诱导的细胞凋亡中起关键作用[21]。Nrf2信号通路可通过抑制细胞凋亡在I/R过程中起到脑保护作用,Nrf2可诱导抗凋亡蛋白Bcl-2表达并且抑制Bax易位至线粒体,从而降低细胞色素c的释放。另外,Nrf2受体的依赖性激活能够通过抑制Caspase-3的激活而减少脑缺血造成的细胞凋亡。本研究结果显示,ISP组较I/R组大鼠脑组织总蛋白Bax、Caspase-3水平下降,Bcl-2水平上升,表明七氟烷后处理抑制了I/R诱导的神经细胞凋亡。
综上所述,七氟烷后处理可以通过激活Nrf2信号通路抑制氧化应激反应、炎症反应和细胞凋亡,减轻大鼠脑I/R损伤。
倫理批准和动物权利声明: 本研究涉及的所有动物实验均已通过青岛大学附属医院实验动物福利伦理委员会的审核批准(文件号AH-QU-MAL20220218)。所有实验过程均遵照《实验动物管理与使用指南》的条例进行。
作者声明: 毛艺锟、王士雷、李瑜参与了研究设计;毛艺锟、王士雷、吴秀云、赵芹、李瑜参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]PARK Y H, PARK H P, KIM E, et al. The antioxidant effect of preischemic dexmedetomidine in a rat model: Increased expression of Nrf2/HO-1 via the PKC pathway[J]. Braz J Anesthesiol, 2023,73(2):177-185.
[2] HITOMI E, SIMPKINS A N, LUBY M, et al. Blood-ocular barrier disruption in patients with acute stroke[J]. Neurology, 2018,90(11):e915-e923.
[3] FAN Y Y, HU W W, NAN F, et al. Postconditioning-induced neuroprotection, mechanisms and applications in cerebral ischemia[J]. Neurochem Int, 2017,107:43-56.
[4] YUAN Q H, YUAN Y, ZHENG Y, et al. Anti-cerebral ischemia reperfusion injury of polysaccharides: A review of the mechanisms[J]. Biomed Pharmacother, 2021,137:111303.
[5] WANG L, ZHANG X, XIONG X, et al. Nrf2 regulates oxidative stress and its role in cerebral ischemic stroke[J]. Antioxidants, 2022,11(12):2377-2377.
[6] WANG H L, LI P Y, XU N, et al. Paradigms and mechanisms of inhalational anesthetics mediated neuroprotection against cerebral ischemic stroke[J]. Med Gas Res, 2016,6(4):194-205.
[7] YANG T, SUN Y, ZHANG F. Anti-oxidative aspect of inhaled anesthetic gases against acute brain injury[J]. Med Gas Res, 2016,6(4):223-226.
[8] SINGH L, SINGH A P, BHATTI R. Mechanistic interplay of various mediators involved in mediating the neuroprotective effect of daphnetin[J]. Pharmacol Rep, 2021,73(5):1220-1229.
[9] JIANG S, DENG C, LV J J, et al. Nrf2 weaves an elaborate network of neuroprotection against stroke[J]. Mol Neurobiol, 2017,54(2):1440-1455.
[10] SHANG S J, SUN F Q, ZHU Y L, et al. Sevoflurane preconditioning improves neuroinflammation in cerebral ischemia/reperfusion induced rats through ROS-NLRP3 pathway[J]. Neurosci Lett, 2023,801:137164.
[11] LI L, PENG L, ZHU J, et al. DJ-1 alleviates oxidative stress injury by activating the Nrf2 pathway in rats with cerebral ischemia-reperfusion injury[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2021,41(5):679-686.
[12] DING Y, CHEN M C, WANG M M, et al. Posttreatment with 11-keto-β-boswellic acid ameliorates cerebral ischemia-reperfusion injury: Nrf2/HO-1 pathway as a potential mechanism[J]. Mol Neurobiol, 2015,52(3):1430-1439.
[13] SUN Y, YANG X, XU L J, et al. The role of Nrf2 in relieving cerebral ischemia-reperfusion injury[J]. Curr Neuropharmacol, 2023,21(6):1405-1420.
[14] PARK H R, LEE H, LEE J J, et al. Protective effects of spatholobi caulis extract on neuronal damage and focal ischemic stroke/reperfusion injury[J]. Mol Neurobiol, 2018,55(6):4650-4666.
[15]SINGH S, NAGALAKSHMI D, SHARMA K K, et al. Natural antioxidants for neuroinflammatory disorders and possible involvement of Nrf2 pathway: A review[J]. Heliyon, 2021,7(2):e06216.
[16] JURCAU A, SIMION A. Neuroinflammation in cerebral ischemia and ischemia/reperfusion injuries: From pathophysio-
logy to therapeutic strategies[J]. Int J Mol Sci, 2021,23(1):14.
[17] LOU J, CAO G X, LI R R, et al. β-caryophyllene attenuates focal cerebral ischemia-reperfusion injury by Nrf2/HO-1 pathway in rats[J]. Neurochem Res, 2016,41(6):1291-1304.
[18] CHEN W W, TENG X, DING H M, et al. Nrf2 protects against cerebral ischemia-reperfusion injury by suppressing programmed necrosis and inflammatory signaling pathways[J]. Ann Transl Med, 2022,10(6):285.
[19] LIU H, JING X B, DONG A Q, et al. Overexpression of TIMP3 protects against cardiac ischemia/reperfusion injury by inhibiting myocardial apoptosis through ROS/mapks pathway[J]. Cell Physiol Biochem, 2017,44(3):1011-1023.
[20] SAHA S, BUTTARI B, PANIERI E, et al. An overview of Nrf2 signaling pathway and its role in inflammation[J]. Molecules, 2020,25(22):5474.
[21] XU Q, CHEUNG R T F. Melatonin mitigates type 1 diabetes-aggravated cerebral ischemia-reperfusion injury through anti-inflammatory and anti-apoptotic effects[J]. Brain Behav, 2023,13(9):e3118.
(本文編辑 范睿心 厉建强)
