海南雷公笋的SCoT-PCR体系优化及有效引物筛选
2024-05-29孙秀秀王春梅陈加利夏腾飞冯依欣郑道君
孙秀秀 王春梅 陈加利 夏腾飞 冯依欣 郑道君

摘要 [目的]分析DNA、引物,dNTPs、Taq DNA聚合酶4种因素对雷公笋SCoT-PCR扩增结果的影响,通过最优的SCoT-PCR反应体系筛选多态性引物,为雷公笋种质资源分子标记研究提供条件。[方法]以海南雷公笋为材料,采用单因素试验和正交试验方法。[结果]Taq酶对雷公笋SCoT-PCR扩增的影响最大,其次是模板DNA和dNTPs,最后是引物;最优反应体系為20 μL体系中40 ng DNA,0.30 μmol/L 引物,0.25 mmol/L dNTPs,3.00 U Taq酶。经验证,该体系获得的扩增产物清晰稳定;应用该体系从40条SCoT引物筛选出8条多态性好,且适合雷公笋扩增的引物,多态性条带占62.64%。[结论]该研究为使用SCoT分子标记技术对雷公笋开展深入研究提供了重要的理论基础和技术支持。
关键词 雷公笋;SCoT;反应体系优化;有效性引物
中图分类号 S647文献标识码 A
文章编号 0517-6611(2024)08-0095-05
doi:10.3969/j.issn.0517-6611.2024.08.022
Optimization of SCoT-PCR System and Screening of Effective Primers for Costus speciosus of Hainan
SUN Xiu-xiu1,2,WANG Chun-mei1,2,CHEN Jia-li1,2 et al
(1.Sanya Institute,Hainan Academy of Agricultural Sciences,Sanya,Hainan 572025; 2.The Key Laboratory of Tropic Special Economic Plant Innovation and Utilization/National Germplasm Resource Chengmai Observation and Experiment Station/Institute of Tropical Horticulture Research,Hainan Academy of Agricultural Sciences,Haikou,Hainan 571100)
Abstract [Objective]In order to analyze the effects of DNA,primers,dNTPs and Taq DNA polymerase on the SCoT-PCR amplification results,the polymorphic primers were selected through the optimal SCoT-PCR reaction system to provide conditions for the study of molecular markers of the Costus speciosus resources.[Method]Unifactor test and orthogonal test methods were used.[Result]Taq had the greatest effect on SCoT-PCR amplification,followed by template DNA and dNTPs,and the last was primer.The optimal reaction system was 40 ng DNA,0.30 μmol/L primer,0.25 mmol/L dNTPs,3.00 U Taq enzyme in the 20 system.The amplification products obtained by this system were clear and stable.8 primers with good polymorphism were selected from 40 SCoT primers,and the polymorphism bands accounted for 62.64%.[Conclusion]This study provided an important theoretical basis and technical support for further study of Costus speciosus with SCoT molecular marker technology.
Key words Costus speciosus;SCoT;Reaction system optimization;Effectiveness primers
雷公笋,学名闭鞘姜(Costus speciosus),属于姜科闭鞘姜属植物,是海南特有的野生草本植物,具有消炎利尿、散瘀消肿和解毒止痒等功效[1-2]。雷公笋还可提取合成甾体激素药物的重要原料甾体皂苷[3]。此外,雷公笋营养成分种类齐全,含有丰富的膳食纤维、氨基酸和维生素等物质[4],作为海南的常见野菜深受消费者喜爱。雷公笋在海南岛各地都有分布,但大多数为野生资源。近些年,随着人们对绿色食品的喜爱,市场需求量增加,雷公笋野生资源遭受前所未有的破坏。因此,对海南雷公笋野生资源进行遗传学研究,更好地评估和保护雷公笋资源显得尤为迫切和重要。然而,目前对雷公笋的研究仅限于化学成分和药用分析[5-7],对雷公笋资源的分布与储量、资源类型、生境等知之甚少。由于分子标记技术的快速发展,越来越多的研究人员开始使用分子标记手段对植物的遗传多样性进行研究。目标起始密码子多态性 (SCoT,start codon targeted polymorphism) 标记[8]是一种新型分子标记技术,利用基因翻译起始点(ATG)的侧翼序列的保守性和一致性,设计引物扩增目的基因,具有引物设计简单,试验操作方便,成本低,多态性高,遗传信息丰富等优点[9-11]。SCoT分子标记在果树[10]、蔬菜[12]、花卉[13]和中草药[14-15]等方面有较强的通用性,但在闭鞘姜属植物中研究鲜见报道。鉴于此,笔者以海南雷公笋为试材,建立一个最优且稳定的SCoT-PCR反应体系,筛选了合适的SCoT引物,不仅有助于解析雷公笋种质资源的遗传多样性,还可为其亲缘关系和分子辅助育种等研究奠定基础。
1 材料与方法
1.1 材料
试验所用试材取自海南省海口琼山区茂山村,定安县龙湖镇云头村和屯昌县屯城镇下坡村雷公笋野生居群,材料编号依次为MS、YT和XP。取健康、干净叶片用硅胶保存备用。
1.2 主要试剂与仪器
试剂:Taq DNA聚合酶、dNTPs、10×Taq Buffer(含Mg2+)均由南京諾唯赞生物技术有限公司提供,100 bp DNA Ladder Marker由北京中科瑞泰集团公司提供,SCoT引物由北京诺塞基因组研究中心有限公司合成。仪器:振荡仪、电热恒温水浴锅、离心机、紫外分光光度计、移液枪、PCR仪、电冰箱、水平电泳仪、Gel Doc XR 型凝胶成像系统等。
1.3 基因组DNA提取
利用FOREGENE试剂盒提取雷公笋的叶片DNA,用0.8%~1.0%琼脂糖凝胶电泳检验基因组DNA的质量,用紫外分光光度计检验DNA的纯度和浓度,最后将获得的基因组DNA样品加无菌水稀释到20 ng/μL,存放于-20 ℃冰箱中备用。
1.4 SCoT-PCR反应体系的优化与建立
1.4.1 单因素试验设计。
采用MS基因组DNA作为模板,选用引物SCoT3(CAACAATGGCTACCACCG){16},初始体系中总体系20 μL:2.0 μL 2×PCR buffer,0.2 μL 1 U Taq DNA聚合酶,0.6 μL 0.3 mmol/L dNTPs ,1.6 μL 0.8 μmol/L 引物和1.0 μL 40 ng DNA,纯净水14.6 μL。扩增程序:94 ℃预变性5 min,94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1.5 min,35个循环;72 ℃延伸10 min。维持其他3种因素恒定,改变1个因素的浓度进行扩增(表1),筛选后的浓度范围用作正交试验。
1.4.2 雷公笋SCoT-PCR反应体系的建立。
对模板DNA、引物、dNTPs和Taq 酶进行4因素4水平L16正交试验,确立最优反应体系。为了更好地评估扩增结果,参考何正文等[17-18]的直观分析法,将条带数目丰富且清晰的记为16分,最差的为1分。通过2次独立计分,计算出2次评分的平均值,并对其进行极差R值分析。
1.5 雷公笋SCoT-PCR有效引物筛选和反应体系验证
以3份地理距离较远的雷公笋资源的基因组DNA为模板,应用最佳SCoT-PCR的反应体系,对40对SCoT引物进行复选,从中筛选能够扩增3条以上产物的引物,并对其进行多态性比率(PPB)评价和反应体系稳定性验证。
2 结果与分析
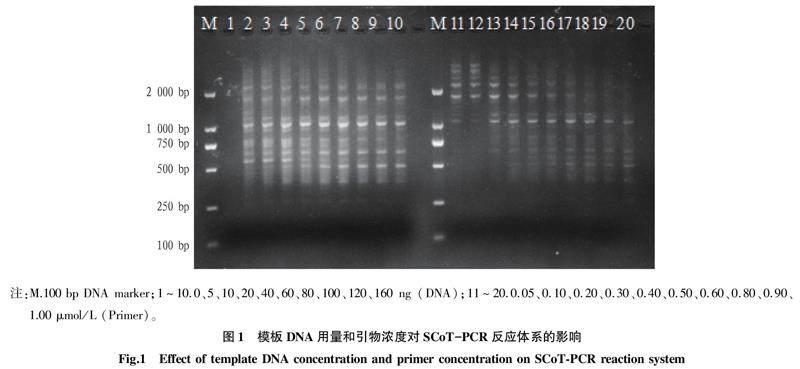
2.1 模板DNA用量对SCoT-PCR扩增效果的影响
在20 μL体系中,其他因素不变,雷公笋DNA用量设置为10个梯度,即0、5、10、20、40、60、80、100、120、160 ng。通过图1可见,除DNA的用量为0 ng外,其余用量都可扩增出条带;随着DNA用量的增加,条带清晰度和丰富度逐渐升高后又逐渐下降。DNA用量在10~60 ng时条带完整,亮度较其他用量时高,且无拖带现象;DNA用量高于60 ng时扩增条带的丰富度和清晰度均降低。因此,DNA用量范围确定在10~60 ng 用于正交试验。
2.2 引物浓度对SCoT-PCR扩增效果的影响
引物浓度对PCR扩增有重要影响,当引物浓度超过一定范围时,增加非特异性扩增的概率,从而促进引物二聚体形成;引物浓度过低时,与模版DNA结合率下降,使扩增产物产率下降。根据图1,当引物浓度低于0.10 μmol/L,与DNA 结合位点变少,导致PCR反应不完全,泳道11、12扩增产物条带少;随着引物浓度的增加,扩增条带逐渐增多并清晰,特别是在引物浓度在0.20~0.50 μmol/L时,扩增效果好;当引物浓度高于0.50 μmol/L 时,开始出现条带不清晰现象。因此,正交试验应选择引物浓度在0.20~0.50 μmol/L。
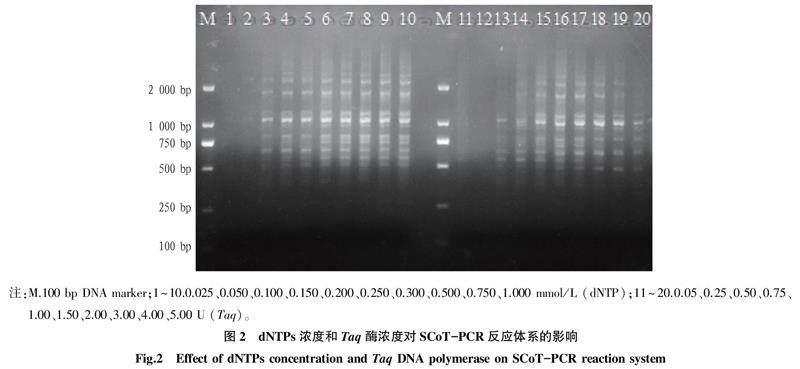
2.3 dNTPs浓度对SCoT-PCR扩增效果的影响
dNTPs作为PCR扩增反应的原材料之一,如果浓度过低,扩增效率会下降,条带变弱或无扩增产物[19];相反,浓度过高时,其会与Taq 酶竞争Mg2+,从而大大降低Mg2+与Taq 酶的结合效率[17]。如图2所示,不同浓度含量对扩增结果有显著影响,在0.025~0.050 mmol/L,泳道均未出现条带;0.100~0.200 mmol/L扩增的条带数量较少,清晰度较差;而0.250~1.000 mmol/L扩增的条带最佳。
2.4 Taq酶浓度对SCoT-PCR扩增效果的影响
Taq酶对PCR扩增的主要影响包括条带的多少和亮度的强弱[20],Taq酶浓度过低,扩增效率下降,Taq酶浓度过高时,PCR的稳定性会下降,易产生假阳性结果。由图2可知,由于Taq酶浓度的增大,扩增条带的清晰度和多态性都有所提升。当Taq酶浓度为0.05、0.25 U时,无扩增产物产生;当Taq酶浓度在0.50~0.75 U时,出现扩增条带但丰富度低;当Taq酶浓度在1.00~3.00 U时,扩增条带数量逐渐增加,并且更加清晰可见;当Taq酶浓度高于3.00 U时,扩增产物丰富度降低,且背景噪音较大。因此,选择Taq酶浓度在1.00~3.00 U用于正交试验。
2.5 雷公笋SCoT-PCR反应体系的建立
根据单因素试验结果,设计组合的L16 (44) 组合的SCoT-PCR正交试验(表2)。从图3可以看出,由于模板DNA、引物、dNTPs和Taq酶的浓度组合不同,扩增效果存在差异。根据扩增产物对16个组合进行PCR评分(表3)。如图3所示,组合12扩增出丰富的条带,有10个条带,扩增明显且清晰度高,扩增产物背景低,打分为16分;组合2、13和14的PCR扩增背景噪音低,也可扩增出9条清晰可辨的条带,打分分别为14、14和15分;其余组合要么条带缺失,要么扩增产物背景噪音高。因此,组合12为雷公笋SCoT的最佳反应组合,即总体系为20 μL,DNA含量为40 ng,引物浓度为0.30 μmol/L,dNTPs浓度为0.25 mmol/L,Taq的含量3.00 U。
极差 (R)可以判断对反应体系的主要影响因素和次要影响因素。R越大,说明该因素对反应体系的影响越大,该因素越重要。由表3可知,该研究模板DNA、引物、dNTPs和Taq酶的R值分别为3.25、2.25、3.25和6.25,说明各因素对SCoT-PCR扩增结果的影响程度为Taq酶>模板DNA=dNTPs>引物。
2.6 雷公笋SCoT-PCR引物筛选及稳定性检验
利用已建立的SCoT-PCR体系,将雷公笋的MS、YT、XP基因组DNA作为模板,对初步筛选的引物进行复选。从图4可以看出,所有引物均能扩增出条带,扩增结果稳定、清晰,特异性条带无明显弥散现象。筛选出8条扩增条带清晰、多态性良好的引物。8个引物多态性比率在40.00% ~ 84.61%(表4),其中SCoT14多态性最好。结果表明,在最佳反应体系下,3种资源均能扩增出清晰、丰富、稳定的条带。因此,该系统稳定可靠,可用于雷公笋资源的SCoT分析。
3 讨论
分子标记是继形态标记、细胞标记、生物化学标记之后的遗传多样性标记,在基因组水平上直接反映遗传多态性[21]。目前应用最广泛的分子标记技术有扩增片段长度多态性(AFLP)、随机扩增片段长度多态性(RAPD)、微卫星DNA (SSR)等。SCoT作为一种新开发的分子标记,与其他标记相比,可以获得与性状密切相关的目标基因,具有操作简单、引物通性强、遗传信息丰富、性价比高等优点[9-10,22]。目前广泛应用于种质资源多样性、群体遗传结构、亲缘关系及遗传图谱构建等领域[11,23-25]。SCoT-PCR扩增结果经常受到模版DNA、引物、dNTPs和Taq聚合酶等因素的影响,因此该试验先用单因素试验缩小每个因素的适宜浓度范围,再用正交试验优化反应体系。单因素试验虽然操作简单,可在单一水平下选出该因素的合适用量[26],但SCoT-PCR扩增过程并不由单个因素决定,往往是多个因素、多个水平共同作用的结果,因此正交试验可满足该试验的要求,综合考察反应体系中各因素的交互作用,从而快速获得最佳组合[27]。该研究利用正交设计方法对模版DNA、引物、dNTPs和Taq聚合酶等因素进行筛选和优化,发现对雷公笋SCoT-PCR结果影响最大的是Taq聚合酶,其次为模板DNA和dNTPs,最小为引物浓度。这与赵瑞强等[28-29]在铁皮石斛和菊花中的研究结果一致,但与韩国辉等[30]在蓝莓上的研究结果有差异,对蓝莓SCoT-PCR結果影响最大的因素为dNTPs。这说明不同物种间分子标记体系影响因素不同[31]。因此,在进行SCoT标记时,应当对其反应体系进行优化,以确保其稳定性和可靠性。
该研究从40条引物中共筛选出8条具有条带清晰、多态性丰富、重复性好的引物。用筛选出来的引物对雷公笋3个居群(MS、YT和XP)的DNA进行扩增,均能获得清晰稳定、多态性丰富的扩增结果。通过对8条引物的扩增,共产生108条带,平均每条引物扩增13.5条带,多态性比率达到62.64%,高于熊发前等[9]在花生遗传多样性分析中的每条引物扩增条带数(10.42)和多态性比率(31.80%),但低于苏亚春等[32]对甘蔗的遗传多样性分析中的多态性比率(82.14%)。这可能是由于该研究采用的琼脂糖凝胶分辨率较低,分离条带模糊,导致多态性比率相对较低,这与李宁等[31]的研究结果一致。该研究从40条SCoT引物中筛选出8条多态性好、清晰度高的有效引物,从而证实了最佳反应体系的稳定性和可靠性,为雷公笋遗传多样性分析、亲缘关系鉴定及相关分子标记的开发提供了理论基础和技术支持。
4 结论
该研究经过试验得到适合雷公笋SCoT标记的20 μL的优化体系:DNA含量为40 ng,引物浓度为0.25 μmol/L,dNTPs浓度为0.30 mmol/L,Taq含量3.00 U。从40条引物中共筛选出8条具有条带清晰、多态性丰富、重复性好的引物。用筛选出的引物对雷公笋3个居群(MS、YT和XP)的DNA进行扩增,均能获得清晰稳定、多态性丰富的扩增结果。通过对8条引物扩增,共产生108条带,平均每条引物扩增13.5条带,多态性比率达到62.64%。
参考文献
[1] 云南省食品药品监督管理局.云南省中药材标准:第3册·傣族药[M].昆明:云南科技出版社,2005.
[2] 赵国平,戴慎,陈仁寿.中药大辞典(上册)[M].上海:上海科学技术出版社,2006:93-94.
[3] 顾关云.闭鞘姜及其同属植物的研究进展[J].国外医学(药学分册),1986,13(4):247-250.
[4] 赵天瑞,樊建,李永生,等.云南野生闭鞘姜的营养成分研究.西南农业大学学报(自然科学版),2004,26(4):456-458.
[5] 胡琳,陈娜娜,贺正山.闭鞘姜化学成分及药理作用研究进展[J].云南民族大学学报(自然科学版),2014,23(1):18-23.
[6] 李忠琼,傅文,林瑞超,等.闭鞘姜属植物化学成分及药理研究概况[J].中药材,2001,24(2):148-150.
[7] 乔春峰,徐珞珊,董辉,等.闭鞘姜类药材的鉴别研究[J].中草药,2002,33(1):62-64.
[8] COLLARD B C Y,MACKILL D J.Start codon targeted(SCoT) polymorphism:A simple,novel DNA marker technique for generating gene-targeted markers in plants[J].Plant molecular biology reporter,2009,27(1):86-93.
[9] 熊发前,蒋菁,钟瑞春,等.目标起始密码子多态性(SCoT)分子标记技术在花生属中的应用[J].作物学报,2010,36(12):2055-2061.
[10] 蔡元保,杨祥燕,陈豪军,等.SRAP结合SCoT标记分析番木瓜种质的遗传多样性[J].植物遗传资源学报,2014,15(2):292-298.
[11] AMIRMORADI B,TALEBI R,KARAMI E.Comparison of genetic variation and differentiation among annual Cicer species using start codon targeted (SCoT) polymorphism, DAMD-PCR, and ISSR markers[J].Plant systematics & evolution,2012,298(9):1679-1688.
[12] 林清,龙治坚,韩国辉,等.基于SCoT标记的芥菜种质遗传多样性与指纹图谱[J].中国蔬菜,2013(12):31-39.
[13] 叶松.菊花表型性状与SSR、SCoT分子标记的关联分析[D].开封:河南大学,2017.
[14] 杨珂,周延清,段红英,等.地黄SCoT分子标记体系的建立和指纹图谱的构建[J].广西植物,2019,39(5):608-614.
[15] 邵征绩,张璐,郑升,等.铁皮石斛SCoT-PCR反应体系的建立及其初步应用[J].分子植物育种,2021,19(5):1606-1613.
[16] COLLARD B C Y,MACKILL D J.Start codon targeted ( SCoT) polymorphism:A simple, novel DNA marker technique for generating gene-targeted markers in plants[J].Plant molecular biology reporter,2009,27(1):86-93.
[17] 何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[18] 郑道君,谢良商,张文,等.海南龙血树RAPD-PCR反应体系的优化[J].广西植物,2011,31(1):31-35,86.
[19] 严武平,陈宣,杨立荣,等.濒危植物海南龙血树SSR-PCR反应体系优化[J] .分子植物育種,2018,16(1):195-200.
[20] 孙成成,王振国,周伟,等.高粱SCoT-PCR反应体系的建立与优化[J].分子植物育种,2021,19(17):5735-5739.
[21] 邱芳,伏健民,金德敏,等.遗传多样性的分子检测[J].生物多样性,1998,6(2):143-150.
[22] ALIKHANI L,RAHMANI M S,SHABANIAN N,et al.Genetic variability and structure of Quercus brantii assessed by ISSR,IRAP and SCoT markers[J].Gene,2014,552(1):176-183.
[23] 刘超,党江波,魏烨昕,等.SCoT分子标记技术初步应用于烟草属部分材料的遗传分析及种间杂种的鉴定[J].中国烟草学报,2013,19(5):107-111.
[24] HUANG L K,HUANG X,YAN H D,et al.Constructing DNA fingerprinting of Hemarthria cultivars using EST-SSR and SCoT markers[J].Genetic resources and crop evolution,2014,61(6):1047-1055.
[25] SATYA P,KARAN M Y,JANA S,et al.Start codon targeted (SCoT) polymorphismreveals genetic diversity in wild and domesticated populations of ramie (Boehmeria nivea L.Gaudich.),a premium textile fiber producing species[J].Meta gene,2015,3:62-70.
[26] 张君玉,郭大龙,龚莹,等.葡萄目标起始密码子多态性反应体系的优化[J].果树学报,2011,28(2):209-214.
[27] 郭大龙,张君玉,李猛,等.葡萄SRAP反应体系优化及引物筛选[J].基因组学与应用生物学,2010,29(2):379-384.
[28] 赵瑞强,高燕会,章晓玲,等.铁皮石斛SCoT-PCR反应体系构建及优化[J].核农学报,2012,26(4):648-655.
[29] 何仁锋,冯尚国,陈喆,等.药用菊花SCoT-PCR 反应体系的正交优化[J].核农学报,2014,28(10):1781-1789.
[30] 韩国辉,龙治坚,范理璋,等.蓝莓SCoT标记分析体系的建立与优化[J].中国农学通报,2014,30(25):136-141.
[31] 李宁,杨涛,杨生保,等.制干辣椒SCoT-PCR体系优化及引物筛选[J].南方农业学报,2015,46(4):544-549.
[32] 苏亚春,凌辉,王恒波,等.甘蔗SCoT-PCR反应体系优化与多态性引物筛选及应用[J].应用与环境生物学报,2012,18(5):810-818.
基金项目 海南省科技专项资助(ZDYF2021XDNY127)。
作者简介 孙秀秀(1993—),女,山东莱西人,助理研究员,硕士,从事热带植物种质资源保护与创新利用研究。*通信作者,研究员,硕士,从事热带植物种质资源保护与创新利用研究。
收稿日期 2023-05-29
