乙氧基血根碱改善血管紧张素Ⅱ诱导的小鼠心肌纤维化的实验研究
2024-05-28魏丽慧沈阿灵
魏丽慧,程 瑛,谢 意,彭 军,沈阿灵,3*
(1.福建中医药大学科技创新与转化中心,福建 福州 350122;2.福建中医药大学中西医结合学院,福建 福州 350122;3.福建省中西医结合老年性疾病重点实验室,福建 福州 350122)
高血压是心血管疾病的主要危险因素。我国有超过3.3 亿人患有高血压,已成为日益严重的公共卫生问题[1-2]。高血压患者因长期压力过载可导致左室肥厚、心肌纤维化等改变,心脏进行性重构,最终出现心力衰竭,严重危害居民身心健康[3]。因此,进一步探究更为有效的高血压防治途径,减缓心脏的损害尤为关键。
乙氧基血根碱(Ethoxysanguinarine,ETH)是血根碱氨化乙醇提取过程的结晶产物。2021 年课题组首次发现乙氧基血根碱具有降低血管紧张素Ⅱ(AngⅡ)诱导的高血压小鼠血压及改善心脏功能的作用[4],但其改善心脏功能的具体作用机制有待深入研究。心肌纤维化是高血压患者心脏损伤的主要病理改变[5],预防心肌纤维化在高血压性心脏病的治疗中至关重要。因此,本研究从心肌纤维化角度探讨了乙氧基血根碱改善AngⅡ诱导的高血压心脏功能障碍的作用及其可能机制。
1 实验材料
1.1实验动物 36只雄性,SPF级,8周龄,C57BL/6小鼠,体质量(28±2) g,由上海斯莱克实验动物有限责任公司提供,动物使用许可证号:SYXK(闽)2019-0007。饲养在SPF 级环境中(温度:22~26 ℃,黑暗/光明各12 h)。本研究方案经福建中医药大学动物伦理委员会批准(审批号:FJTCM IACUC 2022051)。
1.2实验试剂 Masson 染色试剂(货号:G1340)购自北京索莱宝科技有限公司;天狼星红染色试剂(货号:PH1099)购自福州飞净生物科技有限公司;增殖细胞核抗原(PCNA)(货号:ab29)购自英国Abcam 公司;TGF-β1(货号:ABP52598)、GAPDH(货号:ABL1021)购自中国Abbkine Scientific 公司;Ⅰ型胶原(货号:14695-1-AP)、Ⅲ型胶原(货号:22734-1-AP)、纤维连接蛋白(FN)(货号:15613-1-AP)购自美国Proteintech 公司;α-平滑肌肌动蛋白(α-SMA)(货号:40482)、p-smad2(货号:913429)、p-smad3(货号:12838)、smad2(货号:41442)、smad3(货号:41445)购自美国Cell Signaling Technology公司。
1.3实验仪器 电泳仪、转膜仪、化学成像系统购自美国Bio-Rad 公司;普通显微镜、偏光显微镜购自德国Leica 公司;低温高速离心机购自美国Thermo公司。
2 实验方法
2.1分组、造模及给药 雄性C57BL/6 小鼠36 只,适应性喂养1 周后,根据小鼠的基线血压随机分为空白组,模型组,低、中、高剂量组和阳性药组。渗透泵置于生理盐水中,37 ℃培养箱中孵育过夜激活,采用1.5%~2%异氟烷吸入麻醉小鼠,消毒后皮下植入渗透微泵。除空白组外的其余各组小鼠皮下以500 ng/(kg·min)的速率释放AngⅡ,空白组在泵内注入等量生理盐水,持续28 d;低、中、高剂量组从术后第1 天起分别给予0.1、1、10 mg/(kg·d)乙氧基血根碱灌胃,空白组和模型组给予等体积生理盐水,阳性药组给予10 mg/(kg·d)缬沙坦,连续灌胃给药28 d。
2.2观察指标
2.2.1小鼠心脏纤维化 采用Masson 染色评估各组小鼠心脏纤维化的阳性染色情况。28 d 后麻醉处死小鼠。取出心脏,用4%多聚甲醛固定48 h,制作石蜡切片;切片进行脱蜡至蒸馏水中,Weigert 铁苏木素液染5~10 min,冲洗液冲洗30 s;1%盐酸酒精分化8 min,流水冲洗,丽春红酸性复染液染色5 min,流水冲洗,1%磷钼酸水溶液染5~10 min,1%的冰醋酸水溶液处理2 min;梯度乙醇脱水,二甲苯透明,中性树胶封固,显微镜观察小鼠心脏纤维化情况。每张切片随机选取高倍镜下的6 个视野,评估纤维化的阳性染色。
2.2.2小鼠心脏胶原沉积情况 采用天狼星红染色评估各组小鼠心脏胶原沉积情况。心脏组织4 μm切片,常规脱蜡,然后用天狼星红染色1 h,自来水冲洗,苏木精染色8 min,自来水冲洗10 min。采用偏光显微镜400 倍镜下观察拍照。使用Image Pro-Plus 软件,在6 个显微镜视野下评估胶原沉积的区域。
2.2.3Western blot检测Ⅰ型胶原、Ⅲ型胶原、PCNA、α-SMA、FN、TGF-β1、p-smad2/3 及smad2/3 蛋白表达量 取适量心脏组织样本,裂解液裂解,4 ℃高速离心机(14 000 r/min)离心20 min。根据BCA 试剂盒说明书测定蛋白浓度。加入SDS 在100 ℃的金属水浴锅变性。利用SDS-PAGE 胶进行电泳,结束后,将其转移到PVDF 膜上。用牛奶在室温下封闭2 h,4 ℃孵育Ⅰ型胶原、Ⅲ型胶原、PCNA、α-SMA、FN、TGF-β1、p-smad2/3 及smad2/3 一抗过夜。用含0.2% Tween 的TBST 洗涤3 次,每次洗涤10 min,然后加入相应的二抗在室温继续孵育2 h,用TBST洗涤3 次,最后加入ECL 显影剂(A 液∶B 液=1∶1),置于凝胶成像系统中进行成像、扫描。
2.3统计学方法 采用SPSS 23.0 软件分析数据,GraphPad Prism 5 软件进行数据图绘制。在3 组或更多组之间进行差异比较时,当计量资料服从正态分布时用(±s)表示,使用单因素方差分析进行比较,方差齐时使用LSD-t进行事后检验;当方差不齐时使用Games-Howell 进行事后检验;当计量资料不服从正态分布时用[M(P25,P75)]表示,采用非参数Kruskal-Wallis 检验用于比较数据的组间差异。P<0.05 为差异有统计学意义。
3 结 果
3.16组小鼠心脏组织心肌纤维化程度及胶原沉积情况比较 与空白组比较,模型组小鼠心肌间质和血管周围出现明显纤维化及胶原沉积(P<0.05);与模型组比较,低、中、高剂量组及阳性药组心肌间质和血管周围纤维化及胶原沉积程度显著减少,且作用呈剂量依赖性(P<0.05)。图1、表1、图2、表2。
表1 6 组小鼠心肌纤维化程度比较(±s)

表1 6 组小鼠心肌纤维化程度比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.05。
?
表2 6 组小鼠心肌胶原沉积程度比较(±s)
表2 6 组小鼠心肌胶原沉积程度比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.05。
?
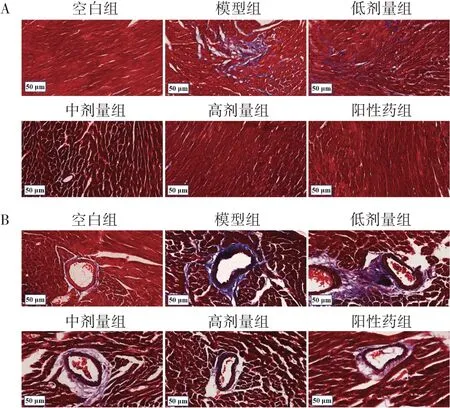
图1 6 组小鼠心肌间质及血管周围心肌纤维化情况(Masson 染色,×400)
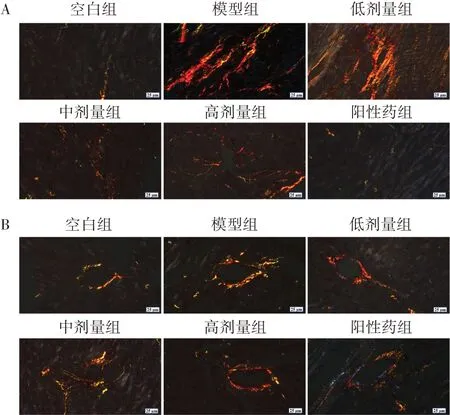
图2 6 组小鼠心肌间质及血管周围心肌胶原沉积情况(天狼星红染色,×400)
3.26 组小鼠心脏组织中Ⅰ型、Ⅲ型胶原蛋白表达情况 与空白组比较,模型组小鼠心脏组织中Ⅰ型、Ⅲ型胶原的蛋白表达均显著增加(P<0.05);与模型组比较,低中高剂量及阳性药组心脏组织中Ⅰ型、Ⅲ型胶原的蛋白表达均显著减少(P<0.05)。见图3、表3。
表3 6 组小鼠心脏组织中Ⅰ型、Ⅲ型胶原蛋白表达量比较(±s)

表3 6 组小鼠心脏组织中Ⅰ型、Ⅲ型胶原蛋白表达量比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.05。
?
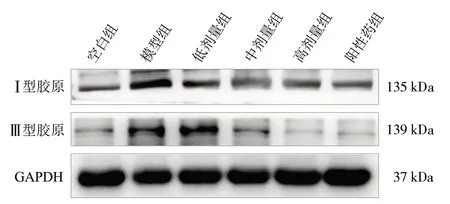
图3 6 组小鼠心脏组织中Ⅰ型胶原及Ⅲ型胶原蛋白条带图
3.3小鼠心脏组织中PCNA 蛋白表达情况 与空白组比较,模型组心脏组织中PCNA 的表达显著增加(P<0.05);与模型组比较,低、中、高剂量及阳性药组心脏组织中PCNA 的表达均明显减弱(P<0.05),表明乙氧基血根碱处理显著抑制AngⅡ诱导的心肌成纤维细胞的增加。见图4、表4。
表4 6 组小鼠心脏组织PCNA 蛋白表达量比较(±s)

表4 6 组小鼠心脏组织PCNA 蛋白表达量比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05。
?

图4 6 组小鼠心脏组织PCNA 蛋白条带图
3.46 组小鼠心肌成纤维细胞α-SMA、FN 蛋白表达情况 与空白组比较,模型组心脏组织中α-SMA及FN 蛋白的表达增加(P<0.05);与模型组比较,低、中、高剂量组及阳性药组心脏组织中α-SMA 及FN的蛋白表达均显著减少(P<0.05)。见图5、表5。
表5 6 组小鼠心脏组织α-SMA 及FN 蛋白表达量比较(±s)

表5 6 组小鼠心脏组织α-SMA 及FN 蛋白表达量比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.05。
?

图5 6 组小鼠心脏组织α-SMA、FN 蛋白条带图
3.56 组小鼠心脏组织TGF-β1、p-smad2/3 及smad2/3 蛋白表达情况 与空白组比较,模型组小鼠心脏组织中TGF-β1 的蛋白表达、p-smad2/smad2 比值及p-smad3/smad3 比值显著增加(P<0.05);与模型组比较,低、中、高剂量组及阳性药组心脏组织中TGF-β1 的表达、p-smad2/smad2 比值及p-smad3/smad3 比值均显著下降(P<0.05)。见图6、表6。
表6 6 组小鼠心脏组织TGF-β1 蛋白表达量、p-smad2/smad2 比值和p-smad3/smad3 比值比较(±s)
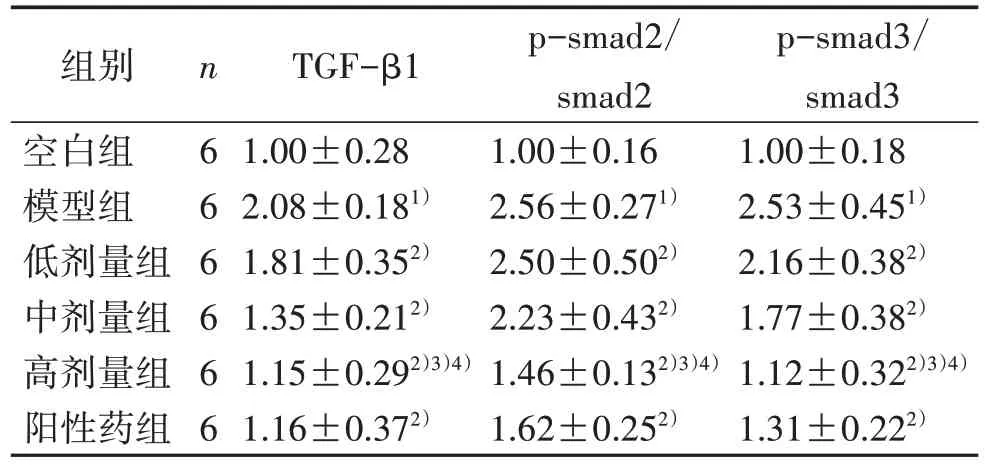
表6 6 组小鼠心脏组织TGF-β1 蛋白表达量、p-smad2/smad2 比值和p-smad3/smad3 比值比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.05。
?
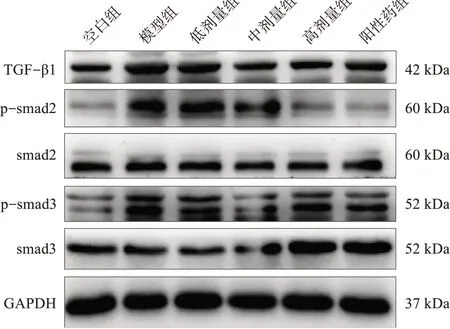
图6 6 组小鼠心脏组织中TGF-β1、p-smad2/3 及smad2/3 蛋白条带图
4 讨 论
高血压性心脏病是高血压最常见的并发症之一,最终可引起心力衰竭导致患者死亡。本课题组在前期抗高血压新药及机制研究过程中发现,降压新成分乙氧基血根碱具有显著降低AngⅡ诱导的高血压小鼠血压及改善心脏功能的作用[4]。研究表明心肌纤维化是高血压患者心脏损伤的主要病理改变[5],表现为正常心脏组织中出现胶原的过度沉积、排列紊乱、比例失调,心脏纤维化不仅加重心肌缺血缺氧,而且心室顺应性下降,经过一系列的变化最终导致心室腔逐渐扩大,心室收缩和舒张功能均严重受损,进而出现心力衰竭[5-8]。故预防心肌纤维化在高血压性心脏病的治疗中至关重要。
RAAS 的激活是心肌纤维化的主要原因,AngⅡ在这一过程中起着重要的调控作用[9-10]。AngⅡ可通过激活血管紧张素Ⅰ型受体,刺激心肌成纤维细胞的增殖和细胞外基质(ECM)蛋白的表达,引起心肌纤维化[10]。因此,它可加速高血压心力衰竭[10-12]。为此,本研究观察乙氧基血根碱对AngⅡ诱导的高血压小鼠心肌纤维化的影响。首先观察乙氧基血根碱对心肌纤维化及胶原沉积情况的影响,结果表明乙氧基血根碱治疗可以显著降低高血压小鼠的心肌纤维化及胶原蛋白的堆积,并显著下调心脏组织中Ⅰ型、Ⅲ胶原蛋白表达。
生理情况下,心脏受到外界损伤刺激时,心肌成纤维细胞向肌成纤维细胞转化,肌成纤维细胞增殖并向损伤部位迁移,合成胶原,修复损伤的心肌组织。病理状态下,如AngⅡ等细胞因子作用于心肌成纤维细胞,心肌成纤维细胞被过度激活,向肌成纤维细胞转化,并大量增殖分泌胶原蛋白,这些胶原蛋白在损伤部位累积,在初始阶段时起到维持心脏结构和功能的作用,但随着心脏纤维化程度的加重,最后出现心力衰竭。为此,本项目还观察了心肌成纤维细胞增殖及心肌成纤维细胞向肌成纤维细胞转化的标记物PCNA 及α-SMA 蛋白表达。结果显示,AngⅡ诱导的高血压小鼠心肌,PCNA 及α-SMA 蛋白表达显著升高,经乙氧基血根碱治疗后PCNA 及α-SMA 蛋白表达显著下调。可见乙氧基血根碱可能是通过减轻心肌成纤维细胞向肌成纤维细胞转化增殖这一过程,发挥改善高血压导致心脏损伤。
研究表明TGF-β1/smad2/3 通路在多种心肌纤维化模型中被激活[13-14]。TGF-β1 通过激活smad2和smad3 磷酸化,并将其信号传递至细胞核内,影响多种促纤维化过程的关键介质,促进组织纤维化。本研究发现在AngⅡ刺激后,心脏组织中TGFβ1 蛋白表达升高,p-smad2/smad2 比值及p-smad3/smad3 比值增加,乙氧基血根碱治疗可降低AngⅡ诱导的心脏组织中TGF-β1 的蛋白表达及p-smad2/smad2 和p-smad3/smad3 的比值。
综上,本研究证实乙氧基血根碱可显著减轻AngⅡ诱导的高血压心肌纤维化,可能是通过调控TGF-β1/smad2/3 通路抑制心肌成纤维细胞的分化。
