失代偿期肝硬化患者营养状况及免疫功能的临床观察*
2024-05-25罗雪清黄美金
叶 婷,罗雪清,黄美金
(右江民族医学院附属医院:1.营养科;2.超声科3.感染性疾病科,广西百色 533000)
肝硬化患者普遍存在营养不良,而失代偿期肝硬化患者营养不良的发生率则更高,达44.1%[1]。营养不良与肝硬化的病情进展及预后密切相关[2],是肝硬化患者预后不良的独立预测因素。而有研究发现,大部分肝硬化患者都会出现细胞免疫功能下降,免疫功能与肝硬化的发生、演变及进展关系密切[3]。本研究采用营养风险筛查 2002(nutritional risk screening 2002,NRS2002)评分对失代偿期肝硬化患者进行营养风险筛查,评估其营养风险,分析其营养状况及免疫功能,为失代偿期肝硬化患者的下一步营养干预提供参考。
1 资料与方法
1.1 一般资料
选取 2020年1月至2022年6月在本院住院的失代偿期肝硬化患者132 例作为研究对象。纳入标准:患者失代偿期肝硬化的诊断符合2020年版《肝硬化诊治指南》[4]。排除标准:(1)神志不清、不能站立,不能测量身高、体重等指标的患者;(2)肝性脑病、肝衰竭患者;(3)3个月内输注人血白蛋白及血浆的患者;(4)合并恶性肿瘤、心肾功能不全的患者;(5)合并内分泌及代谢疾病者。病因:乙型病毒性肝炎91例,丙型病毒性肝炎22例,酒精性肝炎19例。本研究方案获得本院伦理委员批准(审批号:YYFY-LL2024-226),所有研究对象均知情同意。
1.2 方法
1.2.1测量身体数据
测量患者的身高(m)、体重(kg),根据身高、体重计算BMI。其中BMI 18.5~<24.0 kg/m2为正常,<18.5 kg/m2为消瘦,24.0~<28.0 kg/m2为超重,BMI≥28.0 kg/m2为肥胖,以上测量均在早晨起床排空二便后,赤足进行测量;测量患者肱三头肌皮皱厚度(TSF)、上臂围(AC)、上臂肌围(AMC)。TSF的测量方法:在患者的右侧上臂肩峰至尺骨鹰嘴窝中点处提起患者皮肤和皮下组织,于其下约1.5 cm处用皮褶厚度仪测量皮褶厚度,测量3次,取平均值。AC的测量方法:用皮尺在上臂中点测量3次,取平均值。AMC的计算方式为AMC=AC(cm)-3.14×TSF(cm)。以上评估和测量均由经过培训的医护人员在患者入院后24 h内完成。
1.2.2营养风险评估及分组
采用欧洲肠外肠内营养学会推荐的NRS2002评分[5]评估患者营养风险,NRS2002评分由疾病严重程度评分、营养状况受损评分及年龄评分3项评分的总和组成。NRS2002评分为0~7分,其中≥3分为有营养风险、<3分为无营养风险。NRS2002评分≥3分的患者再分别根据NRS2002评分3~<5分和5~7分分成低营养风险和高营养风险两个亚组。132 例研究对象中,高营养风险组19例,男16例,女3例,年龄21~72岁,平均(46.58±17.63)岁;低营养风险组53例,男48例,女5例,年龄19~69岁,平均(51.57±9.43)岁;无营养风险组60例,男51例,女9例,年龄19~69岁,平均(50.23±11.76)岁;3组患者性别、年龄比较差异无统计学意义(P>0.05)。
1.3 收集指标
入院后次日早上6:00点抽空腹静脉血送检。采用希森美康se500全自动血球分析仪(日本希森美康株式会社)检测血红蛋白(Hb);cobas c702全自动生化分析仪(德国Roche公司)检测清蛋白(ALB)、前清蛋白(PA)、视黄醇结合蛋白(RBP)、总胆红素(TBIL)、胆固醇(TC)、甘油三酯(TG)、IgG、IgA、IgM。希森美康cs5100凝血仪(日本希森美康株式会社)检测凝血酶原时间(PT);采用BD FACSCantoTMⅡ全自动流式细胞仪[美国BD公司,试剂管为碧迪医疗器械(上海)有限公司产品]分析CD4+T细胞百分比、CD8+T细胞百分比、CD4+T细胞百分比与CD8+T细胞百分比的比值(CD4+T/CD8+T)。根据患者ALB、TBIL、PT、腹水及肝性脑病的情况评估肝功能 Child-Pugh 分级。记录患者临床并发症发生率(包括消化道出血、腹水、肝肾综合征、肝性脑病、自发性腹膜炎)。
1.4 统计学处理

2 结 果
2.1 3组人体基础指标比较
各营养风险组的人体基础指标BMI、TSF、AMC比较,差异有统计学意义(P<0.05)。高营养风险组的BMI、TSF、AMC低于低营养风险组和无营养风险组,低营养风险组的BMI、TSF、AMC低于无营养风险组,组间两两比较差异有统计学意义(P<0.05),见表1。

表1 3组人体基础指标比较
2.2 3组营养指标比较
各营养风险组的实验室营养指标Hb、ALB、PA、RBP、TG比较,差异有统计学意义(P<0.05)。高营养风险组和低营养风险组Hb、ALB、PA、RBP、TG均低于无营养风险组,高营养风险组的ALB、TG低于低营养风险组,组间两两比较差异有统计学意义(P<0.05),见表2。

表2 3组营养指标比较
2.3 3组免疫指标比较
各营养组的免疫指标IgG、IgA、CD4+T细胞百分比、CD4+T/CD8+T比较,差异有统计学意义(P<0.001)。高营养风险组和低营养风险组的免疫指标IgG、IgA高于无营养风险组,差异有统计学意义(P<0.05);高营养风险组和低营养风险组的CD4+T细胞百分比、CD4+T/CD8+T均低于无营养风险组,组间两两比较差异有统计学意义(P<0.05),见表3。

表3 3组体液免疫和细胞免疫指标比较
2.4 3组Child-Pugh分级情况比较
各营养风险组Child-Pugh分级构成比比较差异有统计学意义(χ2=85.374,P<0.001)。高营养风险组的Child-Pugh B级、C级患者比例高于无营养风险组,低营养风险组患者比例高于无营养风险组,组间两两比较差异有统计学意义(P<0.05);高营养风险组、低营养风险组的Child-Pugh A级患者比例低于无营养风险组,组间两两比较差异有统计学意义(P<0.05),见表4。

表4 3组Child-Pugh分级情况的比较[n(%)]
2.5 3组临床并发症发生率比较
各营养风险组并发症消化道出血、腹水、肝肾综合征、肝性脑病、自发性腹膜炎发生率比较,差异有统计学意义(P<0.05)。高营养风险组消化道出血、腹水、肝肾综合征、肝性脑病、自发性腹膜炎发生率高于无营养风险组,低营养风险组消化道出血、腹水、肝肾综合征发生率高于无营养风险组,组间两两比较差异有统计学意义(P<0.05),见表5。
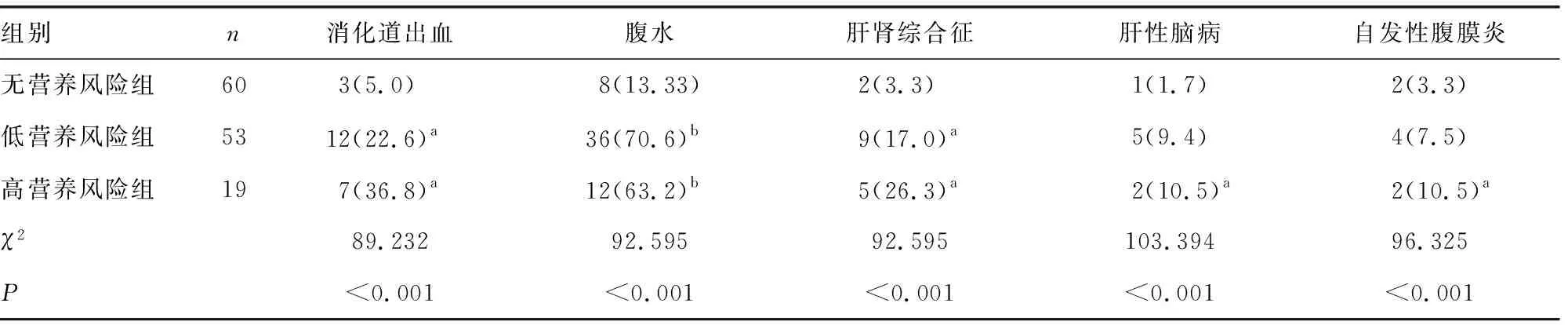
表5 3组临床并发症发生率比较[n(%)]
2.6 NRS2002评分与营养指标和免疫指标的相关性分析
NRS2002评分与BMI、TSF、AMC、Hb、ALB、PA、RBP、TC、TG、CD4+T细胞百分比、CD4+T/CD8+T呈负相关(P<0.001),与IgG、IgA、IgM呈正相关(P<0.001);与CD8+T细胞百分比无关,见表6。

表6 NRS2002评分与人体基础指标营养指标和免疫指标的相关性分析
2.7 失代偿期肝硬化NRS2002评分与人体基础指标、营养指标、免疫指标的多元回归分析
以NRS2002评分为因变量,以BMI、TSF、AMC、Hb、ALB、PA、RBP、TC、TG、IgG、IgA、IgM、CD4+T细胞百分比、CD8+T细胞百分比、CD4+T/CD8+T为自变量,进行多元逐步回归分析。结果发现TSF、AMC、Hb、ALB、RBP与NRS2002评分存在线性回归关系,见表7。

表7 失代偿期肝硬化NRS2002评分与人体基础指标、营养指标、免疫指标的多元逐步回归分析
3 讨 论
蛋白-能量营养不良(PEM)是肝硬化的一个关键特征,营养不良可以预测肝硬化的严重程度,是影响患者生存的关键因素[6]。营养不良也可被视为肝硬化的并发症,因为它对疾病进展和结局有负面影响。营养不良可导致肝硬化患者生活质量降低,腹水和自发性腹膜炎等并发症的发生率增大,是患者不良临床结局的重要预测指标[7]。有研究表明,随着肝硬化的进展,患者细胞免疫功能明显降低,易被病毒、细菌侵染[8],与肝硬化失代偿期自发性腹膜炎、内毒素血症及菌血症的发生密切相关。因此,对失代偿期肝硬化患者进行准确的营养评价,尽早发现营养风险及营养不良,早期给予合理的营养支持治疗对改善临床结局具有非常重要的临床意义。
NRS2002评分是一种用于评估住院患者营养风险的有效工具[9],在肝硬化患者中亦能灵敏地反映患者的营养风险[10]。有报道显示,68.42%的肝硬化患者存在营养风险[11]。BMI可用于判断营养不良及其程度,还可用于动态监测患者营养状态变化,是临床判断营养状况的基础指标之一[12],但由于大多数失代偿期肝硬化患者存在水钠潴留,有腹水和下肢水肿的症状和体征,因此,测量所得的BMI往往要比实际偏高。研究发现,随着营养不良风险的增高及营养不良严重程度的增加,BMI水平明显下降[12]。而TSF、AMC 因不受水钠潴留的影响,是适合所有肝硬化患者的营养评价指标。患者的脂肪贮备情况主要用TSF评价,AMC则用于评价肝硬化患者的总体蛋白水平,两者综合在一起,能较好地评估患者体内皮下脂肪和蛋白储存,以及消耗程度[13]。由于TSF不受水钠潴留的影响,是人体测量数据中最有效的参数,与肝硬化严重程度呈正相关,与肝硬化的病死率也相关[14]。陈向东等[15]研究发现,有营养风险的肝硬化患者的BMI、TSF、AMC低于无营养风险的患者。本研究中高营养风险组的人体基础指标BMI、TSF、AMC低于低营养风险组和无营养风险组,低营养风险组BMI、TSF、AMC低于无营养风险组,组间两两比较差异有统计学意义(P<0.05),NRS2002评分与BMI、TSF、AMC呈负相关(P<0.001)。
肝硬化患者存在营养摄入不足和吸收不良等情况,而消化道出血、腹水、电解质紊乱等并发症进一步加重了肝硬化患者的营养不良。肝硬化贫血的主要原因是缺铁,贫血与肝硬化的临床表现和肝功能异常存在密切的关系[16]。由于失代偿期肝硬化患者食欲下降、消化吸收功能障碍,肝细胞坏死导致蛋白合成不足是ALB、PA、RBP等血清蛋白水平降低的主要原因。因此,ALB、PA、RBP不仅是反映机体蛋白营养不良的可靠指标,而且是反映肝功能的重要指标[17]。指标半衰期越短,对评估患者的营养状况和判断营养支持的疗效越有价值。三者的半衰期分别为21 d、1.9 d、12 h,故PA、RBP是反映失代偿期肝硬化患者早期蛋白营养不良的敏感指标[18]。郑健荪等[19]研究表明,RBP、TC、TG等指标可有效评估肝功能损伤的情况,与Child-Pugh分级密切相关。TC、TG下降对判断乙型病毒性肝炎肝硬化患者病情严重程度具有重要作用[20]。高营养风险肝硬化患者肝功能储备功能差,因此肝功能 Child-Pugh 分级高及营养不良的比例也高[21]。本研究高营养风险组和低营养风险组的营养指标Hb、ALB、PA、RBP、TG均低于无营养风险组,高营养风险组ALB、TG低于低营养风险组,组间两两比较差异有统计学意义(P<0.05);高营养风险组的Child-Pugh B级、C级患者比例高于无营养风险组,低营养风险组患者比例高于无营养风险组,组间两两比较差异有统计学意义(P<0.05),与相关研究结果一致。NRS2002评分与Hb、ALB、PA、RBP、TC、TG呈负相关(P<0.05)。高营养风险组的消化道出血、腹水、肝肾综合征、肝性脑病、自发性腹膜炎发生率高于无营养风险组,低营养风险组消化道出血、腹水、肝肾综合征发生率高于无营养风险组,差异有统计学意义(P<0.05)。多元线性回归提示,Hb、TSF、AMC、ALB、RBP与NRS2002评分存在线性回归关系。
免疫球蛋白主要由浆细胞合成,具有较强抗体活性,可诱发抗体形成,使补体活性增强,起到免疫效应。IgG、IgA和IgM 是人体中重要的免疫球蛋白,三者均能反映肝损伤的情况。金宇等[22]发现免疫球蛋白与肝硬化进程有关,肝硬化程度越严重,免疫球蛋白水平越高。张静等[23]研究发现,血清IgG、IgM、IgA异常高表达与失代偿期肝硬化患者预后不良存在密切联系,三者联合检测可增强预测患者预后的能力。张锐[24]发现,血清IgG、IgM、IgA可作为临床诊断肝硬化的指标,对判断肝功能受损程度,评估疾病的预后有重要价值。本研究高营养风险组和低营养风险组的免疫指标IgG、IgA高于无营养风险组,组间两两比较差异有统计学意义(P<0.05)。NRS2002评分与IgG、IgA、IgM呈负相关(P<0.05)。
细胞免疫在肝硬化进程中起着重要的作用。慢性肝炎进展至肝硬化与细胞免疫功能有密切的关系。刘欣等[25]认为,T细胞亚群比例可在一定程度上反映肝硬化患者门静脉高压病情发展情况。李欣等[8]认为,随着肝硬化病程的进展,患者细胞免疫功能加速减退,Child-Pugh C级的患者CD4+T细胞百分率、CD4+T/CD8+T较A、B级明显减少。提示Child-Pugh C级肝硬化患者机体更新CD4+T细胞的能力降低,患者细胞免疫功能明显降低,导致患者易被病毒、致病菌感染,这与肝硬化失代偿期自发性腹膜炎的发生密切相关。本研究高营养风险组和低营养风险组CD4+T细胞百分比、CD4+T/CD8+T均低于无营养风险组,组间两两比较差异有统计学意义(P<0.05),NRS2002评分与CD4+T细胞百分比、CD4+T/CD8+T呈负相关(P<0.05)。
综上所述,高营养风险失代偿期肝硬化患者的营养状况及免疫功能均较低营养风险者差。NRS2002评分简单易于实施,因此,在失代偿期肝硬化患者的诊治中尽早地进行NRS2002评分评估,筛选出高营养风险患者并及时进行营养干预是非常有必要的。
