重症脑出血病人发生急性肾损伤的列线图模型建立与验证
2024-05-25贺剑绗,李仁,郭庚
贺剑绗,李仁,郭庚
摘要目的:建立重症脑出血病人发生急性肾损伤的交互式、动态列线图模型,并验证模型效能。方法:纳入美国重症监护医学信息数据库中997例诊断为脑出血的病人,通过LASSO回归筛选影响因素,建立列线图模型,在训练集和验证集中与传统重症评分模型比较,综合评价列线图的区分度、准确性和临床适用性。结果:训练集中443例(61.86%)病人发生急性肾损伤,LASSO回归筛选出影响因素包括年龄、体重、心率、血肌酐、有创通气、血管导管、心力衰竭、白蛋白及万古霉素药物使用和格拉斯哥昏迷量表(GCS)评分,以此为基础建立列线图模型,受试者工作特征曲线显示曲线下面积在训练集中为0.78,在验证集中为0.80,校准曲线评价显示预测的急性肾损伤发生率与实际的发生率具有较好的一致性,决策曲线表明模型具有一定的临床效益。结论:该列线图模型可以在一定程度上预测重症脑出血病人发生急性肾损伤的风险,有助于神经重症医生识别高风险病人,并为早期预防急性肾损伤的发生和个体化治疗提供研究依据。
关键词脑出血;急性肾损伤;神经重症;列线图模型
doi:10.12102/j.issn.1672-1349.2024.08.032
中风在全球范围内是仅次于缺血性心脏病的中老年人第二大死因,也是致残的主要原因,其中脑出血(intracerebral hemorrhage,ICH)约占所有中风病例的27.9%[1]。急性肾损伤(acute kidney injury,AKI)是中风后常见的并发症,与中风病人的高死亡率和致残率相关[2]。有研究报道,住院期间发生AKI与重症ICH病人死亡率升高、住院时间延长、慢性肾脏疾病发生和心血管疾病复发风险增加相关[3-6]。因AKI定义标准的不同、研究人群的差异,既往报道危重ICH病人AKI的发生率存在差异;部分医疗中心报告重症监护室(intensive care unit,ICU)病人AKI患病率为32.0%~57.3%[7-9]。
脑-肾器官交互机制复杂,ICH引起的脑损伤可能通过激活与交感系统相关的神经内分泌途径如肾素-血管紧张素系统和炎症途径,影响肾脏的自我调节,加重肾脏炎症,导致内皮功能紊乱,损伤肾脏微循环和肾小管,最终发生AKI[10-11]。另一方面,重症AKI病人可能由于血液中的神经毒性代谢物穿过血脑屏障,导致发生脑水肿、癫痫,甚至死亡[12]。因此,早期筛选出高风险病人,并防止肾脏功能损伤的进展显得尤为重要。本研究旨在建立并验证预测重症ICH病人住院期间发生AKI风险的列线图模型,为早期预防AKI的发生和个体化的临床决策提供参考。
1资料与方法
1.1数据来源
美国重症监护医学信息 (Medical Information Mart for Intensive Care Ⅳ,MIMIC-Ⅳ) 数据库是一个大型公开免费的综合性重症数据库,该数据库由贝斯以色列女执事医疗中心(Beth Israel Deaconess Medical Center,BIDMC)和麻省理工学院合作建立,纳入了2008—2019年在BIDMC住院的数万名成年重症病人。完成“保护人类受试者”的在线培训(编号51144778),并签署数据使用协议后允许访问数据库。本回顾性研究没有影响纳入病人的治疗方案且所有数据均去标识化处理,因此,由BIDMC审查委员会授予豁免个体病人知情同意。
1.2研究设计
回顾性纳入国际疾病统计分类(The International Statistical Classification of Diseases Code,ICD)第9版診断代码为“431”的重症ICH病人进行研究。为避免数据收集和处理过程中出现混淆,对于多次入院病人,只保留首次入院诊断ICH病人的信息。排除标准:ICU停留时间<24 h;入院前已有严重的肾脏疾病如诊断终末期肾脏病(end-stage renal disease,ESRD)或入院24 h内接受肾脏替代治疗(renal replacement therapy,RRT),由于数据库中没有RRT的直接记录,使用中的透析导管或透析相关的记录被视为接受RRT。AKI诊断参照全球肾脏疾病改善组织(The Kidney Disease Improving Global Outcome,KDIGO)的诊断标准,符合以下情况之一者诊断为AKI:48 h内血肌酐(serum creatinine,Scr)升高超过0.3 mg/dL(1 mg/dL=88.4 μmol/L);7 d内Scr升高超过基线1.5倍;持续6 h尿量<0.5 mL/ (kg·h)。纳入研究的病人以7∶3的比例随机分组为训练集和验证集。
1.3数据收集
使用结构化查询语言从MIMIC-Ⅳ数据库中提取病人基线特征,包括人口统计学特征、生命体征、实验室检查、合并症、医疗操作、使用药物和格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)评分。人口统计学特征包括性别、种族、年龄和体重;入ICU 24 h内生命体征包括心率、呼吸频率、体温、收缩压、舒张压、平均动脉压、动脉血氧饱和度和血糖;24 h内实验室指标包括:红细胞比容、血红蛋白、血小板计数、白细胞计数、阴离子间隙、碳酸氢根离子、Scr、血钙、血氯、血钠、血钾、凝血酶原国际标准化比值、凝血酶原时间和部分凝血酶原时间;临床合并症根据ICD-9或ICD-10的诊断代码提取包括:冠状动脉粥样硬化性心脏病、心力衰竭、高血压、癫痫、脑水肿和蛛网膜下腔出血;医疗操作包括:数字减影血管造影(digital subtraction angiography,DSA)、有创通气和置入血管导管;使用药物包括:白蛋白、血管紧张素转换酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)、他汀类药物、万古霉素、甘露醇、尼莫地平和血管活性药物。
1.4统计学处理
采用Shapiro-Wilk检验和直方图来评估连续变量是否呈正态分布,符合正态分布的定量资料组间比较,以均数±标准差(x±s)表示,使用t检验,偏态分布的定量资料两组间比较以中位数、四分位数[M(P25,P75)]表示,使用非参数检验;定性资料两组间比较使用χ2 检验,以例数、百分数(%)表示。通过LASSO回归筛选AKI发生的影响因素,基于筛选出的因素建立重症ICH病人住院期间发生AKI的列线图模型;使用受试者工作特征(receiver operating characteristic,ROC)曲线和决策曲线(decision curve analyas,DCA)评估列线图模型与传统的重症评分模型的区分度和临床适用性,使用校准曲线评估模型在训练集和验证集中的准确性。通过Stata 16.0和R 4.2.1软件进行数据处理和统计分析,统计学检验结果采用双侧检验,以 P<0.05为差异有统计学意义。
2结果
2.1训练集病人临床资料
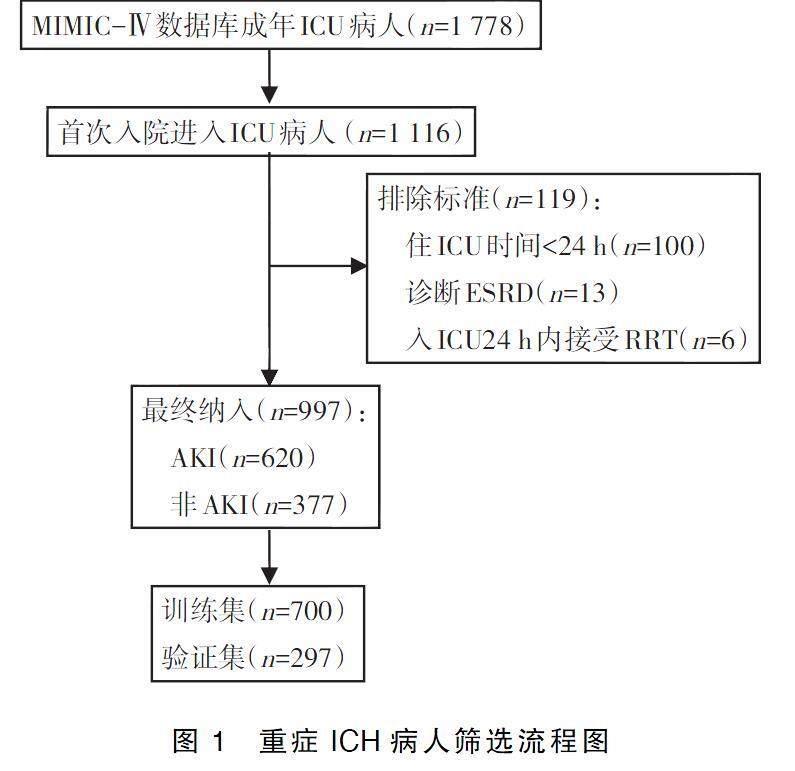
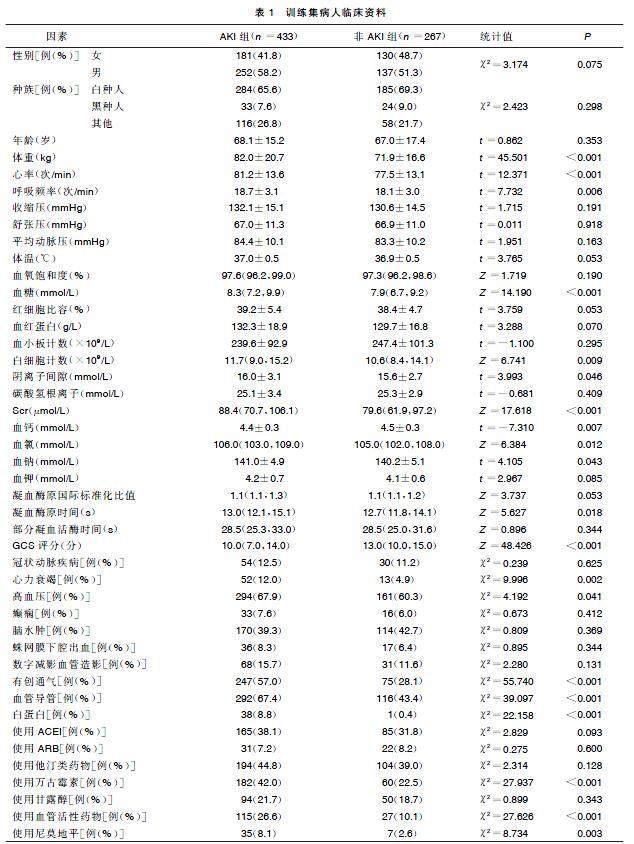
MIMIC-Ⅳ数据库共包含1 778例重症ICH病人,根据排除标准筛选后,997例病人纳入研究,其中包括620例AKI病人和377例非AKI病人,随机分为训练集(700例)和验证集(297例),重症ICH病人筛选流程见图1。训练集中重症ICH病人住院期间AKI的发生率为61.86%,年龄(68.1±15.2)岁。入院24 h内记录数据,体重、心率、呼吸频率、血糖、白细胞计数、阴离子间隙、血钠、凝血酶原时间和Scr均高于非AKI组;同时合并症心力衰竭和高血压的患病率也更高。在医疗操作和药物治疗方面,AKI组具有高有创通气、置入血管导管的干预率,接受白蛋白、使用万古霉素、血管活性药物和尼莫地平等药物治疗的比例也更高,而非AKI组血钙和GCS评分更高。详见表1。
2.2变量筛选与列线图模型构建
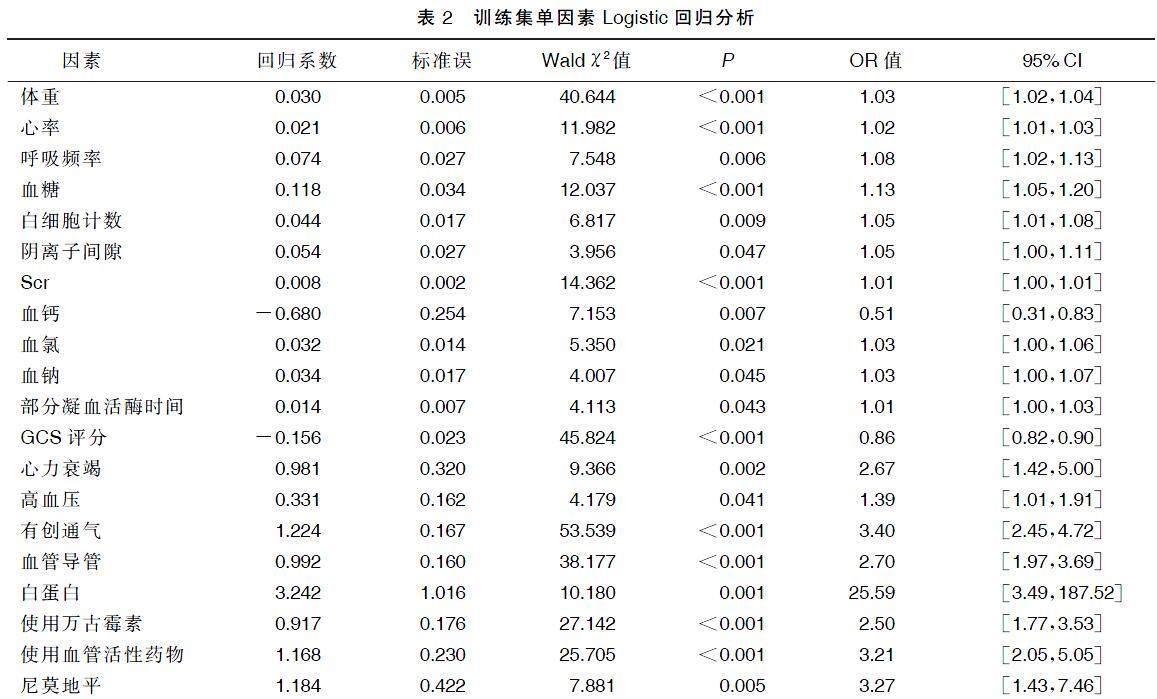
单因素Logistic回归分析显示,体重、心率、呼吸频率、血糖、白细胞计数、阴离子间隙、Scr、血钙、血氯、血钠、部分凝血活酶时间、GCS评分、心力衰竭、高血压、有创通气、血管导管以及白蛋白及使用万古霉素、血管活性药物和尼莫地平等药物治疗是重症ICH病人发生AKI的影响因素(P<0.05)。详见表2。为避免过度拟合,使用LASSO回归在训练集40余个临床因素中筛选重症ICH发生AKI的潜在影响因素(见图2),通过10倍交叉验证确定LASSO回归的调整参数(λ)。考虑到纳入影响因素数量,与最小偏差λ1个标准误(1-s)的λ被认定为最优值,对应影响因素包括年龄、体重、心率、Scr、有创通气、血管导管、心力衰竭、GCS评分、白蛋白和使用万古霉素药物治疗。为可视化预测模型并便于其临床应用,基于以上影响因素构建了交互式列线图与动态列线图,可以通过访问https://hehe666.shinyapps.io/ICH_AKI/,获取在线动态列线图(见图3)进行风险预测。在图3中提供了交互式列线图示例,病人84.2岁,体重67.5 kg,入院第1天平均心率为72.3次/min,入院24 h内Scr最高达97.2 μmol/L,行有创通气、置入血管导管和接受万古霉素治疗,进入ICU时GCS评分为6分,最终列线图模型总得分300分,该病人发生AKI的风险为0.811。
2.3列线图模型验证
列线图模型、序贯器官衰竭评分(Sequential Organ Failure Assessment,SOFA)、Logistic器官功能障碍评分(Logistic Organ Dysfunction System,LODS)和简化急性生理学评分Ⅱ(Simplified Acute Physiology Score Ⅱ,SAPSⅡ)分别在训练集和验证集中建立ROC曲线(见图4),列线图模型在训练集中ROC曲线下面积(the area under the ROC curve,AUC)为0.78,在验证集中AUC为0.80,AUC最高,表明与SOFA、LODS和SAPSⅡ等模型相比列线图模型具有更好的区分度(P<0.05)。校准曲线中训练集与验证集的预测曲线接近标准理想线(见图5);Hosmer-Lemeshow检验结果显示训练集和验证集的P值分别为0.473和0.491,预测结果与实际结果具有较好一致性,模型准确性高。DCA曲线显示(见图6),列线图模型与其他3个评分模型相比,概率阈值在30%~100%具有更高的临床净获益,这表明列线图是指导临床决策的有效工具。
3讨论
MIMIC-Ⅳ数据库中重症ICH病人住院期间AKI发生率高于60%,这可能是由于该数据库提供了更符合KDIGO诊断标准的详细尿量记录和Scr结果。有研究认为较高的基线Scr和尼卡地平的大剂量强化降压治疗以及入院时的严重高血压状态与AKI相关[13]。Zhang等[14]研究发现,年龄、ACEI、ARB、肾毒性抗生素、糖尿病、冠状动脉疾病和高血压是重症ICH发生AKI的独立危险因素。印度一项单中心回顾性研究认为男性、高血压、较低GCS评分的重症ICH病人更容易发生AKI[15]。但之前的研究并未建立预测AKI风险的模型,本研究通过LASSO回归筛选出年龄、体重、心率、Scr、有创通气、血管导管、合并心力衰竭、白蛋白及万古霉素药物使用和GCS评分10个预测因素,并建立了一个动态交互式列线图模型。
SOFA、LODS和SAPSⅡ评分在临床上被广泛用于评估疾病严重程度、器官功能障碍和病人预后。训练集和验证集中列线图模型与重症评分模型比较结果显示,SAPSⅡ的区分能力最差,且临床适用性有限,这可能与SAPSⅡ主要用于评估疾病的严重程度和病人预后相关。本研究中列线图模型通過对神经系统、呼吸系统、循环系统和肾脏系统等多个系统的评估实现对AKI的较全面预测,将AKI视为一种综合性全身疾病,而非仅关注肾功能异常。因此,与SOFA和LODS评分模型相比,列线图具有更高的区分度和临床适用性。
本研究發现有创通气、心力衰竭、体重和使用白蛋白是预测AKI的重要因素,这与之前的研究报道一致。有创机械通气的病人更可能出现氧气供需失衡及缺氧,引起一系列细胞功能紊乱,包括线粒体功能障碍和乳酸产生等,影响肾微循环血流和肾功能的代偿机制,最终导致AKI[16];AKI也与机械通气时间延长、脱离呼吸机困难以及出现呼吸衰竭相关[17]。心力衰竭的病人由于心排血量降低、循环淤血或利尿药物的使用导致循环血流异常,较容易发生AKI;另一方面,AKI可导致肾小管钠的处理能力受损和尿量减少,从而增加循环血容量并加重心力衰竭[18-19]。高体重或肥胖的病人由于肾脏的组织学变化,如肾小球或肾小管的肥大、局灶性肾小球硬化或内分泌相关的疾病,更容易发生AKI[20-22]。此外,文献报道肥胖与机械通气时间增加和住院时间延长相关[23],这也可能增加AKI的发生风险。部分研究认为低白蛋白血症是发生AKI以及AKI相关死亡的危险因素[24-25],这可能是由于白蛋白介导的维持灌注、保护肾小管功能和结合肾毒素等肾脏保护作用丧失所致[26],静脉输注人血清白蛋白是否会加重肾脏负担,从而直接增加AKI的风险,或仅作为低蛋白血症的标志,需要进一步研究。本研究发现是否行数字减影血管造影(DSA)检查并不影响重症ICH病人AKI的发生率,这可能表明造影剂诱发重症ICH病人AKI的发生率较低,这与多项研究结果一致[15,27-28]。基于这一观点,部分研究者认为考虑到DSA对ICH的诊断价值,造影剂诱发AKI风险的担忧不应成为取消DSA的理由[29]。需要进一步研究讨论不同浓度、剂量及渗透压的造影剂对于重症ICH病人AKI发生的影响。
综上所述,本研究建立了一个整合多系统临床因素的预测重症ICH病人住院期间发生AKI的列线图模型,通过验证模型,表明模型具有良好的区分度、准确度和临床适用性,但本研究仍存在以下局限性:1)MIMIC-Ⅳ数据库属于单中心数据,需要外部数据进一步验证模型准确性与临床适用性;2)由于无法获取病人的影像或症状数据,使用ICD诊断代码纳入病人,而不是基于临床指标诊断ICH;3)受限于回顾性研究,MIMIC-Ⅳ数据库存在部分数据缺失,如白蛋白、胱抑素C和β2-微球蛋白等可能导致AKI发生的影响因素,最终可能影响了预测模型的准确性,因此需要进一步完善相关研究。
参考文献:
[1]GBD 2019 STROKE COLLABORATORS.Global,regional,and national burden of stroke and its risk factors,1990-2019:a systematic analysis for the Global Burden of Disease Study 2019[J].Lancet Neurol,2021,20(10):795-820.
[2]HUANG Y,WAN C,WU G.Acute kidney injury after a stroke:a PRISMA-compliant meta-analysis[J].Brain Behav,2020,10(9):e01722.
[3]XIAO Y,WAN J,ZHANG Y,et al.Association between acute kidney injury and long-term mortality in patients with aneurysmal subarachnoid hemorrhage:a retrospective study[J].Front Neurol,2022,13:864193.
[4]MURUGAN R,KELLUM J A.Acute kidney injury:what′s the prognosis?[J].Nature Reviews Nephrology,2011,7:209-217.
[5]CHERTOW G M,BURDICK E,HONOUR M,et al.Acute kidney injury,mortality,length of stay,and costs in hospitalized patients[J].J Am Soc Nephrol,2005,16(11):3365-3370.
[6]TSAGALIS G,AKRIVOS T,ALEVIZAKI M,et al.Long-term prognosis of acute kidney injury after first acute stroke[J].Clin J Am Soc Nephrol,2009,4(3):616-622.
[7]SRISAWAT N,SILEANU F E,MURUGAN R,et al.Variation in risk and mortality of acute kidney injury in critically ill patients:a multicenter study[J].Am J Nephrol,2015,41(1):81-88.
[8]HOSTE E A J,BAGSHAW S M,BELLOMO R,et al.Epidemiology of acute kidney injury in critically ill patients:the multinational AKI-EPI study[J].Intensive Care Medicine,2015,41(8):1411-1423.
[9]NISULA S,KAUKONEN K M,VAARA S T,et al.Incidence,risk factors and 90-day mortality of patients with acute kidney injury in Finnish intensive care units:the FINNAKI study[J].Intensive Care Medicine,2013,39(3):420-428.
[10]PESONEN A,BEN-HAMOUDA N,SCHNEIDER A.Acute kidney injury after brain injury:does it exist?[J].Minerva Anestesiol,2021,87(7):823-827.
[11]OSTERMANN M,LIU K.Pathophysiology of AKI[J].Best Pract Res Clin Anaesthesiol,2017,31(3):305-314.
[12]LEE S A,COZZI M,BUSH E L,et al.Distant organ dysfunction in acute kidney injury:a review[J].American Journal of Kidney Diseases:the Official Journal of the National Kidney Foundation,2018,72(6):846-856.
[13]QURESHI A I,HUANG W,LOBANOVA I,et al.Systolic blood pressure reduction and acute kidney injury in intracerebral hemorrhage[J].Stroke,2020,51(10):3030-3038.
[14]ZHANG C,XIA J,GE H,et al.Long-term mortality related to acute kidney injury following intracerebral hemorrhage:a 10-year(2010-2019)retrospective study[J].Journal of Stroke and Cerebrovascular Diseases:The Official Journal of National Stroke Association,2021,30(5):105688.
[15]ANSARITOROGHI M,NAGARAJU S P,NAIR R P,et al.Study on acute kidney injury in patients with spontaneous intracerebral hemorrhage:an overview from a tertiary care hospital in south India[J].World Neurosurgery,2019,123:e740-e746.
[16]JOANNIDIS M,FORNI L G,KLEIN S J,et al.Lung-kidney interactions in critically ill patients:consensus report of the Acute Disease Quality Initiative(ADQI)21 Workgroup[J].Intensive Care Medicine,2020,46(4):654-672.
[17]FAUBEL S,EDELSTEIN C L.Mechanisms and mediators of lung injury after acute kidney injury[J].Nature Reviews Nephrology,2016,12:48-60.
[18]BANSAL N,MATHENY M E,GREEVY R A,et al.Acute kidney injury and risk of incident heart failure among US veterans[J].American Journal of Kidney Diseases:The Official Journal of the National Kidney Foundation,2018,71(2):236-245.
[19]LUIS H J,CRISTINA L,ANTONIO F,et al.Acute kidney injury in heart failure:a population study[J].ESC Heart Failure,2020,7(2):415-422.
[20]CMARA N O S,ISEKI K,KRAMER H,et al.Kidney disease and obesity:epidemiology,mechanisms and treatment[J].Nature Reviews Nephrology,2017,13:181-190.
[21]WANG M,WANG Z,CHEN Y,et al.Kidney damage caused by obesity and its feasible treatment drugs[J].International Journal of Molecular Sciences,2022,23(2):747.
[22]WHALEY-CONNELL A,SOWERS J R.Obesity and kidney disease:from population to basic science and the search for new therapeutic targets[J].Kidney International,2017,92(2):313-323.
[23]SHI N,LIU K,FAN Y,et al.The association between obesity and risk of acute kidney injury after cardiac surgery[J].Front Endocrinol(Lausanne),2020,11:534294.
[24]WIEDERMANN C J,WIEDERMANN W,JOANNIDIS M.Hypoalbuminemia and acute kidney injury:a meta-analysis of observational clinical studies[J].Intensive Care Medicine,2010,36(10):1657-1665.
[25]KIM K,BANG J Y,KIM S O,et al.Association of preoperative hypoalbuminemia with postoperative acute kidney injury in patients undergoing brain tumor surgery:a retrospective study[J].J Neurosurg,2018,128(4):1115-1122.
[26]Oxidation of albumin is enhanced in the presence of uremic toxins - PubMed[EB/OL].[2023-03-21].https://pubmed.ncbi.nlm.nih.gov/11499570/.
[27]RAY B,RICKERT K L,WELCH B G,et al.Development of contrast-induced nephropathy in subarachnoid hemorrhage:a single center perspective[J].Neurocritical Care,2013,19(2):150-156.
[28]SHAH N,KOCH S,HASSOUNEH Z,et al.Effect of race-ethnicity and CT angiography on renal injury during blood pressure treatment for intracerebral hemorrhage[J].Neurocritical Care,2021,35(3):687-692.
[29]DEMEL S L,GROSSMAN A W,KHOURY J C,et al.Association between acute kidney disease and intravenous dye administration in patients with acute stroke:a population-based study[J].Stroke,2017,48(4):835-839.
(收稿日期:2023-11-16)
(本文編辑王雅洁)
