粗盐提纯有妙招
2024-05-23吴海洋
吴海洋
粗盐提纯实验既能体现“化学是一门以实验为基础的科学”,又能体现“化学源于生活,又服务于生活”,它一直是中考考查的热点,而且常考常新.下面我们对粗盐提纯实验进行归纳,掌握与该实验有关的基础知识。
一、实验基本内容
1.难溶性杂质的去除
(1)仪器:药匙、托盘天平、烧杯、玻璃棒、漏斗、铁架台(含铁圈)、蒸发皿、酒精灯、坩埚钳、量筒.
(2)步骤:溶解,过滤,蒸发,计算产率.
(3)过滤操作要点:一贴,将滤纸折叠好放入漏斗,用少量蒸馏水润湿滤纸,使滤纸紧贴漏斗内壁(滤纸与漏斗间的气泡会影响过滤速度,应挤出气泡).二低,滤纸边缘应略低于漏斗边缘,漏斗中液体的液面应略低于滤纸的边缘(否则被过滤的液体会从滤纸与漏斗之间的间隙流下,直接流到漏斗下方 的烧杯中,这样未经过滤的液体便会与滤液 混在一起).三靠,向漏斗中倾倒液体时,应 使用玻璃棒引流,烧杯口应紧靠玻璃棒,玻 璃棒的底端应与漏斗中三层滤纸处轻轻接 触,漏斗颈的末端应紧靠下方的烧杯内壁.
(4)玻璃棒的作用:溶解时搅拌,加速粗 盐的溶解;过滤时引流,防止液体溅出;蒸发 时搅拌,防止局部过热造成液滴飞溅;蒸发后转移固体.
2.可溶性杂质的去除(以MgCl2、CaCl2、 Na2SO4为例)
(1)步骤:溶解,向溶液中依次加入过 量的BaCl2溶液、NaOH溶液、Na2CO3溶液,将SO、Mg2+、Ca2+转化为BaSO4、Mg(OH)2、CaCO3沉淀(加入Na2CO3溶液后,过量的Ba2+会转化为BaCO3沉淀).过滤,去除BaSO4、Mg(OH)2、CaCO3、BaCO3沉淀.向滤液中加入适量的稀盐酸,去除过量的NaOH、Na2CO3,将它们转化为NaCl.加热蒸发,去除HCl和水,得到NaCl晶体.(2)注意事项:除杂过程中使用了含Na+的溶液与含有CI-的溶液,它们参与的化学反应生成了新的NaCl,所以最后得到的NaCl 晶体的质量增加.
二、中考考查角度
1.考查仪器和操作
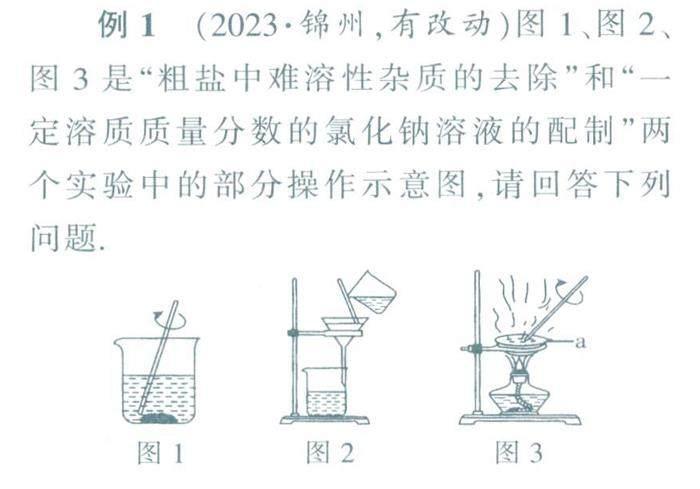
例1(2023·锦州,有改动)图1、图2、 图3是“粗盐中难溶性杂质的去除”和“一 定溶质质量分数的氯化钠溶液的配制”两 个实验中的部分操作示意图,请回答下列问题
(1)两个实验都有的实验步骤是________(填步骤名称).
(2)在上页图3中,仪器a是________玻璃棒的作用是________,
(3)小明同學用提纯得到的氯化钠配制 一定溶质质量分数的溶液,经检测,他配制 的溶液的溶质质量分数偏小,可能的原因是________(填字母序号).
A.量取水时,仰视凹液面最低处读数
B.装瓶时有少量溶液洒出
C.向烧杯中加水时有水溅出
D.将称量好的氯化钠固体转移至烧杯 时,有少量氯化钠洒落
解析g(1)题中提到的两个实验都有的 实验操作是溶解,即将固体药品放入盛有水 的烧杯中,并用玻璃棒搅拌,使固体药品溶 解.(2)在蒸发操作中,盛放溶液的容器是蒸 发皿,蒸发时需要用玻璃棒搅拌,防止局部 温度过高造成液滴飞溅.(3)量取水的体积时, 若仰视凹液面最低处读数,则实际量取的水 的体积偏大,即溶剂质量偏大,则溶液的溶 质质量分数偏小.配置好的溶液是均一的, 稳定的,装瓶时有少量溶液洒出不会影响溶 液的溶质质量分数.向烧杯中加水时,若有 水溅出,则实际参与溶解的水的质量变小, 则溶液的溶质质量分数偏大.将称量好的氯化钠固体转移至烧杯时,若氯化钠洒落,则 实际参与溶解的溶质的质量减少,则溶液的 溶质质量分数偏小.
答案:(1)溶解(2)蒸发皿搅拌,防止局部温度过高造成液滴飞溅(3)AD
点拨:在探讨过滤失败的原因时,同学 们要从仪器和操作两个角度考虑,例如仪器 是否干净,滤纸是否破损,漏斗内的液面是 否高于滤纸边缘等.在判断溶液的溶质质量 分数偏大还是偏小时,同学们要从溶质和溶 剂两个方面考虑,思考在整个配制过程中,哪些情况导致溶剂质量发生了变化,哪些情 况导致溶质质量发生了变化.
2.考查方案的设计与评价
例2(2023·宜昌,有改动)某化学小组 的同学想利用粗盐获取较为纯净的氯化钠 晶体.粗盐含有多种可溶性杂质(如氯化镁、 氯化钙、硫酸钠等)和不溶性杂质(泥沙等).
(1)同学们取来少量粗盐,放入足量的 水中溶解,可以通过 的操作去除其中 的不溶性杂质.
(2)完成上述操作后,同学们决定进一 步去除所得溶液中的可溶性杂质.小华同学 选择用硝酸钡溶液去除硫酸钠,相关反应的化学方程式为______.小组内的其他同学认为小华同学选择的试剂不正确,因为选择除杂 试剂时要遵循一个原则:除杂试剂只与杂质 ._______最终,同学们选择的除杂试剂 反应,
是氢氧化钠溶液、碳酸钠溶液、氯化钡溶液.
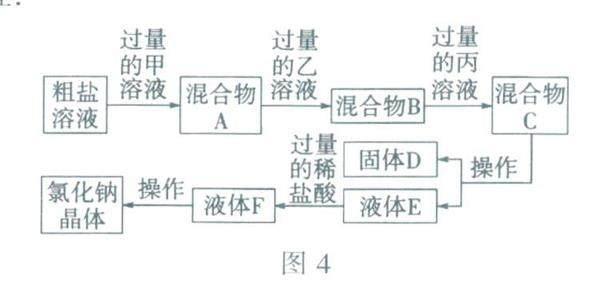
(3)同学们设计了如图4所示的除杂流程.
滴加甲、乙、丙三种试剂的正确顺序最 多有3种,请写出其中一种:________ (按顺序
写出溶质的化学式).向溶液中加入氢氧化钠 溶液时,发生的反应的化学方程式为________ 固体D的成分有 (写化学式).向液体E中加入稀盐酸,发生的反应的化学方程式为________(写一个).
(4)在反思评价的环节中,小郑同学认为, 在上述实验操作中,可以将甲、乙、丙三种溶 液改为两种,这两种溶液的溶质为________ (按顺序写出化学式).
解析:(1)泥沙难溶于水,过滤可实现同液分离,去除粗盐中的难溶性杂质.(2)硝酸钡和硫酸钠反应可以生成硫酸钡沉淀和硝酸钠,除杂试剂应当只与杂质反应,且不能生成新的杂质,但硝酸钡和硫酸钠的反应生成了新的杂质硝酸钠.(3)粗盐含有氯化镁、氯化钙、硫酸钠等杂质,向粗盐溶液中加入过量的氢氧化钠溶液,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,去除了氯化镁.加入过量的氯化钡溶液,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,去除了硫酸钠.加入过量的碳酸钠溶液,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,去除了氯化钙和过量的氯化钡.所以加入碳酸钠溶液的操作,应在加入氯化钡溶液之后,这样过量的氯化钡才能被去除.南以上分析可知,同体D的成分有氢氧化镁、硫酸钡、碳酸钡、碳酸钙.液体E中含氢氧化钠和碳酸钠,二者均可与稀盐酸发生反应.(4)若将甲、乙、丙三种溶液改为两种,则可改为氢氧化钡溶液和碳酸钠溶液.先加入过量的氢氧化钡溶液,可去除氯化镁和硫酸钠,再加入过量的碳酸钠溶液,碳酸钠与氯化钡、氢氧化钡反应生成碳酸钡沉淀,与氯化钙反应生成碳酸钙沉淀.
答案:(1)过滤(2)Ba (NO3)2+Na2SO4= 不能产生新的杂质BaSO4 ↓ +2NaNO3(3)NaOH、BaCl2、Na2CO3(或 BaCl2、NaOH、 Na2CO3,或 BaCl2、Na2CO3、NaOH) MgCl2+2NaOH=Mg(OH)2↓ +2NaCl Mg(OH)2 BaSO4、 BaCO3 CaCO3 Na2CO3+2HCl=2NaCl +H20+ CO2↑(或HCl+NaOH=NaCl+H2O)(4)Ba(OH)2、Na2CO3
点拨:在去除溶液中的可溶性杂质时, 要注意试剂的添加顺序,后加的试剂要能将 先加的过量试剂去除,且自身也容易在后续 的操作中被去除.
