拟南芥组织特异性表达FHY3对fhy3far1细胞死亡的影响
2024-05-21徐云巧朱凤晨马琳秦晓春
徐云巧 朱凤晨 马琳 秦晓春

文章编号:1671-3559(2024)03-0369-07DOI:10.13349/j.cnki.jdxbn.20240403.003
摘要: 为了探究植物光信号蛋白FHY3及其同源蛋白FAR1在叶片细胞死亡调控过程中的分子机制,在拟南芥fhy3far1双突变体背景下分别在维管束及叶肉细胞中表达FHY3。结果表明:在fhy3far1双突变体维管束中特异性表达FHY3可完全改善fhy3far1的细胞死亡表型,而在fhy3far1双突变体叶肉细胞中特异性表达FHY3仅可部分缓解fhy3far1叶片细胞死亡表型,揭示了FHY3调控细胞死亡过程主要是在维管束中行使功能。
关键词: 光信号蛋白; 维管束; 叶肉细胞; 细胞死亡; 拟南芥
中图分类号: Q78
文献标志码: A
开放科学识别码(OSID码):
Effects of Tissue-specific Expression of FHY3 on
Cell Death of fhy3far1 in Arabidopsis Thaliana
XU Yunqiao, ZHU Fengchen, MA Lin, QIN Xiaochun
(School of Biological Science and Technology, University of Jinan, Jinan 250022, Shandong, China)
Abstract: To investigate the mechanism of light signaling protein FHY3 and its homologous protein FAR1 on the leaves cell death,
two sets of transgenic plants in Arabidopsis thaliana that FHY3 particularly expressed in the vascular bundle or mesophyll cells were generated in the fhy3far1 double mutant background.
The results show that FHY3 expressed in vascular bundles completely rescue the leaves cell death phenotype of fhy3far1, however, FHY3 specific expressed in the mesophyll cells only largely rescue the cell death phenotype of fhy3far1, so FHY3 plays an essential role in regulating leaf cell death mainly occurring in the vascular bundles.
Keywords: light signaling protein; vascular bundle; mesophyll cell; cell death; Arabidopsis thaliana
光是影響农作物产量和品质最重要的环境因素之一,是农业生产中不可忽略的重要环节。光不仅提供了植物光合作用所需要的能量,同时也可以作为一种信号直接调控植物生长发育的多个生物过程。光照强度及时间的变化直接影响作物的分布、 开花时间、 产量和品质,在农业生产中具有极其重要的作用。在光照不足逆境胁迫的生长条件下,除光合效率降低之外,植物还会发生一系列的形态变化,如叶片变薄、 黄化、 叶片死亡和育性降低等,这些形态或生理变化大多被光信号直接调控[1-3],因此,开展植物光信号转导研究,无论是基础研究,还是应用基础研究,都具有非常重要的价值。
植物感受环境中不断变化的光信号是通过光受体实现的。不同的光受体通过感受到外界环境中不
收稿日期: 2023-04-25 网络首发时间:2024-04-07T15:52:05
基金项目: 国家重点研发计划项目(2018YFD1000501);国家自然科学基金项目(31900211)
第一作者简介: 徐云巧(1998—),女,山东淄博人。硕士研究生,研究方向为光信号蛋白功能研究。E-mail: xuyq@163.com。
通信作者简介: 马琳(1988—),女,山东潍坊人。讲师,博士,研究方向为光信号蛋白功能研究。E-mail: bio_mal@ujn.edu.cn。
秦晓春(1980—),女,山东济宁人。教授,博士,博士生导师,研究方向为光合作用与高光效农业。E-mail: bio_qinxc@ujn.edu.cn。
网络首发地址: https://link.cnki.net/urlid/37.1378.N.20240403.1601.006
同变化的光信号, 其蛋白构象或定位发生改变, 进而与下游相关信号蛋白与转录因子相互作用, 调控相关下游基因表达, 从而帮助植物更好地适应外界环境的昼夜和季节变化。光信号蛋白FHY3(far-red elongated hypocotyl 3)和同源蛋白FAR1(far-red impaired response 1)是一类由转座酶衍变而来的新型转录因子。前期研究发现, FHY3及FAR1在光敏色素phyA(phytochrome A)远红光信号转导途径中发挥重要作用,可以特异地结合在下游靶基因启动子的FBS(FHY3 binding sites,CACGCGC)区域并调控下游基因表达[4-5]。目前,FHY3与FAR1参与植物生长发育的多个生物过程,主要包括对幼苗光形态建成[5-7]、 生物钟基因节律性表达[8-9]、 叶绿体分裂[10]、 叶绿素合成[11]、 植物分生组织建立与维持[12]、 肌醇淀粉合成[13-14]、 脱落酸信号响应[15]、 遮阴响应[16-17]以及叶片衰老的调控[18-20]等方面。
前期研究发现,在对模式植物拟南芥光信号转导相关突变体的分析中,FHY3和FAR1基因表达完全缺失的双突变体fhy3far1在短日照及延长黑暗的生长条件下呈现植株弱小、育性显著降低等特征,并伴随严重叶片细胞死亡等异常发育表型,与植物发生超敏反应的表型十分类似。对fhy3far1
细胞死亡的表型进行分析的过程依赖于水杨酸(salicylic acid, SA)的过量积累,因此,通过降低SA的积累量可显著缓解fhy3far1的细胞死亡表型[13, 21]。目前关于FHY3和FAR1如何直接调控植物细胞死亡过程的分子机制仍不清晰,为了对该机制进行进一步解析,本文中通过在拟南芥fhy3far1突变体维管束及叶肉细胞中组织特异性表达FHY3,并观察其对叶片细胞死亡表型的影响。在本研究中,通过在fhy3far1突变体维管束中特异性表达光信号蛋白FHY3,可完全改善其细胞死亡表型,而在fhy3far1突变体叶肉细胞中特异性表达FHY3则无法完全缓解,预示着FHY3在维管束中具有的潜在重要功能。本文中的研究为深入阐释fhy3far1突变体叶片细胞死亡的调控机制以及FHY3蛋白功能,解析光信号转导的分子机制提供了重要的参考材料。
济南大学学报(自然科学版)第38卷
第3期徐云巧,等:拟南芥组织特异性表达FHY3对fhy3far1细胞死亡的影响
1 材料与方法
1.1 植物材料与栽培条件
本文中所用的拟南芥材料主要包括野生型No-0及fhy3far1突变体, 均在济南大学生物科学与技术学院保存。 将拟南芥种子采用乙醇的体积分数为75%的溶液及次氯酸钠的质量分数为1.5%的溶液进行消毒,并将其置于设定温度为4 ℃的黑暗条件下春化作用, 3 d之后将其置于植物全能培养基上并于设定温度为 22 ℃的培养箱中进行萌发,待长出真叶后移植于营养土中, 分别在长日照(16 h光照, 8 h黑暗) 或短日照(8 h光照, 16 h黑暗)、 温度为22 ℃的生长条件下进行培养。
1.2 组织特异性表达FHY3表达载体的构建
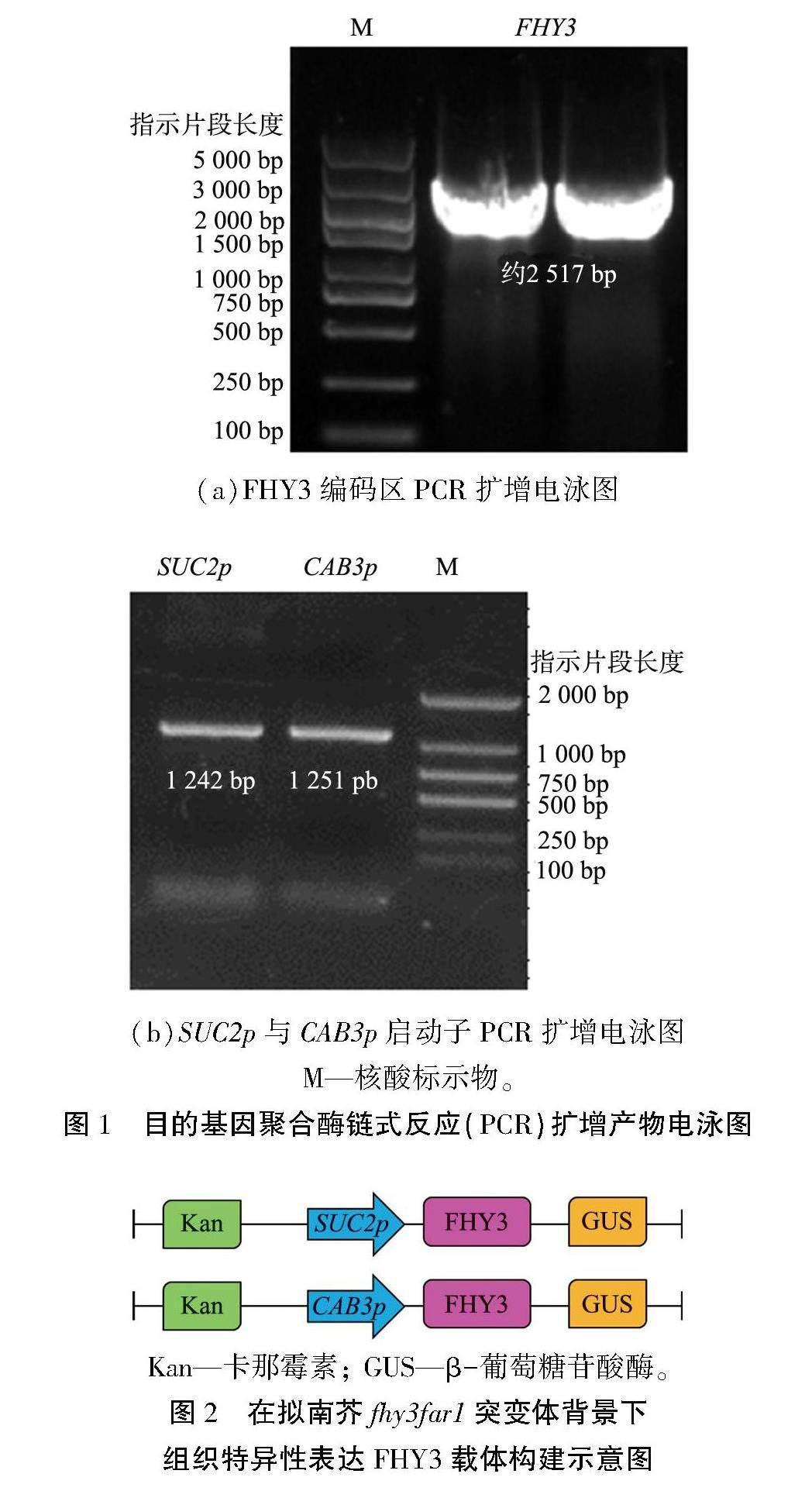
根据TAIR 数据库公布的SUC2 (sucrose-proton symporter 2,AT1G22710)、 CAB3 (chlorophyll a/b binding protein 3,AT1G29910)以及FHY3 (AT3G22170)基因启动子及编码区序列,设计聚合酶链式反应(PCR)扩增引物(见表1),并使用美国国家生物技术信息中心(NCBI)进行引物特异性检测,引物由生工生物工程(上海)股份有限公司合成引物。以拟南芥No生态型的基因组脱氧核糖核酸(DNA)为模板对SUC2及CAB3的启动子序列进行扩增,以拟南芥No生态型的cDNA为模板对FHY3全长片段进行PCR扩增,分别将PCR产物进行酶切回收,其中,SUC2启动子片段SUC2p用EcoRI和KpnI进行双酶切,CAB3启动子片段CAB3p用SacI和KpnI进行双酶切,而FHY3编码区片段用KpnI及SalI进行双酶切,酶切完成后分别进行产物纯化得到黏性末端目的片段。
本实验所用载体为pZP211-GUS,根据其多克隆位点序列,先进行同样双酶切分别与SUC2及CAB3的启动子序列相连接,获得pZP211-SUC2p/CAB3p:GUS表达载体。再将该表达载体进行KpnI及SalI双酶切,与FHY3外显子片段相连接,最终经过DNA测序技术,成功构建完成pZP211-SUC2p/CAB3p:FHY3-GUS表达载体。除此之外,通过将pZP211-35S:3FLAG进行EcoRI和KpnI双酶切,与SUC2启动子片段进行连接,获得pZP211-SUC2p:3FLAG表达载体,进一步通过酶切连接,将其与FHY3外显子片段相连接, 最终经过DNA测序, 成功完成pZP211-SUC2p:FHY3-3FLAG表达载体的构建。
1.3 组织特异性表达FHY3转基因株系的获得
将构建完成的表达载体转化农杆菌GV3101, 将其在侵染液中重悬并利用花序浸染法侵染拟南芥fhy3far1双突变体。 将侵染完成收获的T0代种子在含有卡那霉素(Kan)质量浓度为100 mg/L的抗性培养基上进行筛选, 获得T1代转基因植株。 其中, 在维管束SUC2p:FHY3-GUS/fhy3far1及叶肉细胞CAB3p: FHY3-GUS/fhy3far1中特异性表达FHY3的转基因植株叶片采用β-葡萄糖苷酸酶(GUS)染色法进行筛选[13], 将成功染色T1代株系进行自交, 获得T2代进行后续研究。SUC2p:FHY3-3FLAG/fhy3far1转基因株系通过提取T1代转基因植株基因组DNA, 设计引物FHY3-F1(序列为TATAGGAAACTGTGCTGGTA)及3FLAG-R(序列为TCACTTATCGTCATCGTCCT),进行片段扩增,进而获得基因组中成功插入载体的T1代转基因植株,继续自交获得T2代并进行后续研究。
2 结果与分析
2.1 组织特异性表达FHY3载体构建
为了实现在拟南芥fhy3far1突變体背景下组织特异性表达FHY3, 本文中分别选取能够在韧皮部及叶肉细胞中特异性表达基因SUC2和CAB3的启动子序列区域进行FHY3组织特异性表达载体构建。 根据SUC2和CAB3的启动子以及FHY3的外显子编码区序列进行引物设计及PCR扩增, 其中,SUC2与CAB3选取的启动子片段长度分别为1 242、 1 251 bp,FHY3选取的编码区片段长度为2 517 bp。PCR扩增结果如图1所示。根据电泳标记物(M)指示不同片段长度条带,FHY3编码区片段与SUC2、 CAB3启动子片段扩增条带与预期片段长度相符合。对PCR产物分别进行酶切及产物回收,并最终连入pZP211-GUS表达载体中,通过大肠杆菌的转化、 阳性克隆的筛选、 质粒的提取及DNA测序鉴定等方式成功构建pZP211-SUC2p:FHY3-GUS及pZP211-CAB3p:FHY3-GUS表达载体,其结构图如图2所示。最终通过农杆菌转化及拟南芥花序浸染法获得T0代种子,将其在含有卡那霉素的质量浓度为100 mg/L的抗性培养基上进行筛选,获得在维管束SUC2p:FHY3-GUS/fhy3far1及叶肉细胞CAB3p:FHY3-GUS/fhy3far1中特异性表达FHY3的T1代转基因株系。
2.2 CAB3p:FHY3-GUS/fhy3far1转基因株系筛选鉴定及表型分析
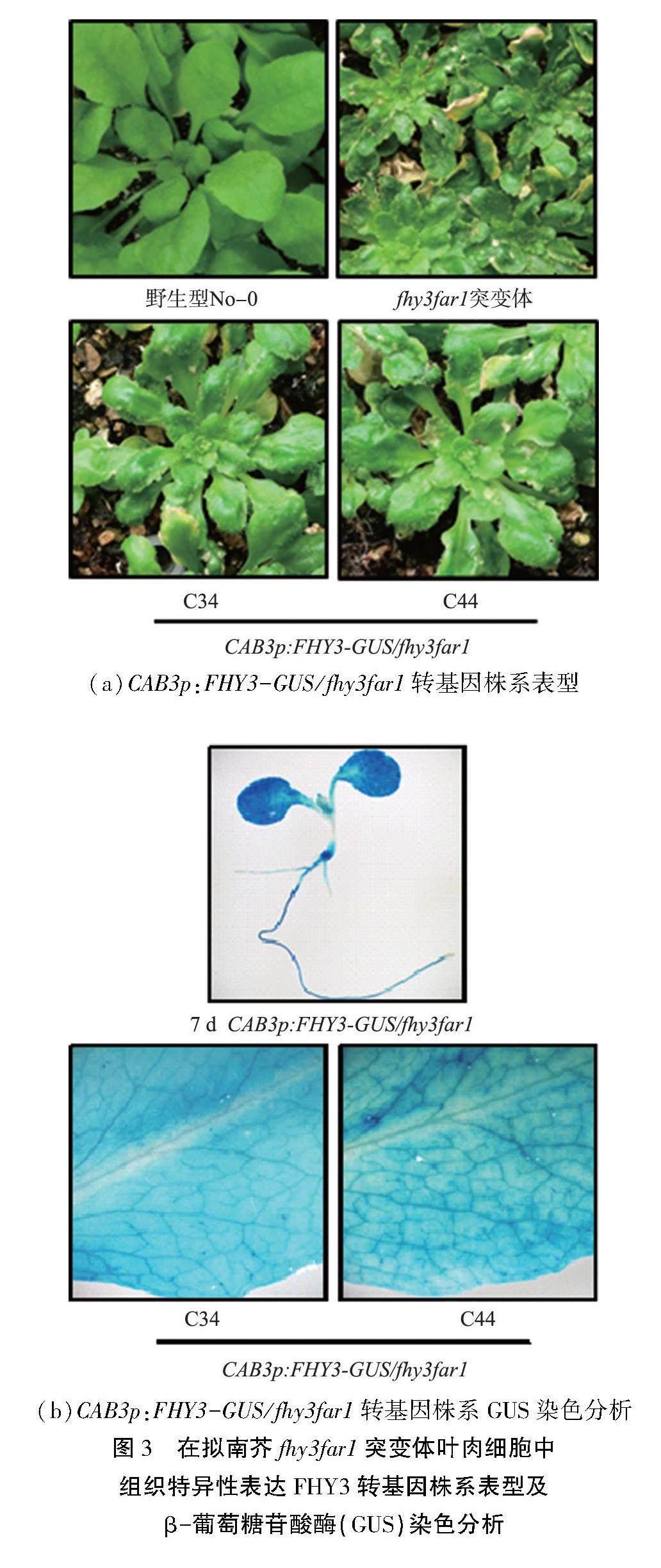
通过卡那霉素抗性筛选获得T1代CAB3p:FHY3-GUS/fhy3far1转基因植株, 自交获得T2代, 在短日照条件下进行培养并对其进行细胞死亡表型及GUS染色定位分析, 结果如图3所示。 通过对其叶片细胞死亡表型进行分析, 在短日照条件下生长50 d, fhy3far1突变体呈现生长弱小、 叶片褶皱及严重细胞死亡现象, 与前期研究结果相一致, 而在CAB3p:FHY3-GUS/fhy3far1转基因植株中,研究发现在叶肉细胞中特异性表达FHY3(C34和C44)可部分缓解fhy3far1生长发育弱小、 叶片细胞死亡等异常发育表型[见图3(a)]。为了进一步证明该表型由在叶肉细胞中特异性表达FHY3导致,对其进行叶片GUS染色分析,结果表明,无论在幼苗(生长7 d)还是成苗时期(生长50 d),其GUS染色部位呈现均匀分布在叶片组织中,表明FHY3主要集中在叶肉细胞中表达,证明CAB3p:FHY3-GUS/fhy3far1转基因植株构建成功,同时进一步说明, FHY3在叶肉细胞中特异性表达仅部分互补fhy3far1的细胞死亡表型[见图3(b)]。
2.3 SUC2p:FHY3-GUS/fhy3far1转基因株系筛选鉴定及表型分析
基于上述研究基础,通过同样筛选方式成功获得T2代SUC2p:FHY3-GUS/fhy3far1转基因阳性植株,将其均在短日照生长条件下种植并进行叶片细胞死亡等表型观察,结果如图4(a)所示。由图可以看出:在短日照条件下生长28 d,fhy3far1突变体呈现植株生长弱小、 叶片发育不良并伴随严重细胞死亡现象,而SUC2p:FHY3-GUS/fhy3far1转基因阳性植株(S88和S94)则整体呈现类似野生型No-0的表型,可完全改善并缓解fhy3far1突变体叶片细胞死亡等生长发育异常的表型。为了进一步确定该表型与在维管束中特异性表达FHY3蛋白之间的关系,通过对表型恢复的转基因植株叶片(S88和S94)进一步进行GUS染色分析,结果表明,无论在生长7 d的幼苗及生长28 d的成苗(S88和S94)叶片材料中,SUC2p:FHY3-GUS/fhy3far1转基因株系GUS染色部位均主要集中在叶脉中表达,表明在维管束中特异性表达FHY3(SUC2p:FHY3-GUS/fhy3far1)转基因植株构建成功,且其生长良好表型由在维管束中特异性表达FHY3蛋白功能导致。相比在叶肉细胞中特异性表达FHY3(CAB3p:FHY3-GUS/ fhy3far1)转基因株系细胞死亡部分恢复的表型,FHY3在维管束中特异性表达可完全互补fhy3far1的细胞死亡表型[见图4(b)]推测FHY3在维管束中具有潜在的重要功能。
2.4 在短日照生长条件下SUC2p:FHY3-3FLAG/fhy3far1转基因株系表型分析
为了进一步验证FHY3在拟南芥fhy3far1突变体维管束中特异性表达可完全互补fhy3far1突变体的细胞死亡表型,通过进一步将PCR扩增得到的SUC2启动子片段与FHY3编码区连入pZP211-3FLAG表达载体中,并后续转化农杆菌,浸染fhy3far1突变体花序等实验,最终,经卡那霉素抗性筛选获得SUC2p:FHY3-3FLAG/fhy3far1 T1代转基因株系。选取FHY3编码区及3FLAG标签序列设计引物(FHY3-F1及3FLAG-R),通过PCR扩增对T1代转基因株系进行载体插入验证,从中挑选载体转化成功的T1代转基因株系进行自交获得T2代并进行后续表型分析,结果如图5所示。从图中可以看出,通过在短日照生长条件下培养28 d,与野生型No-0相比,fhy3far1突变体呈现严重的细胞死亡表型,而FHY3在维管束中组织特异性表达的SUC2p:FHY3-3FLAG/fhy3far1轉基因株系中(分别是8、10、
16、 32号), 其细胞死亡表型得到明显缓解, 呈现类似野生型No-0无细胞死亡的表型, 与SUC2p:FHY3-GUS/fhy3far1转基因植株的结果相吻合, 进一步表明在维管束中特异性表达FHY3可完全缓解fhy3far1突变体细胞死亡等异常发育表型。
2.5 在延长黑暗转光下生长条件下SUC2p:FHY3-3FLAG/fhy3far1转基因株系表型分析
前期研究表明,fhy3far1突变体细胞死亡表型受延长黑暗所诱导,且该过程依赖于FHY3功能缺失。为了进一步验证在拟南芥fhy3far1突变体维管束中组织特异性表达FHY3对fhy3far1突变体细胞死亡表型的影响,通过将在长日照条件下生长21 d的野生型No-0、 fhy3far1突变体以及不同SUC2p:FHY3-3FLAG/fhy3far1转基因株系进行延长黑暗处理3 d再转光下处理3 d,观察其叶片细胞死亡表型变化,结果如图6所示。由图可见,与野生型No-0相比,fhy3far1突变体延长黑暗处理3 d再转光下生长3 d,其幼叶部位呈现严重的细胞死亡现象(图中红色箭头标注部位),进一步表明fhy3far1细胞死亡表型受黑暗延长所诱导,然而,在不同SUC2p:FHY3-3FLAG/fhy3far1转基因株系中(8、 10、 16、 32号),通过相同条件延长黑暗转光下处理,其幼叶部位细胞死亡表型得到明显缓解与改善。结合前期研究结果,最终进一步证明,在拟南芥fhy3far1突变体维管束中特异性表达FHY3可完全互补fhy3far1突变体受黑暗所诱导的细胞死亡表型,推测FHY3在维管束中存在潜在的重要功能。
3 结论
近年来, 随着全球天气变暖和环境污染日益加剧, 植物生长发育过程中遭遇雾霾及阴雨寡照等异常天气的频度逐渐增加, 作物产量和品质受到严重威胁。 对植物生长而言, 无论是在雾霾还是阴雨寡照天气下, 光照强度或光照时间不足是影响植物生长发育的主要原因之一, 因此, 开展光信号调控植物生长发育的机制研究具有十分重要的生物学意义。
本文中基于FHY3及FAR1功能缺失的fhy3far1突變体在短日照及延长黑暗等生长条件下呈现严重的叶片细胞死亡表型为出发点进行研究, 前期关于fhy3far1突变体的细胞死亡表型的研究主要集中在减少fhy3far1
体内SA积累可显著缓解细胞死亡表型, 表明fhy3far1突变体叶片细胞死亡表型依赖SA积累[13, 21]。 为了进一步探究FHY3直接调控植物细胞死亡过程的分子机制, 本文中通过选取在拟南芥fhy3far1突变体维管束及叶肉细胞中组织特异性表达FHY3, 分别构建维管束
SUC2p:FHY3-GUS/fhy3far1及叶肉细胞CAB3p:FHY3-GUS/fhy3far1转基因株系, 观察它们是否可互补fhy3far1突变体的细胞死亡表型。 得到以下主要结论:
1)通过GUS染色对FHY3表达部位进行定位分析,结果表明,在短日照生长条件下,在拟南芥fhy3far1突变体叶肉细胞中特异性表达FHY3可部分恢复fhy3far1突变体生长弱小及叶片细胞死亡的表型,而在拟南芥fhy3far1突变体维管束中特异性表达FHY3则可完全互补fhy3far1突变体细胞死亡等异常生长表型,呈现类似野生型No-0的表型。
2)为了进一步验证在拟南芥fhy3far1突变体维管束中特异性表达FHY3对fhy3far1突变体细胞死亡表型的影响,通过构建带有3FLAG标签不同转基因植株SUC2p:FHY3-3FLAG/fhy3far1,分别在短日照及延长黑暗转光下处理等生长条件下观察其表型,与前期研究结果一致,在拟南芥fhy3far1突变体韧皮部组织特异性表达FHY3可完全互补fhy3far1由黑暗诱导的生长弱小及叶片细胞死亡表型。
结合前期研究, 基于本文中的研究结果, 推测光信号蛋白FHY3参与调控拟南芥fhy3far1突变体叶片细胞死亡过程主要通过在韧皮部发挥功能实现的。 本文中的研究结论为后续解析光信号蛋白FHY3直接调控叶片细胞死亡分子机制,深入解析组织特异性表达FHY3在植物生长发育等多个生物学过程中的功能发挥奠定了基础。
参考文献:
[1] KAMI C, LORRAIN S, HORNITSCHEK P, et al. Light-regulated plant growth and development[J]. Current Topics in Developmental Biology, 2010, 91: 29.
[2] LI J G, LI G, WANG H Y, et al. Phytochrome signaling mechanisms[M]. Arabidopsis Book, 2011, 9: e0148.
[3] CASAL J J. Photoreceptor signaling networks in plant responses to shade[J]. Annual Review of Plant Biology, 2013, 64: 403-427.
[4] WANG H Y, DENG X W. Arabidopsis FHY3 defines a key phytochrome: a signaling component directly interacting with its homo-logous partner FAR1[J]. EMBO Journal, 2002, 21: 1339.
[5] LINRC,DINGL,CASOLAC,etal.Transposase-derived transcription factors regulate light signaling in Arabidopsis[J]. Science, 2007, 318: 1302-1305.
[6] LI J G, LI G, GAO S M, et al. Arabidopsis transcription factor ELONGATED HYPOCOTYL5 plays a role in the feedback regulation of phytochrome A signaling[J]. The Plant Cell, 2010, 22: 3634.
[7] HUANG X, OUYANG X H, YANG P Y, et al. Arabidopsis FHY3 and HY5 positively mediate induction of COP1 transcription in response to photomorphogenic UV-B light[J]. The Plant Cell, 2012, 24: 4590.
[8] LI G, SIDDIQUI H, TENG Y B, et al. Coordinated transcriptional regulation underlying the circadian clock in Arabidopsis[J]. Nature Cell Biology, 2011, 13: 616.
[9] IU Y, MA M D, LI G, et al. Transcription factors FHY3 and FAR1 regulate light-induced CIRCADIAN CLOCK ASSOCIATED1 gene expression in Arabidopsis[J]. The Plant Cell, 2020, 32(5): 1464.
[10] OUYANG X H, LI J G, LI G, et al. Genome-wide binding site analysis of FAR-RED ELONGATED HYPOCOTYL3 reveals its novel function in Arabidopsis development[J]. The Plant Cell, 2011, 23: 2514.
[11] TANG W J, WANG W Q, CHEN D Q, et al. Transposase-derived proteins FHY3/FAR1 interact with PHYTOCHROME-INTERACTING FACTOR1 to regulate chlorophyll biosynthesis by modulating HEMB1 during deetiolation in Arabidopsis[J]. The Plant Cell, 2012, 24: 1984.
[12] LIDM,FUX,GUOL,etal.FAR-REDELONGATEDHYPOCOTYL3 activates SEPALLATA2 but inhibits CLAVATA3 to regulate meristem determinacy and maintenance in Arabidopsis[J]. Proceedings of the National Academy of Sciences, 2016, 113(33): 9375.
[13] MA L, TIAN T, LIN R C, et al. Arabidopsis FHY3 and FAR1 regulate light-induced myo-inositol biosynthesis and oxidative stress responses by transcriptional activation of MIPS1[J]. Molecular Plant, 2016, 9: 541.
[14] MA L, XUE N, FU X Y, et al. Arabidopsis thaliana FAR-RED ELONGATED HYPOCOTYLS3 (FHY3) and FAR-RED-IMPAIRED RESPONSE1 (FAR1) modulate starch synthesis in response to light and sugar[J]. New Phytologist, 2017, 213: 1682.
[15] XU D, WU D, LI X H, et al. Light and abscisic acid coordinately regulate greening of seedlings[J]. Plant Physiology, 2020, 183(3): 1281.
[16] LIU Y, WEI H B, MA M D, et al. Arabidopsis FHY3 and FAR1 regulate the balance between growth and defense responses under shade conditions[J]. Plant Cell, 2019, 31(9): 2089.
[17] MA L, LI Y, LI X X, et al. FAR-RED ELONGATED HYPOCOTYLS3 negatively regulates shade avoidance responses in Arabidopsis[J]. Plant Cell and Environment, 2019, 42(12): 3280.
[18] TIAN T, MA L, LIU Y, et al. Arabidopsis FAR-RED ELONGATED HYPOCOTYL3 integrates age and light signals to negatively regulate leaf senescence[J]. The Plant Cell, 2020, 32(5): 1574.
[19] XIE Y R, MA M D, LIU Y, et al. Arabidopsis FHY3 and FAR1 function in age gating of leaf senescence[J]. Frontiers in Plant Science 2021, 28(12): 770060.
[20] WANG Q B, LIU M L, QUAN S X, et al. FAR-RED ELONGATED HYPOCOTYL3 increases leaf longevity by delaying senescence in Arabidopsis[J]. Plant Cell and Environment, 2023, 46(5): 1582.
[21] WANG W Q, TANG W J, MA T T,etal.Apairoflightsignaling factors FHY3 and FAR1 regulates plant immunity by modulating chlorophyll biosynthesis[J]. Journal of Integrative Plant Biology, 2016, 58(1): 91.
(責任编辑:于海琴)
