左侧颞部副神经节瘤影像学表现一例
2024-05-20卢婷王媛媛周凤瑜董文洁周俊林
卢婷,王媛媛,周凤瑜,董文洁,周俊林*
作者单位 1.兰州大学第二医院放射科,兰州 730030;2.兰州大学第二临床医学院,兰州 730000;3.甘肃省医学影像重点实验室,兰州 730030
本研究为回顾性研究,遵守《赫尔辛基宣言》,并经兰州大学第二医院伦理委员会审核批准,免除受试者知情同意,批准文号:2023A-444。
患者男,41 岁,因“左侧颞部一质软包块伴头痛1 年余,加重2 天”,于2023 年5 月至兰州大学第二医院就诊。患者自诉1 年前左侧颞部出现一质软包块伴头痛,在当地医院就诊,给予口服双氯芬酸钠缓释片(0.1 g/天)治疗后症状稍有缓解,2天前患者左侧颞部疼痛加重。查体:血压118 mmHg/82 mmHg(1 mmHg=0.133 kPa),自发病以来神志尚清,精神欠佳,近期体质量下降约10 kg。既往糖尿病病史1 年余,规律口服盐酸二甲双胍缓释片(0.5 g/天)。实验室检查:葡萄糖10.86 mmol/L(3.90~6.10 mmol/L),血气分析、凝血功能未见明显异常。
影像学检查:头面部超声示左侧头皮下低回声病灶,大小3.0 cm×2.6 cm,形态规则,边界不清,内部回声不均匀,血流信号丰富(图1A)。CT平扫示左侧颞部软组织密度肿块,大小5.5 cm×6.6 cm×7.1 cm,左侧颞骨、蝶骨大翼及蝶窦壁多发骨质破坏,左侧翼内肌受侵(图1B~1C)。头颅CT 血管造影(computed tomographic angiography, CTA)示左侧颞部肿物明显强化(图1D),由左侧颈外动脉分支供血,内见多发迂曲血管影(图1E)。头颅MRI示左侧颞部不规则实性占位,沟通颅内外生长,大小8.3 cm×7.1 cm×8.7 cm,病灶向前下延伸入颞窝,侵及左侧翼内外肌及左侧颞肌、第三脑室及左侧侧脑室受压变窄,中线结构向右侧移位。病灶实性成分表现为等T1稍长T2信号,内见多发迂曲血管影,高b值(b=1000 s /mm2)扩散加权成像(diffusion weighted imaging, DWI)呈稍高信号,表观扩散系数(apparent diffusion coefficient,ADC)值为0.920×10-3mm2/s,T1WI 增强明显不均匀强化(图1F~1J)。影像学诊断:左侧颞部占位性病变,恶性脑膜瘤可能大。
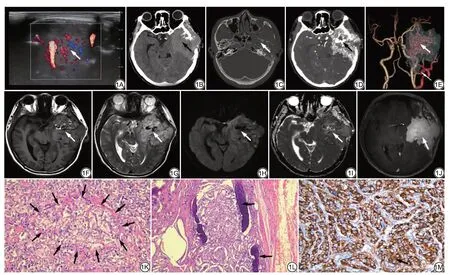
图1 男,41岁,左侧颞部副神经节瘤。1A:头面部超声示左侧头皮下低回声病灶,边界不清,内部可探及丰富血流信号(白箭);1B~1C:头颅CT 平扫横断面示病灶呈软组织密度,边界尚清晰,沟通颅内外生长(黑箭),骨窗示左侧颞骨及蝶窦壁多发骨质破坏(白箭);1D~1E:头颅CTA示左侧颞部肿物明显强化(黑箭),病变由左侧颈外动脉(细箭)分支供血,肿物内见多发迂曲血管影(粗箭);1F~1G:头颅MRI平扫横断面示病灶T1WI呈等信号,T2WI呈稍高信号,内见流空血管信号影(白箭);1H~1I:DWI病灶呈稍高信号(白箭),ADC图病灶呈稍低信号(白箭);1J:T1WI增强病灶呈明显不均匀强化(白箭);1K~1M:术后镜下病理示主细胞聚集成“Zellballen结构”(HE ×200,1K,黑箭),周围血窦丰富,肿瘤细胞胞浆丰富,细胞核轻度异形,肿瘤细胞周围骨组织破坏(HE ×100,1L,黑箭),术后免疫组化示肿瘤组织呈棕黄色,即Syn 阳性(免疫组化:Syn ×100,1M,黑箭)。CTA:CT 血管造影;DWI:扩散加权成像;ADC:表观扩散系数;Zellballen结构:器官样结构;HE:苏木精伊红;Syn:突触素。Fig.1 Male, 41 years old, left temporal paraganglioma.1A: Head and facial ultrasound shows hypoechoic lesions under the left scalp, unclear boundaries, and abundant blood flow signals (white arrow) inside; 1B-1C: Cranial CT sweeping cross-section shows soft tissue density of lesions, clear borders, communication intracranial and extracranial growth (black arrow), bone window shows multiple bone destruction of the left temporal bone and sphenoid sinus wall (white arrow);1D-1E: Cranial CTA shows that the left temporal mass is significantly strengthened (black arrow), the lesion is supplied by the left external carotid artery (thin arrow) branch, and multiple tortuous vascular shadows (thick arrows) are seen in the mass; 1F-1G: Cranial MRI sweeping cross-section shows that the lesion T1WI shows equal signal, T2WI shows slightly higher signal, and the flow empty vascular signal shadow (white arrow) is seen inside; 1H-1I: DWI lesions shows slightly higher signal (white arrow), ADC diagram lesions shows slightly lower signal (white arrow); 1J: T1WI enhancement lesions shows obvious uneven strengthening(white arrow); 1K-1M: Postoperative microscopic pathology shows that the main cells gathered into the "Zellballen structure" (HE ×200, 1K, black arrow), the surrounding blood sinus is abundant, the tumor cell cytoplasm is abundant, and the nucleus is slightly abnormal, destruction of bone tissue around tumor cells (HE ×100, 1L, black arrow), postoperative immunohistochemistry shows that the tumor tissue is brownish-yellow, that is, Syn positive (immunohistochemistry: Syn ×100,1M, black arrow).CTA: computed tomographic angiography; DWI: diffusion weighted imaging; ADC: apparent diffusion coefficient; Zellballen pattern: cell ballen pattern; HE: hematoxylin-eosin; Syn: synaptophysin.
患者在全麻下行“左侧额颞开颅大脑深部病损切除术”,术中见左侧颞部搏动性肿物,呈红褐色,边界欠清,血运丰富,肿物与颞底硬脑膜粘连,左侧颞侧及乳突根部骨质侵蚀严重,骨窦渗血。术后病理检查:大体病理示肿瘤组织呈灰红灰褐色,约9.0 cm×6.0 cm×3.5 cm,切面呈灰白灰黄,质软。镜下病理示肿瘤排列呈巢团状,周围血管丰富,肿瘤细胞胞浆丰富,细胞核轻度异型,可见主细胞排列形成一种特征性的细胞球,称为器官样结构(Zellballen pattern),肿瘤细胞周围骨组织破坏(图1K~1L)。免疫组化结果:CgA(+),NSE(+),SYN(+),CR(-),EMA(-),Vimentin(+),GFAP(-),Oli-2(-),S-100(-),PR(-),CD34(+),Bcl-2(-),STAT6(-),TLE(-),H3K27Me3(+),SSTR(-),CKP(-),Ki-67(5%)。病理诊断:(左侧颞部)神经内分泌肿瘤,结合免疫组化结果(图1M)考虑副神经节瘤(paraganglioma, PGL)。
术后诊疗及随访:患者术中出血量大,约8150 mL,术后给予患者预防癫痫、脱水降颅压、营养补液,预防感染等治疗后,患者出现肺部感染及颅内感染,遂给予抗感染治疗,患者意识恢复,术后30 天CT 示颅脑术后改变,术区积气,术区少量积血,皮下软组织肿胀。继续给予营养补液、脱水降颅压、抗感染、护肝与抗凝等治疗后,患者术后一般情况尚可,术后53 天MRI 示左侧颞部肿瘤术后,术区软化灶形成。患者于术后3 月来我院行影像引导容积旋转调强放射治疗,临床靶区:左侧颅内瘤床区及颅底肿瘤区,计划靶区:临床靶区外扩3 mm,计划放疗剂量为54 Gy,单次剂量为2 Gy,放疗过程中患者未出现明显不适,查血常规未见明显异常。近期电话随访明确,患者一般情况尚可,自诉左侧颞部切口恢复良好,无头痛头晕,另自觉左侧听力轻度减退,记忆力轻度下降,远期预后有待后续随访评价。
讨论 PGL 是起源于神经嵴外胚层细胞的少见神经内分泌系统肿瘤,可发生于全身各部位[1],以靠近交感、副交感神经节区较多见[2]。PGL 主要好发于颈静脉区[3],原发于颅脑者极为罕见。PGL 可发生于任何年龄段,发病高峰年龄为30~50 岁,无明显性别差异。目前PGL 发病机制尚不清楚,部分系基因突变所致[4]。根据PGL 是否有功能,一般分为功能性PGL 和非功能性PGL,由于PGL 分泌激素不同,临床症状多不同,部分患者可出现儿茶酚胺分泌增多的症状,如阵发性或持续性高血压及头痛、心悸、出汗三联征,该类PGL 患者可因儿茶酚胺分泌过量诱发严重心血管疾病,甚至发展多系统功能衰竭[5]。而非功能性PGL 多取决于肿瘤位置、大小、瘤周侵犯而出现局部压迫症状。本例颅内PGL 肿瘤变体积较大,形态不规则,毗邻结构与周围骨质破坏较为严重,结合影像学资料与术中所见,病变与颞底硬膜呈宽基底相连,多考虑本例颅内PGL 起源于左侧中颅窝颞底,其发生机制可能是左侧中颅窝颞底区域神经嵴细胞退化异常[6]而发生肿瘤样改变,导致周围骨质破坏并沟通颅内外生长。
颅内PGL血供丰富,其影像学表现具有一定特征性。颅内PGL 以颅底好发,CT 平扫呈软组织密度肿块,边缘较清晰,邻近颅骨可因肿瘤侵蚀出现骨质破坏,CTA能显示增粗的肿瘤供血动脉,其多为颈外动脉及其分支。MRI 平扫病灶呈T1WI 不均匀低信号,T2WI稍高信号,可见点状、条状流空血管影,形成“椒盐征”,DWI及ADC显示肿瘤实性部分不同程度扩散受限[7]。由于PGL 是富血供肿瘤,瘤体内坏死囊变少见[8],增强扫描肿瘤呈明显强化[9]。本例PGL的影像学与既往研究相符,病灶呈T1WI等信号,T2WI稍高信号,实性部分轻度扩散受限,增强呈明显不均匀强化,在CT上可见左侧颞骨、蝶骨大翼及蝶窦壁多发骨质破坏,在CTA上可见肿瘤由颈外动脉分支供血。
综合本例颅内PGL 的临床及影像学资料,影像学检查在颅内PGL 的诊断中具有重要价值。本例颅脑PGL 具有沟通颅内外生长的特点,可以使用头面部超声探查肿瘤性质,而且颅内PGL 为富血供肿瘤,彩色多普勒和超声造影均可显示其血供情况,但是超声检查对病变定性分析所提供的信息有限,因而患者仍需要进一步地CT 和MRI 检查以明确病变性质。CT 的优势是扫描速度快且密度分辨率高,可以清晰显示肿瘤邻近骨质结构破坏的范围和程度,并且CT 三维重建可以显示肿瘤位置、形态、大小及其与脏器的毗邻关系,进而为手术入路提供依据。此外,CTA 对颅内PGL的诊断具有独特优势,由于CTA能够明确肿瘤供血动脉,进而能够指导术前动脉栓塞的策略制订。但是对于较小的颅内PGL 病变,CT显示不清、或瘤体与毗邻结构分辨不清时,需要行MRI 检查。MRI 的优势在于软组织分辨率高,可以清楚地显示病灶内部信号特征,在颅内PGL 的定位、分期、术后随访及复发监测中具有重要作用,而且MRI 在中枢神经系统肿瘤性病变以及后颅窝和颅颈交界区病变的诊断性能优于CT,但是MRI 扫描时间较长,易产生伪影,因而对患者配合度要求较高。因此,颅内PGL 术前全面的影像学检查可以为其诊断提供详细的定位以及定性信息,以指导临床治疗决策的制订。颅内PGL 需要与以下疾病鉴别:(1)间变型脑膜瘤(anaplastic meningiomas, AAM)为WHO 3 级,占颅内脑膜瘤的1%,青壮年多发,男性多见,部分患者可因邻近脑组织受压导致脑脊液回流障碍,出现颅内压增高症状。AAM 病变多呈蘑菇状、结节状,信号混杂,DWI 序列表现多样,与周围脑组织分界不清,瘤周水肿多见,颅骨破坏多以内板为主,增强呈不均匀强化[10],特征性表现为AAM 的脑膜尾征呈短粗状,部分可呈不规则结节样,一般认为与肿瘤细胞浸润和硬膜反应性结缔组织增生密切相关。(2)颅内孤立性纤维性肿瘤(solitary fibrous tumor ,SFT),约占颅内肿瘤的1%,发病年龄无明显差异,发病年龄为40~45 岁,男性发病率略高于女性,部分患者可因局部脑组织受压出现头痛、肢体乏力及偏瘫等症状。SFT多见于颅底、矢状窦、大脑镰等区域,病灶形态不规则,以分叶状多见,呈T1WI等或低信号,T2WI高信号,易发生囊变、坏死及出血,邻近骨质多呈虫蚀样破坏,增强呈明显强化。由于SFT瘤细胞增殖活跃,在MRS上可出现Cho峰均显著增高、Cho/NAA、Cho/Cr 显著升高[11]。(3)颅内软骨瘤(intracranial chondroma),是一种罕见的颅内原发性肿瘤,约占所有颅内原发性肿瘤的0.2%~0.3%,起源于胚胎软骨残余或由成纤维细胞转化而来,发病年龄为30~40 岁,无明显性别差异。颅内软骨瘤好发于硬膜外,发生于脑实质内者少见,部分患者可因肿瘤体积较大出现癫痫发作以及颅内压增高等症状,由于肿瘤生长缓慢,患者可在数年内无任何症状。在CT平扫上病灶多表现为颅底区或大脑凸面颅板下密度不均分叶状团块,内部可见斑点状或条片状钙化;在MRI多肿瘤呈混杂信号,T1WI 多呈等或稍低信号;T2WI 多呈不均匀高信号,其内可见多发的点状低信号,为肿瘤内部钙化及骨化成分,当肿瘤内软骨基质发生黏液样变性或囊变时可表现为长T1、长T2信号,增强多呈轻到中度强化,部分可出现典型的“蜂窝样”强化征象[12]。
诊断PGL 的金标准是病理学,其中免疫组化对PGL 的诊断具有重要意义,神经元特异性烯醇化酶(neuron-specific enolase, NSE)、嗜铬素A(chromogranin A, CgA)、突触素(synaptophysin, Syn)及支持细胞S-100 蛋白阳性可提示本病的诊断。既往研究认为PGL 均有转移潜能[13],其中PGL 可通过淋巴转移与血行转移至区域淋巴结、肝、肺等部位,因此手术完整切除肿瘤为首选治疗方案[14],而PGL 血供丰富,术中极易出血,本例术中出血约8150 mL,提示术前应行影像学检查明确肿瘤累及范围和肿瘤供血血管,预防术中出血。对于无法根治性手术的PGL 可采用手术减瘤联合姑息性放疗或者全身化疗,常用化疗方案为环磷酰胺、达卡巴嗪和长春新碱[15]。
综上,PGL 发生于颅内极为罕见,颅脑CT 及MRI 检查有助于其诊断,当颅内脑外出现富血供肿瘤,肿瘤周围多发侵蚀性骨质破坏改变以及迂曲增粗的血管影,可以考虑颅内PGL 的可能。此外,颅内PGL 术中极易出血,有望通过术前影像学检查明确颅内PGL 的位置及性质,为颅内PGL 的手术切除治疗提供指导建议。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:周俊林设计本研究的方案,对稿件重要内容进行了修改;卢婷起草和撰写稿件,获取、分析和解释本研究的数据;王媛媛、周凤瑜、董文洁获取、分析以及解释本研究的数据,对稿件重要内容进行了修改;周俊林获得了甘肃省科技计划项目资助。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
