磁共振靶向成像检测心肌纤维化大鼠模型中TGF-β1表达的实验研究
2024-05-20宋梦星夏敏杨雅雯马占龙
宋梦星,夏敏,杨雅雯,马占龙
作者单位 南京医科大学第一附属医院放射科,南京 210029
0 引言
心肌纤维化(myocardial fibrosis, MF)是由细胞外基质蛋白的过度沉积引起的心肌细胞间质的扩张及扩大,是多种心脏疾病的共同常见的病理生理表现。MF 引起心脏重塑,导致心脏收缩功能和舒张功能受损,加速心脏疾病恶化,其持续性进展可能引发心力衰竭甚至死亡等严重不良预后[1]。
目前,磁共振成像(magnetic resonance imaging,MRI)作为一种非侵入性检查方法,已成为MF 定性和定量的重要影像学检查方法[2-4]。对于心脏疾病的诊断,MRI 使用的对比剂主要是含钆对比剂(Gadolinium-based contrast agent, GBCAs),而GBCAs 具有肾毒性,用于急性肾损伤及慢性肾脏病患者可引起神经系统异常聚集,严重影响了对肾功能不全患者的检查;此外普通心脏MRI尚无法精准评估心肌纤维化发展过程中的重要蛋白的变化,这对于心肌纤维化治疗前后动态评估具有一定的限制。而超小超顺磁性氧化铁(ultrasmall supperparamagnetic iron oxide, USPIO)纳米颗粒比GBCAs具有更高的磁性能,肾毒性更低,且具有良好的生物相容性,在血管内循环时间更长,能与特定配体或抗体靶向结合,进而可以实现MR靶向成像,目前已经用于多种心血管疾病的成像研究[5-8]。
转化生长因子-β1(transforming growth factor beta-1,TGF-β1)作为胶原蛋白累积的驱动因素,通过与其受体结合后使Smads 蛋白磷酸化,诱导心肌成纤维细胞转化为肌成纤维细胞,导致I型和Ⅲ型胶原纤维在心肌间质和血管周围的过度沉积,是MF发生发展过程中最重要的因子[9-10]。目前临床中想要获得TGF-β1的表达尚需依赖心肌活检,而心肌活检为有创性检查,不仅存在取样偏差,还可能导致出血、感染、心律失常等严重并发症。目前MRI 已成为评估MF 的主要方法,但利用MRI 检测MF 中TGF-β1 表达的研究尚未见报道。因此,本研究拟以TGF-β1 为靶点,构建靶向TGF-β1 的分子探针,在体检测MF 过程中细胞及蛋白水平的TGF-β1 表达并进行MRI,以期从分子水平到组织和器官水平精准评估心肌纤维化,为临床治疗方案的制订提供有力的实验依据。
1 材料与方法
1.1 试剂与仪器
异丙肾上腺素(isoprenaline, ISO)购自上海麦克林生化科技有限公司;TGF-β1 抗体购自北京博奥森生物技术公司;DSPE-MPEG200、DSPE-PEG 2000-COOH 购自上海艾伟拓医药科技有限公司;普鲁士蓝染液套装、组织化学试剂盒DAB 显色剂、PBS、4%多聚甲醛购自武汉赛维尔生物科技有限公司;NIKON ECLIPSE E100 正置光学显微镜、成像系统(日本尼康)。
1.2 实验动物及分组
选取雄性清洁级SD 大鼠40 只,6 周龄,体质量220~240 g(购自北京维通利华实验动物技术有限公司),随机分为模型组30 只和健康对照组10 只。在温度20 ℃~25 ℃环境中饲养,每天黑暗和光照交替12 h。模型组大鼠皮下注射ISO,5 mg/(kg·d),连续7 d,健康对照组不作处理。采用M 型超声检查,获得左心功能参数,评估模型组大鼠MF 建模情况。本研究经过南京医科大学实验动物伦理委员会审查批准(批准文号:IACUC-2004002-1)。
1.3 超声心动图检查
随机选取模型组与健康对照组大鼠各10只,采用乙醚吸入麻醉方式将实验动物麻醉,充分暴露大鼠胸部,超声心动仪选用Vevo LAB 小动物超声影像系统(VisualSonics公司,加拿大),利用21 MHz线阵探头进行扫描检查。采用胸骨旁长轴切面,测定舒张末期室间隔厚度(end-diastolic dimension interventricular septum thickness, IVSTd);收缩末期室间隔厚度(end-systolic dimension interventricular septum thickness, IVSTs)、舒张末期左室内径(left ventricular end-diastolic dimension, LVEDD)、收缩末期左室内径(left ventricular end-systolic dimension, LVESD)、舒张末期左室后壁厚度(left ventricular end-diastolic posterior wall, LVPWd)、收缩末期左室后壁厚度(left ventricular end-systolic posterior wall , LVPWs)、左室射血分数(ejection fraction, EF)、左室短轴缩短率(fractional shortening, FS)、左室质量(left ventricular mass, LV Mass)、舒张末期左室容积(left ventricular end-diastolic volume, LVEDV)、收缩末期左室容积(left ventricular end- systolic volume, LVESV),获得左心功能参数。
1.4 USPIO-anti-TGF-β1靶向探针的合成及表征
采用化学交联法合成TGF-β1 靶向探针(USPIO-anti-TGF-β1)(图1,由Figdraw 绘制)。分别称取150 mg DSPE-MPEG2000、50 mg DSPE-PEG 2000-COOH,充分溶解于三氯甲烷中;加入10 mg(以Fe计)的Fe3O4@OA纳米颗粒及4 mL去离子水,混匀后在70 ℃水浴锅中蒸发10 min,去除三氯甲烷,获得USPIO(Fe3O4@DSPE-PEG),取1 mg(以Fe 计)USPIO 溶液,分别加入100 μL TGF-β1 抗体,同时加入100 μL 2-(N-吗啉)乙磺酸缓冲液(0.01 M,pH=5.5)调节溶液pH 至5.5,置于25 ℃摇床混匀吸附30 min(120 rpm)。在反应体系中加入0.5 mg EDC进行交联,25 ℃摇床反应4.5 h(120 rpm)。反应结束后,反应液通过磁分离柱纯化,以除去游离的抗体,4 ℃保存。采用透射电子显微镜观察纳米颗粒的形貌特征,动态光散射分析仪测定探针水和粒径及Zeta电位,在7.0 T MRI 下扫描不同浓度的USPIO-anti-TGF-β1 靶向探针,探究其弛豫效能。
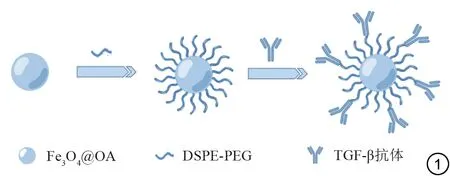
图1 USPIO-anti-TGF-β1靶向探针合成示意图。Fig.1 Schematic diagram of the probe synthesis USPIO-anti-TGF-β1.
1.5 各组大鼠体内MRI
将模型组大鼠随机分为实验组、单纯对照组及空白对照组,每组各10只,所有大鼠在打药前及打药后均进行心脏扫描,采用7.0 T 小动物MRI 仪(Bruker PharmaScans,德国,南京医科大学磁共振影像实验室)进行检测。1.5%异氟烷气体麻醉后,将大鼠固定于扫描床内,并以1.5%异氟烷与空气混合气体维持麻醉状态,接心电门控,调节大鼠的心率维持约300~340 次/min,呼吸频率维持约35 次/min。采用大鼠头部线圈,行T2*序列成像,主要参数如下:视野3 cm×3 cm,矩阵256×256,回波时间3.5 ms,重复时间130 ms,扫描层厚1 mm,翻转角30°。
扫描结束后,实验组予以USPIO-anti-TGF-β1 靶向探针尾静脉注射,剂量为10 mg Fe/kg;单纯对照组予以相同剂量单纯USPIO 纳米颗粒尾静脉注射;空白对照组注射相同剂量生理盐水。12 h后,再次扫描相同层面心脏。
MRI 图像分析手动选择感兴趣区域,在T2*序列图像上每个标本于室间隔及左心室随机选择5个感兴趣区,取其平均值。采用Image J 1.53 软件(National Institutes of Health,美国)计算心肌的MRI 图像信号强度,相对信号强度(relative signal intensity, rSI)定义为同层面心肌信号强度/肌肉信号强度。
1.6 病理学分析
MRI 扫描完成后,将各组大鼠安乐死,固定于手术板,快速分离心肌组织,放于4%多聚甲醛中固定,用于病理切片。分别作普鲁士蓝染色、免疫组化和普鲁士蓝染色,普鲁士蓝染色观察心肌组织纤维化情况,免疫组化观察心肌组织中TGF-β1的表达情况,普鲁士蓝染色观察心肌组织内铁颗粒的沉积。应用Image J 1.53计算心肌胶原容积分数(collagen volume fraction,CVF)[式(1)];采用Image-Pro plus 6.0(Media Cybernetics公司,美国)计算TGF-β1表达(单位面积中的平均吸光度值,作为免疫组织化学结果定量依据)。
1.7 统计学分析
采用SPSS 26.0(International Business Machines Corporation 公司,美国)统计软件,采用Shapiro-Wilk和Levene检验对连续性数据进行正态分布和方差齐性检验,如符合正态分布且方差齐,以±s表示,两两比较采用独立样本t检验进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠MF模型建立的检测结果
M型超声胸骨旁长轴切面显示:与健康对照组大鼠比较,模型组EF、FS降低,LV Mass增加,Vold减小,LVPWd增加,差异具有统计学意义(P<0.05)(表1)。
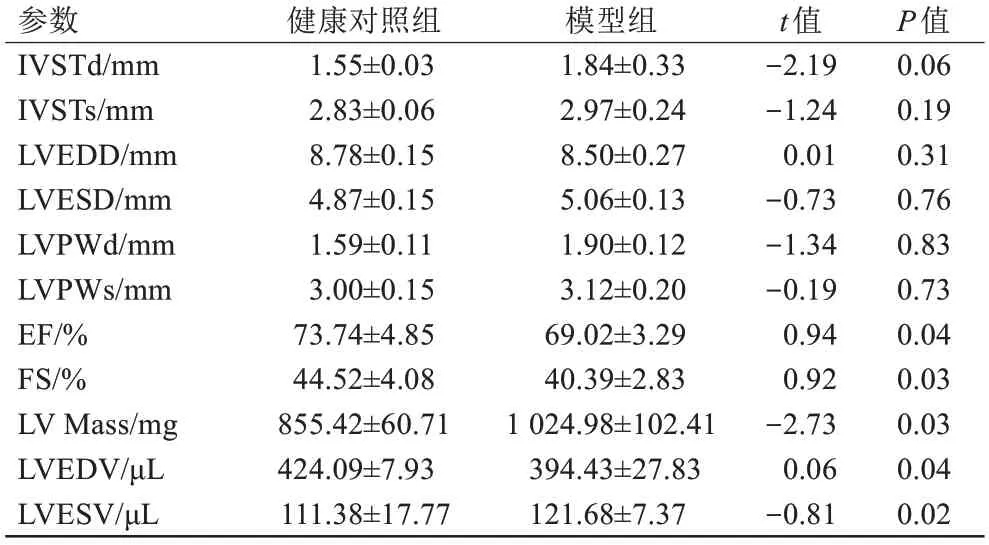
表1 两组大鼠心脏结构参数变化(n=10)Tab.1 Changes in cardiac structural parameters in the two groups of rats (n=10)
2.2 USPIO-anti-TGF-β1 靶向探针合成的鉴定结果及其表征分析
合成的USPIO-anti-TGF-β1靶向探针溶液呈棕色清澈液体,透射电子显微镜下显示探针呈球形或类球形,于PBS中分布均匀,分散性良好(图2A);单纯USPIO水动力学尺寸为(15.55±0.45) nm,USPIO-anti-TGF-β1 靶向探针水动力学尺寸为(23.01±1.75) nm,二者之间差异具有统计学意义(P<0.01),提示成功合成了探针,且USPIO-anti-TGF-β1 靶向探针的水动力学尺寸的分布较窄(图2B),说明探针颗粒分散性较好,没有明显的聚集现象,提示探针的稳定性较好。USPIO 的Zeta 电位为-(46.2±1.38) mV,USPIO-anti-TGF-β1 靶向探针的Zeta 电位为-(23.1±2.69) mV,二者之间差异具有统计学意义(P<0.01)。7.0 T MR 扫描不同浓度探针,可见随探针浓度的增加,信号逐渐减低(图2C);以探针浓度(mg/mL)为横坐标(X),1/T2*为纵坐标作图(图2D),线性回归方程为:Y=1.75X+0.088,R2=0.9976,该探针的T2*弛豫率为1.75/(mg·ms),表明合成探针具有良好的超顺磁性。
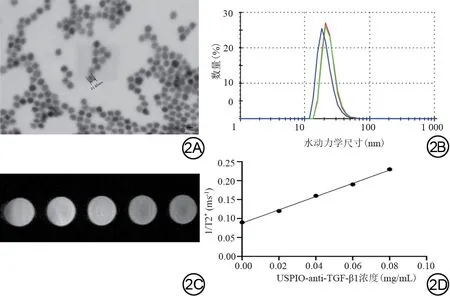
图2 USPIO-anti-TGF-β1 靶向探针的表征结果。2A:透射电子显微镜下USPIO-anti-TGF-β1的形态及分布;2B:USPIO-anti-TGF-β1的水动力学尺寸分布图;2C:从左到右分别为浓度0、0.02、0.04、0.06、0.08 mg/mL的USPIO-anti-TGF-β1 MRI图像;2D:不同浓度的USPIO-anti-TGF-β1与1/T2*关系图。Fig.2 Characterization results of USPIO-anti-TGF- β1 probe.2A:Morphology and distribution of USPIO-anti-TGF-β1 under transmission electron microscopy; 2B: Hydrodynamic size distribution of USPIO-anti-TGF-β1; 2C: USPIO-anti-TGF-β1 MRI at concentrations of 0,0.02, 0.04, 0.06, and 0.08 mg/mL from left to right, respectively; 2D:relationship between different concentrations of USPIO-anti-TGF-β1 and 1/T2*.
2.3 实验组和对照组大鼠体内MRI
7.0 T MR 扫描图像(图3)结果显示:实验组大鼠给药前扫描结果显示心肌信号尚均匀,未见明显低信号区,rSI 为0.72±0.12,给药12 h 后再次扫描结果显示心内膜下心肌可见信号减低区,rSI 为0.62±0.10,二者相比,差异具有统计学意义(P<0.01);单纯对照组大鼠给药前rSI 为0.73±0.12,注射单纯USPIO 12 h 后,心肌信号未见明显减低,rSI 为0.71±0.12,差异无统计学意义(P=0.81)。空白对照组两次扫描信号无明显变化(0.70±0.13 vs.0.73±0.13,P=0.52)。
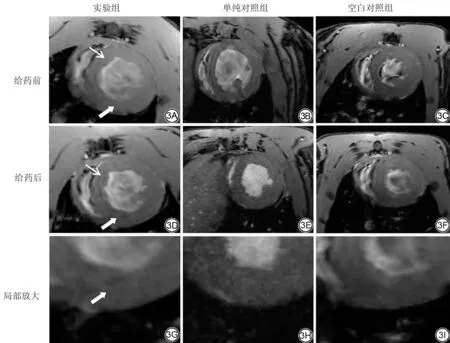
图3 实验组、单纯对照组、空白对照组大鼠心脏7.0 T MR 扫描图像。3A~3C 为给药前扫描图像;3D~3F 为给药后12 h 扫描图像;3G~3I为3D~3F 放大图像;相同类型箭头指示心脏同一部位的信号强度变化。Fig.3 7.0 T MR images of rat hearts of experimental group, the simple control group and the blank control group.3A-3C show the images before administration; 3D-3F represent the images 12 h after administration; 3G-3I are the enlarged images of 3D-3F.Arrows of the same type indicate changes in signal intensity in the same part of the heart.
2.4 模型组与健康对照组大鼠心肌组织病理学分析结果
普鲁士蓝染色显示,模型组大鼠MF 区域主要位于心内膜下,大面积纤维化组织取代正常心肌组织,可见大量蓝染的纤维结缔组织将心肌肌束分隔包绕(图4A、4E);健康对照组大鼠心肌间质胶原纤维数量少、分布规则,肌纤维排列整齐,心肌肌束形态完整(图4C、4G)。与健康对照组大鼠心肌相比,模型组大鼠心肌CVF 明显增高,差异有统计学意义[(2.36±0.29)% vs.(22.51±7.78)%,P<0.01]。

图4 模型组与健康对照组大鼠心肌组织病理学变化及TGF-β1 表达量结果[全景扫描(4A~4D)及×200(4E~4F)]。4A、4E:模型组大鼠心肌普鲁士蓝染色;4B、4F:模型大鼠心肌免疫组化TGF-β1表达;4C、4G:健康对照组大鼠心肌普鲁士蓝染色;4D、4H:空白对照组大鼠心肌免疫组化TGF-β1表达。Fig.4 Pathological changes of myocardial tissue and TGF-β1 expression in rats in the model group and the healthy control group [Panoramic scanning (4A-4D) and ×200(4E-4F)].4A and 4E: Masson staining of rat myocardium in the model group; 4B and 4F: Immunohistochemical TGF-β1 expression in the model rat myocardium; 4C and 4G:Masson staining of rat myocardium in the healthy control group; 4D and 4H: immunohistochemical TGF-β1 expression in rat myocardium in the blank control group.
免疫组化显示,模型组大鼠心肌组织中TGF-β1的阳性表达区主要分布于胶原纤维周围的心肌组织及纤维化区域(图4B、图4F),健康对照组心肌免疫组化显示无明显棕黄色阳性颗粒沉积(图4D、图4H)。与健康对照组相比,模型组大鼠心肌组织TGF-β1 的平均吸光度值明显增高,差异具有统计学意义(0.011±0.003 vs.0.002±0.001,P<0.01)。
普鲁士蓝染色显示,模型组中实验组大鼠心肌中有蓝色铁颗粒沉积(图5A),单纯对照组大鼠心肌中仅有极少的铁颗粒沉积(图5B),空白对照组大鼠心肌中无明显蓝色铁颗粒沉积(图5C)。

图5 实验组、单纯对照组及空白对照组心肌组织铁颗粒沉积情况(×400)。5A~5C 分别为实验组、单纯对照组、空白对照组普鲁士蓝染色结果;箭所示为铁颗粒沉积。Fig.5 Iron particle deposition of myocardial tissue in experimental group,simple control group and blank control group (×400).5A-5C are the results of Prussian blue staining in experimental group, simple control group and blank control group, respectively; the arrow exhibits the iron particle deposition.
3 讨论
本研究构建了USPIO-anti-TGF-β1 靶向探针,通过T2*序列扫描,比较了实验组、单纯对照组及空白对照组注射USPIO-anti-TGF-β1 靶向探针前后的信号变化,结果发现仅实验组大鼠心肌给药前后的信号强度具有显著差异,而单纯对照组及空白对照组给药前后的信号强度无明显变化,验证了MR靶向检测MF大鼠模型中TGF-β1的表达可行。
3.1 以TGF-β1为靶点构建分子靶向探针
心血管疾病严重威胁人类健康,是全球首要死亡原因,而几乎所有类型的心脏疾病的预后好坏都与MF 程度引起的心脏重构及心脏功能下降密切相关[11-12]。TGF-β1 作为MF 过程中最重要的因子[13],能够刺激成纤维细胞的激活和增殖,导致细胞外基质沉积,其表达水平往往与纤维化的严重程度密切相关[14]。多项研究表明,TGF-β1 与受体结合后,通过Smads、p38 MAPK 以及ERK 等信号通路诱导成纤维细胞转化为肌成纤维细胞,产生大量的细胞基质蛋白[15-16],导致MF。此外,TGF-β1 还可以促进心房纤维化,激发心房纤颤、遗传性心肌病及炎症性心肌病[17-18]。TGF-β1 作用的多样性及心脏病变的异质性是防治MF的难点,通过TGF-β1的检测来提高MF的防治水平,具有重要的临床研究价值。
本研究以前期试验为基础[19],选择了通过皮下注射ISO 建立大鼠MF 模型[20-21],通过超声观察到模型组大鼠的左室射血分数及左室短轴缩短率降低,左室质量和左室容积增加,说明本实验成功建立了大鼠MF 模型,这种建模方法成功率高,并且避免了冠脉结扎的手术风险及高死亡率。
USPIO纳米颗粒作为一种阴性对比剂,主要使病灶在T2加权图像上信号减低。USPIO纳米颗粒的表面化学性质可以为特定的生物医学应用而定制,可用于MRI、光热治疗和药物传递,与GBCAs相比不但肾毒性低,且具有更广泛的应用价值[22-24]。USPIO 纳米颗粒能够穿过毛细血管屏障,被单核细胞和巨噬细胞吞噬,从而识别炎症部位[25]。而巨噬细胞在MF中起着重要作用,如经典活化型M1和代替活化型M2的失调可导致过度炎症和心肌损伤[26-27]。此外,巨噬细胞还可通过分泌细胞因子、生长因子和基质细胞蛋白来促进成纤维细胞的转化[28]。目前已有研究证实USPIO纳米颗粒可识别心肌炎、心肌梗死及动脉粥样硬化斑块的形成[29-31]。抗体靶向探针具有特异性强、敏感性高的特点,是靶向成像研究的主要探针合成方法。本研究在前期研究的基础上[32],构建了USPIO-anti-TGF-β1靶向探针,探针表征分析证实性能稳定,为靶向TGF-β1表达,进而探索MF的检测提供了研究基础。
3.2 USPIO-anti-TGF-β1 可用于在体检测MF 中TGF-β1的表达
本研究通过采集给药前后MRI 图像,可见模型组大鼠给药前心肌信号尚均匀,未见明显低信号区,提示早期纤维化定量在MRI 上敏感性较低,诊断较为困难。单纯对照组大鼠注射USPIO 前后信号未见明显降低,可能是由于模型组大鼠的心肌炎症反应处于非活跃状态或巨噬细胞的吞噬作用较弱[33-35],未能被巨噬细胞大量摄取,因此通过注射单纯USPIO行MRI 扫描诊断MF 存在一定的局限性。而实验组在注射USPIO-anti-TGF-β1 探针12 h 后MRI 扫描结果显示心内膜下心肌信号强度明显减低,提示USPIO-anti-TGF-β1 靶向探针在此部位聚集较多。普鲁士蓝染色显示实验组大鼠心肌中蓝色铁颗粒沉积最多,进一步说明USPIO-anti-TGF-β1 靶向探针在MF 区域实现大量聚集,这可能是由于探针的靶向作用引起的。组织病理学结果显示本研究所建的模型组大鼠MF区域主要位于心内膜下,且该区域TGF-β1呈明显高表达,这与MRI 图像上的低信号改变区一致,验证了USPIO-anti-TGF-β1 靶向探针的靶向作用。本研究通过MRI 和病理学相结合,证实MRI 靶向TGF-β1 成像可行,为实现早期MF 的靶向干预提供了坚实的实验依据。
3.3 本研究的局限性
本研究尚存在不足之处:(1)纳入的样本量较少,结果可能存在一定的偏差;(2)成像时间仅选择注射后12 h,仅在各组之间进行了横向对比,并未将注射靶向探针后不同时间的心肌信号改变进行纵向对比,未来将在更大样本量的基础上进一步探究最佳成像时间;(3)实验组在注射靶向探针后普鲁士蓝染色所见铁颗粒沉积量不及TGF-β1表达区域广泛,TGF-β1的表达特异性需进一步验证,通过静脉注射靶向探针是否有其他器官或组织的摄取有待进一步研究。
4 结论
综上所述,本研究所构建的USPIO-anti-TGF-β1靶向探针具有良好的稳定性,可在体检测MF 大鼠模型中TGF-β1 的表达,为临床监测TGF-β1 的表达及抗MF治疗方案的选择和疗效评估提供了实验依据。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:马占龙设计本研究的方案,对稿件重要内容进行了修改,并获得国家自然科学基金项目的资助;宋梦星起草和撰写稿件,获取、分析和解释本研究的数据;夏敏、杨雅雯参与最终病理的获取,并获取、分析或解释本研究的数据,对稿件重要内容进行了修改。全体作者均同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
