MAGiC 技术定量评估原发性骨质疏松症的可行性研究
2024-05-20王文娟邹月芬胡磊刘啸峰柴刘勇
王文娟,邹月芬,胡磊,刘啸峰,柴刘勇
作者单位 1.南京医科大学,南京 211166;2.南京医科大学第一附属医院放射科,南京 210029;3.池州市人民医院放射科,池州247100
0 引言
原发性骨质疏松症是全球广泛存在的一种常见骨代谢性疾病,其主要特征是骨量减少、骨微结构退化和脆性骨折。原发性骨质疏松症通常与年龄增长相关,由于其发病过程隐匿,常容易在出现症状之前被忽视[1]。2018 年一项关于我国骨质疏松症患病率的流行病学调查报告显示:50 岁以上人群患病率达19.2%,65 岁以上人群患病率达32.0%[2]。随着人口老龄化的加剧,患病率预计还在继续增加,预计2050年骨质疏松性脆性骨折人数将达599万,届时将产生高达1745 亿元的医疗支出,这不仅给患者带来严重的健康问题,还将给医疗和社会造成巨大的人力和经济负担[3]。
目前双能X 线吸收测定法(dual-energy X-ray absorptiometry, DEXA)、定量CT(quantitative computed tomography, QCT)为临床常用的骨矿物含量检测方法[4]。DEXA 因操作简单、价廉、辐射剂量低的优势,在过去几十年里一直被作为骨质疏松症的诊断金标准,但DEXA 为2D 投影图像,不可避免地受软组织、血管壁钙化、皮质骨、植入物等的干扰,易导致骨密度(bone mineral density, BMD)值的过高评估和骨折风险的假性降低。QCT 的应用克服了以上局限性,可区分皮质骨和小梁骨,它基于常规CT 成像,利用体模校准和软件分析,获得单位体积内腰椎和股骨近端的骨矿物含量,明显提高了诊断的准确性。QCT虽敏感性较DEXA 高,但额外增加了患者受照射剂量,且骨强度由骨矿物含量与骨质量共同决定[5],单位面积及单位体积内骨矿物含量并不能完全反映骨强度[6-7]。骨质量是除骨密度外反映骨强度全部指标的总称,能够反映骨组织内在结构及分子水平的变化。近些年,关于骨质量要素的磁共振定量研究成为热点。磁共振波谱成像(magnetic resonance spectroscopy, MRS)、弥散加权成像(diffusion weighted image, DWI)、动态对比增强MRI(dynamic contrast enhancement MRI, DCE-MRI)、高分辨率MRI(high-resolution MRI, HR-MRI)、超短回波时间MRI(ultrashort echo-time MRI, UTE-MRI)、魔镜成像(mDixon-Quant)、非对称回波最小二乘估算法迭代水脂分离序列(iterative decomposition of water and fat with echo asymmetry and least-squares estimation quantitation sequence, IDEAL-IQ)等在评估骨质疏松症中虽取得了一定的成果,但各自均存在一定的局限性,且定性还需基于常规MRI检查,额外增加了扫描及后处理时间,另外获得的参数有限,目前还均处在临床前阶段[8]。MRI 集成(magnetic resonance image complication, MAGiC)序列为一站式弛豫定量技术,采用一次多动态多回波序列(multiple dynamic multiple echo, MDME)扫描进行合成重建,可获得多种不同对比度形态学图像和T1-mapping、T2-mapping、PD-mapping 三种定量图谱[9],在满足定性诊断的同时,获取反映组织生物物理特性的多种定量参数。由于扫描采用了一系列180°重聚脉冲,有效避免了磁场不均匀性及磁敏感效应,扫描时间短且无电离辐射。目前,在骨肌系统主要用于椎间盘变性及关节软骨损伤方面的研究[9],对VBQ 进行评估的报道甚少,目前尚无利用QCT作为金标准评估MAGiC序列各参数单独及联合诊断骨质疏松症的报道[10-11]。基于此,本研究旨在探究MAGiC T1WI 的VBQ(VBQ-magic)、T1av、T2av、PDav 值单独及联合应用于原发性骨质疏松症中的价值。
1 材料与方法
1.1 一般资料
前瞻性招募2023 年5 月至2023 年9 月参加池州市人民医院健康体检并完成胸部低剂量CT 的志愿者。所有志愿者均自愿接受常规腰椎MRI 及MAGiC 序列扫描。纳入标准:(1)年龄大于20 岁;(2)已完成胸部低剂量CT 扫描,3 个月内自愿接受常规MRI 及MAGiC 序列扫描的志愿者。排除标准:(1)行胸部低剂量CT时未包全L3椎体;(2)腰椎侧凸畸形;(3)腰椎体骨折及手术史;(4)腰椎体病变、良恶性骨质破坏;(5)代谢性全身性骨病,如严重肝肾疾病、糖尿病、先天性骨代谢异常等;(6)腰椎椎管狭窄,影响脑脊液(cerebrospinal fluid, CSF)信号强度(signal intensity, SI)的测量。本论文研究遵循《赫尔辛基宣言》,符合池州市人民医院伦理委员会要求,经伦理委员会审核并批准(批准号:2023-KY-09),全体受试者均对本研究知情并签署了同意书。
1.2 检查及测量方法
1.2.1 胸部低剂量CT扫描及腰椎BMD测量
采用东软医疗NeuViz Extra 63 排CT 机进行扫描,扫描条件:管电压120 kV,管电流50 mAs,层厚5.0 mm。在CT 基础上利用非同步定量CT 骨密度分析系统(QCT PRO V6.1,Mindways 公司,美国)的QCT 校准体模进行数据的校准,数据上传至QCT 后处理工作站进行BMD值的测量,通过三平面定位,避开骨皮质及椎基静脉,在L1~L3椎体中央偏前位置设置最大程度感兴趣区(region of interest, ROI),分别测量L1~L3椎体BMD值,取其平均值为最终测量结果。依据QCT 诊断标准[12]进行分组:骨量正常组BMD>120 mg/cm3,骨量减少组BMD 介于80~120 mg/cm3之间,骨质疏松组BMD<80 mg/cm3。
1.2.2 腰椎常规MRI 及MAGiC 序列扫描及定量参数测量
采用美国GE SIGNA Architect 3.0 T 磁共振进行腰椎常规矢状位T1 快速自旋回波(fast spin echo,FSE)序列(TR 733 ms,TE 7.8 ms,层厚4.0 mm,视野320 mm×320 mm)、T2 快速反转自旋回波(fast recovery fast spin echo, FRFSE)序列(TR 2699.0 ms,TE 102 ms,层厚4 mm,视野320 mm×320 mm)、T2 FLEX序列(TR 2123 ms,TE 102 ms,层厚4 mm,视野320 mm×320 mm)扫描,扫描时长4 min 32 s。同时进行MAGiC 序列(TR 4000 ms,TE 19.3、89.2 ms,层厚4 mm,视野280 mm×280 mm)扫描,扫描时长4 min 8 s。使用MAGiC 后处理应用程序生成T1WI、T2WI、T1-mapping、T2-mapping 以及PD-mapping 三组定量图谱,并保存及上传至影像存储及传输系统(picture archiving and communication systems,PACS)。
VBQ 评分基于骨质疏松症患者椎体骨小梁萎缩和脂肪浸润所引起的T1WI 像SI 增加,通过测量T1WI 像L1~L4 椎体SI,取其平均值,并除以L3 CSF SI 进行标准化来表达患者的骨质量,从而实现患者之间的比较[13]。椎体ROI 的放置要求:(1)避开皮质骨和椎基静脉;(2)ROI覆盖尽可能多的骨小梁区域,ROI 因椎体形状和大小不要求一致;(3)测量时选取正中矢状切面。CSF ROI 置于L3 椎体后方,避开突出的椎间盘、硬膜外脂肪、下行神经根等组织(图1A)。
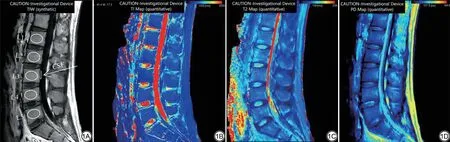
图1 男,34 岁,健康志愿者。1A:MAGiC T1WI 图像;1B:T1-mapping 图谱;1C:T2-mapping 图谱;1D:PD-mapping 图谱。MAGiC T1WI 图上勾画ROI,测量L1~L4椎体及L3平面脑脊液SI,测量L1~L5椎体T1、T2、PD值,计算获得VBQ-magic值为3.36,T1av值为511.60 ms,T2av值为80.40 ms,PDav值为74.68 pu。MAGiC:MRI集成;ROI:感兴趣区;SI:信号强度;PD:质子密度;VBQ:椎体骨质量;T1av:平均T1弛豫时间;T2av:平均T2弛豫时间;PDav:平均质子密度。Fig.1 Male, 34 years old, health volunteer.1A: MAGiC T1WI; 1B: T1-mapping; 1C: T2-mapping; 1D: PD-mapping.ROI is outlined in the MAGiC T1WI map.Measurement of SI in the L1-L4 vertebral and L3 plane cerebrospinal fluid.Measurement of L1-L5 vertebral T1, T2, PD values.The VBQ-magic value is 3.36, the T1av value is 511.60 ms, the T2av value is 80.40 ms, the PDav value is 74.68 pu.MAGiC: magnetic resonance image compilation; ROI: region of interest; SI: signal intensity; VBQ: vertebral bone quality; T1av: average T1 relaxation time; T2av: average T2 relaxation time; PDav: average proton density.
在PACS 系统利用相同的标准分别测量常规T1 及MAGiC T1 L1~L4 椎体及L3 平面CSF SI,利用公式VBQ=SI(L1~L4)/SI(L3 CSF)分别计算常规T1 VBQ 值及MAGiC T1 VBQ-magic 值。利用MAGiC软件在T1WI 序列正中矢状位勾画L1~L5 椎体ROI,勾画标准同VBQ 的测量,分别测量T1、T2、PD 值(图1B~1D),并取相应平均值T1av、T2av、PDav值为最终结果。
1.2.3 一致性检验
从研究的总样本中随机抽取64 位志愿者资料,由2 名经过培训的年资分别为9 年及11 年的主治医师先后独立进行VBQ-magic、T1av、T2av、PDav 值测量及计算,进一步验证观察者间数据的可重复性。
1.3 统计学方法
采用Med Calc 20.0软件及SPSS 26.0软件进行统计学分析。采用组内相关系数(intra-class correlation coefficient, ICC)评价观察者间数据的一致性,ICC<0.4 表示信度较差,0.4≤ICC≤0.75 表示信度一般,ICC>0.75 代表信度较好。对所有计量资料进行正态性检验,符合正态性分布的数据以(±s)表示,不符合正态分布的数据以M(P25,P75)表示。三组间年龄、BMI、VBQ、VBQ-magic、T1av、T2av、PDav 值比较采用单因素方差分析或Kruskal-Wallis非参数秩和检验,两两比较采用LSD法或Wilcoxon检验。采用Pearson或Spearman相关系数分析各参数与BMD 的相关性。将差异有统计学意义的参数分别使用logistic回归建立单因素及多因素联合诊断模型,通过绘制受试者工作特征(receiver operating characteristic curve, ROC)曲线分析单独及联合参数对骨量减少及骨质疏松的诊断效能。曲线下面积(area under the curve, AUC)的比较采用Z检验。以P<0.05为差异有统计学意义。
2 结果
2.1 入组资料
本研究最终纳入128名健康志愿者,骨量正常组63 例,骨量减少组43 例,骨质疏松组22 例。其中男62 名,女66 名,年龄23~81 岁,中位年龄52 岁。三组间年龄差异均有统计学意义(P均<0.001)。
2.2 各参数差异性比较
除BMI 外,三组间VBQ、VBQ-magic、T1av、T2av、PDav 值差异均有统计学意义(表1)。组间两两比较结果显示:(1)VBQ、VBQ-magic 值各组间两两比较差异均有统计学意义(P≤0.009),骨质疏松组VBQ-magic 值大于骨量减少及骨量正常组(P=0.009、P<0.001),骨量减少组VBQ-magic 值大于骨量正常组(P<0.001);(2)T1av 值在骨量正常组大于骨量减少组及骨质疏松组(P均=0.001),骨量减少组与骨质疏松组间差异无统计学意义(P>0.05);(3)T2av值在骨质疏松组大于骨量减少组及骨量正常组(P均<0.001),骨量减少组与骨量正常组间差异无统计学意义(P>0.05);(4)PDav值在骨量正常组小于骨量减少组及骨质疏松组(P=0.007、P=0.043),骨量减少组与骨质疏松组间差异无统计学意义(P>0.05)。
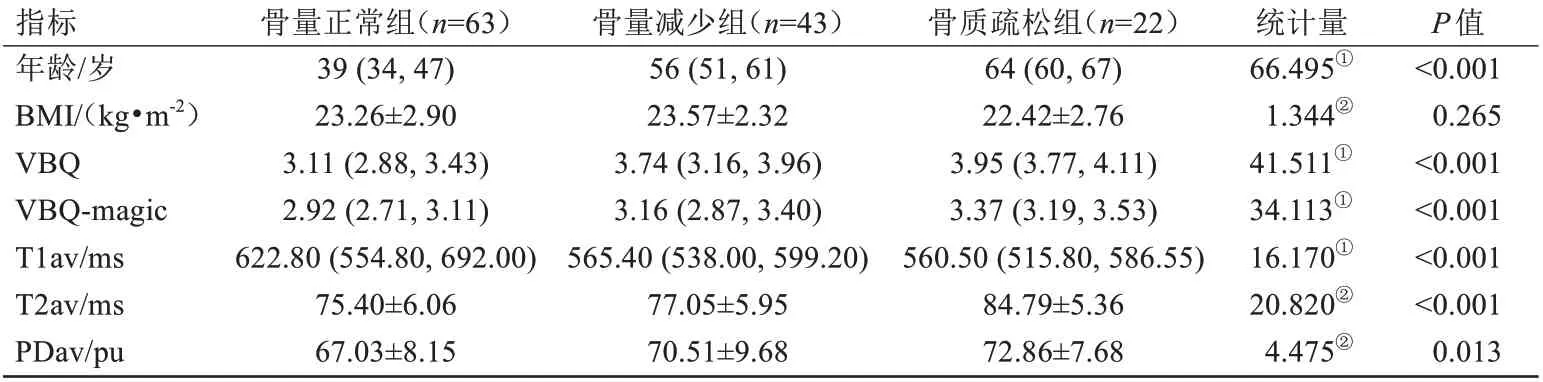
表1 一般资料及各定量参数比较Tab.1 Comparison of general information and each quantitative parameter
2.3 数据一致性检验
结果显示VBQ-magic、T1av、T2av、PDav 的ICC分别为0.965、0.955、0.982、0.965,均显示出较好的观察者间信度。
2.4 各参数与BMD的相关性
年龄、VBQ 与BMD 均呈强负相关,r值及其95%置信区间(confidence interval,CI)分别为-0.740(-0.815~-0.637)、-0.651(-0.742~-0.534),P均<0.001;VBQ-magic与BMD 呈中等负相关,r(95%CI)=-0.524(-0.649~-0.384),P<0.001;T1av 与BMD 呈中等正相关,r(95%CI)=0.403(0.245~0.546),P<0.001;T2av[r(95%CI)=-0.365(-0.490~-0.201),P<0.001]、PDav [r(95%CI)=-0.224(-0.365~-0.077)]与BMD呈弱负相关(图2)。

图2 各参数与BMD值相关性散点图。BMD:骨密度;VBQ-magic:基于MAGiC序列的椎体骨质量;T1av:平均T1弛豫时间;T2av:平均T2弛豫时间;PDav:平均质子密度。Fig.2 Scatterplot of the correlation of each parameter with BMD values.BMD: bone mineral density; VBQ-magic: vertebral bone quality based on MAGiC sequence; T1av: average T1 relaxation time; T2av: average T2 relaxation time; PDav: average proton density.
2.5 单参数及联合参数对骨量减少及骨质疏松的诊断效能
以骨量减少为阳性事件,VBQ、VBQ-magic、T1av、VBQ-magic+T1av 诊断的AUC 分别为0.798、0.772、0.702、0.782(表2、图3A)。VBQ-magic、VBQ-magic+T1av 分别与VBQ 间对骨量减少的诊断效能差异均无统计学意义(P=0.442、0.668)。

表2 各参数评估骨量减少的诊断效能Tab.2 Diagnostic efficacy of each parameter in assessing bone loss

图3 单参数及联合参数的受试者工作特征(ROC)曲线。3A:预测骨量减少的ROC 曲线;3B:预测骨质疏松的ROC 曲线。VBQ:基于常规MRI序列的椎体骨质量;VBQ-magic:基于MAGiC 序列的椎体骨质量;T1av:平均T1弛豫时间;T2av:平均T2弛豫时间。Fig.3 Receiver operating characteristic (ROC) curve of single and combined parameters.3A: ROC curves for predicting bone loss; 3B: ROC curves for predicting osteoporosis.VBQ: vertebral bone quality based on conventional MRI sequence; VBQ-magic: vertebral bone quality based on MAGiC sequence; T1av: average T1 relaxation time; T2av: average T2 relaxation time.
以骨质疏松为阳性事件,VBQ、VBQ-magic、T2av、VBQ-magic+T2av 诊断的AUC 分别为0.845、0.810、0.867、0.803(表3、图3B)。VBQ-magic、VBQ-magic+T2av 分别与VBQ 间对骨质疏松的诊断效能差异均无统计学意义(P=0.323、0.446)。

表3 各参数评估骨质疏松的诊断效能Tab.3 Diagnostic efficacy of each parameter to assess osteoporosis
3 讨论
鉴于MAGiC 技术用于腰椎成像的可行性[14],本研究探讨了基于MAGiC 序列的VBQ-magic 评分、T1、T2及PD值与BMD的相关性,并分析其诊断骨量减少及骨质疏松的价值。VBQ-magic、T1av、T2av 与BMD有一定的相关性,PDav与BMD的相关性较弱,VBQ-magic 单独及联合T1av、T2av 对骨量减少及骨质疏松均具有一定的诊断价值,且VBQ-magic+T1av联合诊断骨量减少的效能有所提升。MAGiC技术在骨质疏松症筛查及诊断方面具有良好的应用前景。
3.1 基于MAGiC的VBQ-magic评分价值
VBQ-magic 评分是建立在EHRESMAN 等[13]学者提出的常规MRI 评估患者VBQ 的基础之上,由于人体CSF 组成相对恒定,利用L3 平面CSF SI 作为基线进行标准化,VBQ 评分可实现不同患者在不同机型、不同场强及不同参数下的对比[15]。本研究中,VBQ-magic 在各组间差异均具有统计学意义,骨质疏松组>骨量减少组>骨量正常组,且VBQ-magic 与BMD呈中等负相关,同VBQ与BMD的相关性相当。伴随骨质疏松的发生,VBQ-magic 呈递增趋势,这正与骨质疏松症患者椎体骨小梁退化,BMD下降,脂肪细胞增多,从而引起T1WI 上SI 增加的机制相呼应[16]。HAFFER 等[17]学者也通过研究证明了VBQ 与μCT 确定的小梁微观结构之间显著的相关性。VBQ-magic 评分提供了额外的骨质量信息,可作为BMD 的补充。近3 年国内外关于VBQ 评分的大量研究[18-23]表明VBQ评分可成为预测骨质疏松、脆性骨折、腰椎椎弓根螺钉松动及融合器下沉风险的良好评估工具,值得临床推广应用。本研究进一步评估VBQ-magic 对骨量减少及骨质疏松的诊断效能中发现,VBQ-magic 对骨量减少具有良好的预测能力(AUC=0.772),敏感度、特异度、阳性预测值及阴性预测值均显示良好;VBQ-magic对骨质疏松具有一定的预测能力(AUC=0.810),敏感度及阴性预测值显示良好,但特异度及阳性预测值略偏低,提示筛查过程中可能有部分病例存在假阳性。SALZMANN等[24]及ROCH 等[25]的研究显示VBQ 评分鉴别骨量减少与骨量正常患者的AUC 分别为0.708、0.713,KIM 等[26]的研究显示VBQ 预测骨质疏松的AUC 为0.754。本文研究结果与以上学者的结果相似,且VBQ-magic 与VBQ 的诊断效能无明显差异,进一步确立了VBQ-magic 评分可成为预测骨量减少及骨质疏松的良好评估方法。
3.2 MAGiC定量参数T1、T2及PD值的诊断价值
利用MAGiC 定量图谱可直接测量组织T1、T2 及PD 值,可作为间接反映组织微结构变化的指标。在评价椎体骨质量方面的研究甚少。一项针对62 位症状性腰椎退行性疾病患者开展的MAGiC 定量初步研究[10]显示,PD 值与DEXA T 值呈中度负相关(r=-0.565),T1、T2与T值相关性极弱,PD值被认为是骨量减少及骨质疏松的极好预测因子。而在本研究中,PDav 与BMD 值的相关性较弱(r=-0.224),T1av、T2av 却表现出与BMD 较好的相关性(r=0.403、-0.365),进一步通过ROC 曲线分析,T1av 对骨量减少有一定的预测能力,VBQ-magic+T1av 联合诊断骨量减少的效能有所提高;T2av 对骨质疏松有一定的预测能力,但VBQ-magic+T2av联合诊断骨质疏松的效能略下降,但特异度有所提升,降低了诊断的误诊率。最新的一项探讨中老年女性骨质量变化的定量研究[11]与我们的结果相符,T1、T2 值与BMD 值呈中度相关,且诊断OP 具有较高的准确性。相比以上研究,本研究样本量更大,招募志愿者时严格控制了不同年龄段及性别的人数,覆盖面更广,降低了选择偏倚性,且使用精准度更高的QCT结果作为诊断标准,使我们的结果更具说服力。
3.3 T1、T2及PD值的反应机制
本研究与既往多项研究[27-28]均显示T1与BMD值相关性较好,即伴随骨量减少,T1值逐渐缩短。我们认为T1值的缩短与骨小梁退化及骨髓脂肪化密切相关。由于椎体脂肪含量与增龄相关的骨质疏松有关,骨小梁减少,间隙增宽,被脂肪组织所填充,导致椎体脂肪含量增加[29-31];骨髓脂肪组织的T1值与体积骨密度、骨体积分数、骨小梁厚度呈正相关,骨髓脂肪化程度间接反映了松质骨的骨密度及微结构[28]。我们的研究与TOKGÖZ 等[32]的发现类似,骨质疏松组T2av 值大于骨量减少组及骨量正常组,T2av 值随着BMD 的降低而增加。原因可能为:松质骨由骨小梁与交织分布其内的骨髓组织所构成,骨小梁网络结构会影响骨髓MR特性,骨小梁和骨髓界面的磁化效应增加会缩短T2 值[33],反之,骨小梁退化导致骨小梁与骨髓界面磁化效应降低,T2值会延长[34]。另外骨质疏松患者骨组织孔隙率增加,其内游离水及总水含量随之增加,结合水含量随羟基磷灰石晶体、胶原蛋白等基质的降低而减少[35-37],较高的T2值与骨水含量的增加和胶原基质的紊乱有关[38-39]。人体水和脂肪氢质子含量最高,骨髓组织主要由水与脂肪成分所组成,因此PD值主要反映骨髓中水与脂肪含量的变化,同时受孔隙水、胶原结合水及胶原本身质子的影响[40]。本研究中骨量减少与骨质疏松组PDav值高于骨量正常组,可能也与骨髓中水与脂肪含量增加有关,但这种变化在骨量减少与骨质疏松组间无明显差异。
3.4 局限性及展望
本研究存在一些局限性:首先,骨质疏松组数据相对较少,可能存在选择偏倚,后续将进一步细化纳排标准,收集更多样本量;其次,骨髓微环境除受年龄、骨密度、水及脂肪组织的影响外,还受女性雌激素、组织扩散特性及微循环灌注等的影响[41],后续将探索其与MAGiC 各定量参数相互作用的机制;最后,关于T1、T2、PD 值在骨质疏松症中的研究结果仍然存在部分矛盾的地方,还需进行多中心研究,扩大样本量,建立更加稳定的模型。
4 结论
我们的数据表明,VBQ-magic、T1av、T2av 对骨量减少及骨质疏松具有一定的诊断价值,且诊断骨量减少时联合参数效能有所提升,MAGiC 序列有望成为骨质疏松症新的筛查及诊断工具。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:王文娟参与选题及设计,获取、分析及解释本研究的数据,起草和撰写稿件,获得了池州市2023年度社会发展领域科技攻关项目资金资助;邹月芬参与选题及设计,分析及解释本研究的数据,对稿件重要内容进行了修改;胡磊、刘啸峰、柴刘勇获取、分析及解释本研究的数据,对稿件重要内容进行了修改。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
