多参数MRI联合影像组学在鉴别PI-RADS 4~5分前列腺病灶良恶性中的应用分析
2024-05-20祝丽孟婕王欢欢李丹燕
祝丽,孟婕,王欢欢,李丹燕
作者单位 南京大学医学院附属鼓楼医院医学影像科,南京 210009
0 引言
前列腺影像报告数据系统(prostate imaging reporting and data system, PI-RADS)在放射学界及泌尿外科学界已经得到了广泛认可,在临床和科研中广泛应用[1-2]。PI-RADS v2.1使用5分制,依据病灶在T2WI、弥散加权成像(diffusion weighted imaging,DWI)及动态对比增强(dynamic contrast enhanced,DCE)序列上的不同表现来评估临床有意义癌可能性的高低[3-4]。其中4~5分提示病灶为临床有意义癌的可能性很高,应考虑穿刺活检明确诊断[5]。但相关研究显示,PI-RADS 4~5 分病灶活检病理的诊断阳性率仅为59%[6],另有研究表明PI-RADS 4分病灶和PI-RADS 5分病灶的活检阳性率分别为22.1%和72.4%[7]。这些研究揭示了PI-RADS 评分与病理结果的不匹配,不准确的评分常导致4~5 分病灶的过度治疗,给患者及社会医疗都造成了不必要的负担。例如非特异性肉芽肿性前列腺炎(nonspecific granulomatous prostatitis,NSGP)在影像上就常被误诊为前列腺癌[8]。因此,提高PI-RADS 4~5 分病灶的诊断准确性对于临床诊疗有着极其重要的指导意义。
影像组学是一种利用计算机,提取医学影像学数据中的高通量特征,并筛选出其中有价值的影像学特征的技术方法,近年来已经被广泛应用于临床和科学研究中[9-11]。基于多参数MRI(multiparametric MRI, mpMRI)的影像组学也已经被应用到前列腺癌的诊断及侵袭性评估中[12-15]。有研究显示,基于T2WI 和表观弥散系数(apparent diffusion coefficient,ADC)序列特征的影像组学可以有效鉴别前列腺癌和其他病变[16]。另有研究成功构建机器学习模型用于评估PI-RADS 3 分病灶的良恶性[17-19]。但目前为止,针对PI-RADS 4~5 分前列腺病灶良恶性鉴别的相关影像学研究仍然较少。
本研究利用mpMRI 联合影像组学,旨在构建能够有效区分PI-RADS 4~5 分前列腺病灶良恶性的模型,帮助提高诊断准确性,为临床诊疗提供更加有力的指导。
1 材料与方法
1.1 一般资料
本研究为回顾性研究,遵守《赫尔辛基宣言》,通过了南京鼓楼医院医学伦理委员会批准,免除患者知情同意,批准文号:2021-301-11。
收集2018 年1 月至2021 年6 月在我院行前列腺多参数MRI(multiparametric MRI, mpMRI)检查后PI-RADS 评分为4~5 分患者的临床及影像资料。入组标准:(1)患者在穿刺活检或手术前接受mpMRI检查,且检查结果提示前列腺病灶为PI-RADS 4~5 分;(2)所有mpMRI 检查均在同一台3.0 T MRI 上完成;(3)穿刺活检或手术后均经病理证实,且病理结果与MRI 检查之间间隔不超过2 个月。排除标准如下:(1)MRI 检查前接受过任何形式的治疗(包括化疗、放疗及手术治疗);(2)MRI 图像伪影严重导致病灶显示不清,影响数据分析;(3)病理数据或临床数据缺失。根据良性病变入组患者年龄匹配随机选择恶性病例进行分析。
1.2 MRI扫描方法
所有入组患者均在同一台3.0 T扫描仪(uMR770,United Imaging, Shanghai, China)上接受检查,配套使用12 通道体部线圈。扫描序列包括横断位T1WI(TR=720 ms,TE=13 ms),T2WI(TR=3400 ms,TE=95 ms)和DWI 序列(TR=5100 ms,TE=80 ms,b 值=50、1000、1500 s/mm2),FOV 为26 cm×22 cm,层厚为3 mm,层间距为0,层数为24。ADC图由后处理软件自动生成,全流程扫描时间约15 min。
1.3 mpMRI图像及数据分析
本研究数据分析使用了T2WI、DWI(b值1500 s/mm2)和相应ADC 序列。所有的MRI 图像阅片由两名经验丰富的影像科医生(医生1:7年前列腺MRI阅片经验;医生2:10 年前列腺MRI 阅片经验)单独进行,两位医生根据最新PI-RADS v2.1 进行诊断和给出评分(图1)。当两名医生意见不一致时,经共同商议讨论后最终决定病灶评分。若为多发病灶则记录最大病灶,病灶PI-RADS 4~5 分且与病理提示病灶位置一致时入组。最终本组研究共有135 个病灶用于影像组学分析。
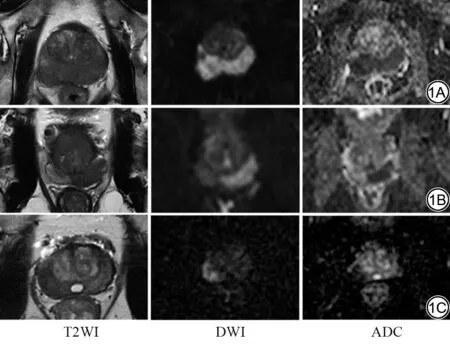
图1 PI-RADS 评分5 分的前列腺外周带病灶。1A:男,79 岁,tPSA 为8.06 ng/mL,T2WI提示两侧外周带弥漫性低信号,DWI(b=1500 s/mm2)呈高信号,ADC图显示为低信号,ADC值为0.778×10-3 mm2/s,术后病理结果提示为NSGP;1B:男,72岁,tPSA 为4.44 ng/mL,T2WI可见左侧外周带弥漫性低信号,测量ADC 值为0.798×10-3 mm2/s,术后病理提示为炎症;1C:男,70 岁,tPSA 为8.56 ng/mL,T2WI 可见右侧外周带弥漫性低信号,测量ADC值为0.612×10-3 mm2/s,术后病理提示前列腺癌。PI-RADS:前列腺影像报告数据系统;tPSA:总前列腺特异性抗原;DWI:弥散加权成像;ADC:表观弥散系数;NSGP:非特异性肉芽肿性前列腺炎。Fig.1 PI-RADS 5 lesions located in peripheral zone.1A: A 79-year old man with a serum tPSA of 8.06 ng/mL, mpMRI shows bilateral mid peripheral zone lesion, the lesion shows restricted diffusion on ADC maps and DWI (b=1500 s/mm2) with ADC value of 0.778×10-3 mm2/s.Postoperative pathological diagnosis revealed NSGP.1B: A 72-year old man with a serum tPSA of 4.44 ng/mL,mpMRI shows left mid peripheral zone lesion with ADC value of 0.798×10-3 mm2/s.Postoperative pathological diagnosis revealed inflammation.1C: A 70-year old man with a serum tPSA of 8.56 ng/mL.mpMRI shows right mid peripheral zone lesion with ADC value of 0.612×10-3 mm2/s.Postoperative pathological diagnosis revealed prostate cancer.PI-RADS: prostate imaging reporting and data system; tPSA: total prostate specific antigen; mpMRI:multiparametric MRI; ADC: apparent diffusion coefficient; DWI: diffusion weighted imaging; NSGP: nonspecific granulomatous prostatitis.
1.4 病灶分割
入组的PI-RADS 4~5 分病灶以DICOM 格式导入工作站(IntelliSpace Discovery version 3.0, ISD,Philips Healthcare, Best, the Netherlands)后,医生1 参照病理结果行逐层手动勾画病灶全容积。边界不清的病灶交由医师2共同参与勾画,确定勾画边界。勾画时无需避开病灶内的坏死、钙化和出血,以真实反映肿瘤的异质性。
1.5 影像组学分析
本研究中影像组学分析流程包括了特征提取、特征筛选、模型构建和模型验证(图2)。

图2 影像组学工作流程。LR:逻辑回归;SVM:支持向量机;NB:朴树贝叶斯。Fig.2 Flow chart of radiomics.LR: logistic regression; SVM: support vector machine; NB: naive Bayes.
1.5.1 特征提取
特征提取使用Pyradiomic 软件,T2WI、DWI 及ADC 三种模态分别提取出960 个特征,包括一阶统计特征、形状特征、纹理特征、LoG特征和小波特征,共计2880 个特征。特征提取前使用Z-score 标准化对MRI图像进行标准化处理。随机选取20个病例计算特征的组内相关系数(intra-class correlation coefficient,ICC),用以评估观察者间一致性,ICC>0.75认为可重复性较好,ICC≤0.75的特征则被剔除。
1.5.2 特征筛选
对训练集数据进行筛选,剔除对分类器性能影响较小的影像组学特征,筛选出最优特征子集(图3)。具体分为三个步骤:一致性分析、Mann-WhitneyU检验和最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)回归。首先对每个模态中提取的所有特征通过观察者间ICC 系数(>0.75的特征)保留;然后采用Mann-WhitneyU检验比较研究对象间组学特征的组间差异,保留P<0.05 的特征;为了降低特征冗余,提高模型分类准确性,最后通过LASSO 回归算法和十折交叉验证法进行降维和进一步组学特征筛选。
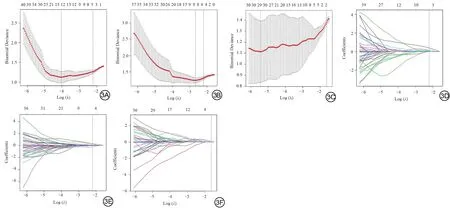
图3 T2WI、DWI 及ADC 模态下分别使用LASSO 回归对影像组学特征进行筛选。3A~3C:LASSO 通过十折交叉验证调节不同参数得到最佳惩罚系数λ(lambda)。以实现模型二项式偏差最小的λ值来选择特征。用最小准则和最小准则的1个标准误差(1-SE准则)在最优值处绘制垂线虚线。3D~3F:根据Log(λ)序列绘制了影像特征的拉索系数剖面图,每条曲线代表一个特征的系数变化轨迹,横坐标表示参数,纵坐标表示系数。DWI:弥散加权成像;ADC:表观弥散系数;LASSO:最小绝对收缩和选择算子;SE:标准误差。Fig.3 Feature selection using the LASSO regression model on T2WI (3A, 3D),DWI (3B, 3E) and ADC (3C, 3F).3A-3C: Tuning parameters λ in the LASSO model used 10-fold cross-validation via minimum criteria.Dotted vertical lines are drawn at the optimal values with the minimum criteria and the 1 standard error of the minimum criteria (the 1-SE criteria).3D-3F: LASSO coefficient profiles of different features are produced against the log (λ) sequence.LASSO: least absolute shrinkage and selection operator; DWI: diffusion weighted imaging; ADC: apparent diffusion coefficient; SE: standard error.
1.5.3 影像组学模型的建立和验证
本研究分别使用逻辑回归(logistic regression,LR)、支持向量机(support vector machine, SVM)和朴树贝叶斯(naive Bayes, NB)三种不同的方法来进行模型训练,并使用受试者工作特征(receiver operating characteristic, ROC)曲线的曲线下面积(area under the curve, AUC)来评估不同分类器的性能,选出最佳分类器。最终利用筛选后的特征建立Radscore。
1.6 统计学分析
本研究的统计分析均在Rstudio(version 4.1.3,2022; The R Foundation for Statistical Computing,Vienna, Austria)上进行。符合正态分布的计量资料使用平均数±标准差表示。采用独立样本t检验比较两组间连续变量的差异,采用卡方检验比较两组间分类变量的差异。采用Mann-WhitneyU检验比较研究对象间组学特征的组间差异。使用ROC曲线评价模型的诊断效能,并计算AUC、敏感度、特异度和准确度。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
135例患者病例被纳入本研究(表1),病理证实为良性病变共64例(47.41%),其中非特异性肉芽肿性前列腺炎21个,间质慢性炎31个,间质慢性炎伴急性活动7个,急性前列腺炎2个,增生2个,腺病1个。根据年龄匹配随机选择恶性病例71例(52.59%),最终组织病理结果均为腺癌。将入组数据按7∶3的比例随机分为训练集95例、测试集40例。两组之间ADC值和总前列腺特异性抗原(total Prostate specific antigen,tPSA)值差异有统计学意义(P<0.001、0.028)。

表1 一般资料Tab.1 Characteristics of all patients
2.2 影像组学特征提取、筛选
本研究从T2WI、DWI 及ADC 三种模态分别提取出960 个特征,共计2880 个特征。通过一致性分析,Mann-WhitneyU检验和LASSO 回归算法筛选后,最终保留8个特征:ADC模态2个特征,DWI模态2 个特征,T2WI 模态4 个特征用于构建分类模型,其中包括一阶特征3 个,形状特征2 个,直方图特征1个,小波特征6个(表2)。

表2 MRI不同模态鉴别PI-RADS 4~5分前列腺病变的组学特征Tab 2 Radiomic feature selection results
2.3 基于不同分类器单模态影像组学模型诊断效能
本研究分别使用LR、SVM 和NB 三种不同的方法来进行模型训练,结果显示LR 模型优于其他两种模型(图4)。基于不同分类器的单模态影像组学模型在训练集、测试集中的结果显示ADC 单模态基于LR分类器在PI-RADS 4~5分前列腺病变的良恶性鉴别诊断中展现了最优的诊断效能(训练集:0.831,测试集:0.825)。

图4 基于T2WI(4A、4D)、DWI(4B、4E)及ADC(4C、4F)模态不同分类器模型鉴别PI-RADS 4~5 分病变良恶性的ROC 曲线图。4A~4C:训练集;4D~4F:测试集。DWI:弥散加权成像,ADC:表观弥散系数;PI-RADS:前列腺影像报告数据系统;ROC:受试者工作特征。Fig.4 ROC curves of different models based on T2WI (4A, 4D), DWI(4B, 4E), and ADC (4C, 4F) in predicting malignancy of PI-RADS 4-5 lesions.4A-4C: Training set; 4D-4F: Test set.ROC: receiver operating characteristic; DWI: diffusion weighted imaging; ADC: apparent diffusion coefficient; PI-RADS: prostate lesions prostate imaging reporting and data system.
2.4 多模态影像组学建模特征
将筛选后的12个组学特征纳入构建多模态影像组学模型,经过LASSO 回归后保留个8 特征,包括:2 个为基于ADC 模态的特征log.sigma.3.0.mm.3D_firstorder_MeanAbsoluteDeviation和wavelet.HHL_glrlm_RunEntropy;2 个为基于DWI 模态的特征original_firstorder_Skewness 和wavelet.LLH_glcm_Idn;4 个为基于T2WI 模态的特征original_shape_Elongation、wavelet.LLH_glcm_Correlation、wavelet.LLH_glrlm_RunEntropy和wavelet.LLL_glszm_GrayLevelVariance。
使用线性公式[式(1)]计算每位患者的影像组学分数(radiomics score, Radscore)。
2.5 模型诊断效能及临床应用
训练集与测试集中影像组学分数在良恶性两组患者中呈现出明显的分布差异(图5)。

图5 影像组学分数(Radscore)区分PI-RADS 4~5分前列腺病灶良恶性的瀑布图。5A:训练集;5B:测试集。PI-RADS:前列腺影像报告数据系统。Fig.5 Waterfall plots of the distribution of radiomics score (Radscore) of each patient.5A: training set; 5B: test set.PI-RADS: prostate lesions prostate imaging reporting and data system.
以影像组学分数和ADC 值为基础构建诺模图(图6),训练集中结果显示,诺模图的鉴别诊断效能(AUC=0.952)高于mpMRI 组学(AUC=0.942)和ADC 值(AUC=0.870)。而在验证集中,mpMRI 组学的鉴别诊断效能(AUC=0.850)高于诺模图(AUC=0.842)和ADC 值(AUC=0.772)(图7)。临床决策曲线分析(clinical decision curve, DCA)提示当风险阈值大于43%时使用mpMRI 影像组学联合ADC 值的诺模图预测良恶性比使用ADC值效益更高(图8)。

图6 鉴别PI-RADS 4~5 分前列腺病灶良恶性的诺模图。图7 不同模型鉴别PI-RADS 4~5 分前列腺病灶良恶性ROC 曲线。7A:训练集;7B:测试集。图8 模型鉴别PI-RADS 4~5 分前列腺病灶良恶性的临床决策曲线。PI-RADS:前列腺影像报告数据系统;ADC:表观弥散系数;Radscore:影像组学分数;ROC:受试者工作特征;Integration:联合模型(多模态影像组学联合传统参数ADC 值);Multi-Modality:多模态影像组学模型[T2WI、弥散加权成像(DWI)、ADC三种模态]。Fig.6 Nomogram of the combined model in predicting malignancy of PI-RADS 4-5 lesions.Fig.7 Receiver operating characteristic (ROC) curve of different models in predicting malignancy of PI-RADS 4-5 lesions.Fig.8 Decision curve of radiomics nomogram and ADC value in predicting malignancy of PI-RADS 4-5 lesions.PI-RADS: prostate lesions prostate imaging reporting and data system; ADC: apparent diffusion coefficient; Radscore: radiomics score; Integration: the model combined radiomics and ADC value; Multi-Modality: the model based on mpMRI [T2WI, diffusion weighted imaging (DWI) and ADC].
3 讨论
本研究通过比较传统参数(ADC 值、PSA)及影像组学在鉴别PI-RADS 4~5 分前列腺病灶良恶性中的表现,旨在构建更加有效的临床诊断模型。研究结果表明传统参数和影像组学特征都可以帮助鉴别诊断,但传统参数与影像组学二者联合的模型较单一模型诊断效能更高(训练集、测试集中的AUC分别为0.952、0.842)。
3.1 传统参数在PI-RADS 4~5分前列腺良恶性病灶之间的差异分析
PSA检查是临床筛查前列腺癌最常用的实验室指标,但特异性较低[20]。DJAVAN 等[21]的研究显示tPSA鉴别前列腺癌和良性前列腺增生的敏感度仅为19%,提示仅依据tPSA筛查前列腺癌远远不够。但PSA仍然是一个很好的参考,不少研究表明PI-RADS v2.1联合PSA 密度(PSA density, PSAD)可以有效提高诊断效能[22-23]。本研究结果显示良性病变组的tPSA 水平[(12.02±9.11) ng/mL]略低于恶性病变组[(15.68±10.09) ng/mL],但后续统计结果提示tPSA 诊断前列腺病变良恶性效能并不高(AUC=0.636),因此我们仍需要探索更加有效的临床指标。
目前PI-RADS v2.1 指南中对于外周带病灶的评分主要依据高b值DWI图像和其对应ADC图上的表现[3],ADC值尚未被纳入参考。但恶性肿瘤由于组织内水分子扩散受限,ADC 值常低于良性病变[24-25]。多个研究表明ADC 值与Gleason 评分呈负相关[26-28],提示ADC值可以帮助前列腺病灶的良恶性判断。本研究结果也证实了A D C值在两组之间有显著差异,这与既往研究结果类似。
3.2 影像组学在鉴别PI-RADS 4~5分前列腺病灶良恶性中的优势
影像组学运用大量自动化数据和特征化算法,可以将医学图像转变成海量数据,从中发掘出肉眼难以发现的病变特点,进一步定量分析肿瘤的异质性,提供更多信息用以帮助肿瘤的早期诊断及疗效监测[9,29]。本研究中,我们尝试了三种不同的算法:LR、SVM 和NB,结果显示基于LR算法构建的模型展现了最佳诊断效能,这一结果与CHRISTODOULOU 等[30]之前的研究相符。
在单模态MRI 影像组学模型分析中,我们发现基于ADC 的模型诊断效能表现最佳。多模态MRI(T2WI、DWI、ADC)影像组学和传统参数(ADC 值)的联合模型拥有更出色的诊断效能(训练集AUC=0.952,验证集AUC=0.842),且明显优于单模态MRI影像组学模型和单纯ADC值。LI等[31]之前的研究也有类似结论,他们的研究结果显示临床-影像组学联合模型(AUC=0.98)预测前列腺病灶良恶性的效能比单一临床模型(AUC=0.79)更高。他们研究中的临床-影像组学联合模型(AUC=0.98)的诊断效能也优于本研究的联合模型,这可能是由于他们的研究中纳入了更为精细的临床参数,包括年龄、前列腺体积(prostate volume, PV)和不同类型血清PSA(包括tPSA、游离态PSA、游离态PSA 与tPSA 比值及PSAD),因此具有更高的诊断效能。此外,本研究针对PI-RADS 4~5 分的病灶,范围更窄,鉴别诊断难度更高,不同的样本范围可能也是导致结果差异的原因。WOŹNICKI等[32]的研究也表明临床-影像组学联合模型的对前列腺癌诊断效能更高,他们创建的模型综合了PI-RADS、PSAD、直肠指检(digital rectal examination, DRE)和影像组学,预测效能(AUC=0.889)介于LI 等的研究和本研究之间,这可能是由于他们使用的临床参数少于LI 等的研究,但又多于本研究。除了构建诊断模型,本研究还提供了放射组学列线图,方便临床医生更简单、直观地评估PI-RADS 4~5病变的良恶性。
值得一提的是,本研究所收集的良性病例中有21 例(32.81%)病理证实为NSGP。NSGP 是一种少见的自限性炎性病变,目前认为其发病原因可能是继发于非特异性感染、前列腺穿刺或梗阻后激发的自身免疫功能紊乱等,其临床表现及影像学检查表现都可与前列腺癌类似,给临床诊断造成很大的困难[8,33]。也有不少针对前列腺癌和NSGP 鉴别诊断的文章[34],LEE 等[35]的研究表明肉芽肿性前列腺炎(granulomatous prostatitis, GP)病灶的平均ADC 值为(702±79)×10-6mm/s2,这与本研究的结果大致相仿(746±116)×10-6mm/s2。本研究所构建的机器学习模型可以有效区分前列腺良性病灶和前列腺癌,这其中也包括了NSGP。但本次研究样本限制在PI-RADS 4~5 分病灶,不足以覆盖各类良性病变,因此还需要在更大样本量中进行验证。
3.3 本研究的局限性
本研究存在以下局限性:首先,作为一项单中心的回顾性研究,样本量有限,仍需要在未来更大样本量的多中心研究中进行验证;其次,本研究的病理结果来自手术和穿刺活检两种途径,实际勾画的病灶与病理病灶有可能存在偏差,而穿刺活检的病理样本由于取材的局限性也可能造成一定偏差。在今后的研究中,我们将进一步扩大样本量,招募前列腺根治术后有完整大病理切片的患者进一步验证。
4 总结
综合多模态MRI(T2WI、DWI、ADC)影像组学和传统参数的模型能有效帮助鉴别PI-RADS 4~5 分病灶的良恶性,且其预测效能优于基于单模态MRI模型或传统参数,有望为前列腺病变的诊断和治疗提供更加精准的辅助。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:李丹燕设计本研究的方案,对稿件重要内容进行了修改,获得了2022 年度南京鼓楼医院临床研究专项资金项目资助;祝丽起草和撰写稿件,获取、分析和解释本研究的数据,对稿件重要内容进行了修改;孟婕及王欢欢获取、分析和解释本研究的数据,对稿件重要内容进行了修改。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
