CMR影像组学联合临床因素预测肥厚型心肌病并发室性心律失常的价值
2024-05-20吕静朱永琪朱彦芳何瑛胡茜邵九杰王艺霖王霈刘云朱力
吕静,朱永琪,朱彦芳,何瑛,胡茜,邵九杰,王艺霖,王霈,刘云,朱力*
作者单位 1.宁夏医科大学第一临床医学院,银川 750004;2.宁夏回族自治区人民医院医学影像中心,银川 750002;3.银川市妇幼保健院放射科,银川 750299;4.宁夏医科大学总医院放射科,银川 750004
0 引言
肥厚型心肌病(hypertrophic cardiomyopathy, HCM)是一种临床表现差异较大的遗传性心脏病[1-3],部分HCM 患者临床无症状,部分HCM 患者以心脏性猝死(sudden cardiac death, SCD)为首发表现。SCD 是HCM 相关性死亡最常见的原因[4],成人HCM 患者SCD 的年发病率约为1%,在儿童HCM 患者中更高[5-6],而发生SCD 的主要机制是致命性室性心律失常(ventricular arrhythmias, VAs)[7-8]。临床工作中,评估HCM 患者是否合并VAs主要依赖常规十二导联心电图检查(12 lead electrocardiogram, 12 lead ECG)及24 h动态心电图(24-hour dynamic electrocardiogram, 24 h DCG),但存在部分VAs未被检测出而导致漏诊[9-10]及不能预测HCM 合并VAs 等缺点,致使部分患者失去就诊机会。因此,一种能便捷准确评估及预测HCM患者并发VAs 风险及危险分层的方法对于HCM 患者合并VAs 的诊断及HCM 患者的预后评估十分重要。有研究表明HCM 患者心肌广泛纤维化是心律失常的基质,心电图检查所评估的心律失常起源与心脏磁共振成像延迟强化(cardiovascular magnetic resonance late gadolinium enhancement, CMR-LGE)纤维化区域密切相关[10]。CMR-LGE 是HCM 患者心肌纤维化定性及定量分析的金标准[11-12],目前已有不少研究致力于探讨HCM 患者延迟强化(late gadolinium enhancement, LGE)心肌与VAs 之间的关系[13-15],但观察者难以通过视觉对LGE 区域作出准确可靠的定性定量评估,且CMR-LGE是对比剂过敏及肾功能受损患者的禁忌证。影像组学是基于提取肉眼难以识别的视觉数据,通过定量图像分析获取反映疾病特定过程信息的技术[16-17],可用于更准确诊断和预测临床结果[18]。目前已有研究[19]证明基于CMR的影像组学可识别与HCM 患者室性心动过速病史相关的LGE纹理特征,继而在HCM 患者危险分层及预后评估方面提供有用信息,但尚未有基于CMR 常规未增强序列的影像组学方法评估及预测HCM 患者并发VAs 风险及危险分层报道。因此,本研究旨在通过提取HCM 患者基于CMR 未增强亮血电影序列的影像组学特征,并联合临床因素,构建预测HCM患者是否存在合并VAs 风险的影像组学预测模型、临床预测模型及联合预测模型,为敏感且定量的识别HCM 患者发生VAs 的病变心肌基质、早期预警HCM 患者VAs 发生提供新策略,有助于临床建立更为早期完善的预防治疗系统,提高患者预后。
1 材料与方法
1.1 一般资料
本研究遵循《赫尔辛基宣言》,所有方法均按照相关的指导方针和规定进行,并获得宁夏医科大学总医院伦理委员会批准,免除受试者知情同意,批准文号:KYLL-2023-0401。回顾性分析2018 年1 月1 日至2023 年5 月31 日在宁夏医科大学总医院放射科行CMR 检查并符合纳入、排除标准的HCM 患者的CMR 影像资料及相关临床资料。HCM 患者的纳入标准:(1)符合欧洲心脏病协会制定的HCM 临床诊断标准,任何心脏影像学检查显示一个或多个左心室心肌节段舒张末期室壁厚度≥15 mm(无家族史)或≥13 mm(有家族史),除外其他可引起心室壁增厚的生理因素、心血管疾病或全身性疾病[7];(2)具备完整的CMR 影像资料及临床资料;(3)具有24 h DCG检查结果,且距行CMR 间隔时间≤6 个月。排除标准:(1)合并其他的心脏疾病,如心肌梗死、主动脉瓣狭窄、心脏瓣膜病、高血压等;(2)图像质量差;(3)心脏行射频消融术后。
1.2 检查方法
采用飞利浦公司Ingenia 3.0 T 超导磁共振仪进行心脏扫描。扫描仪器、受试者扫描前准备、心脏定位及扫描序列同笔者前期的研究[20]。
1.3 影像资料及临床信息的收集
从宁夏医科大学总医院图像存储和通信系统中检索并获取HCM 患者的DICOM 格式CMR 图像。通过宁夏医科大学总医院电子病历系统来收集HCM患者的临床资料,包括HCM 患者的性别、年龄、身高、体质量、体表面积(body surface area, BSA)、身体质量指数(body mass index, BMI)、心率及晕厥史或既往晕厥史。回顾性采集受试者近期超声心动图(ultrasound cardiogram, UCG)(超声诊断仪,GE vividE95,挪威)结果,近期(≤6个月)的12 lead ECG结果是否存在VAs、ST-T 段异常、T 波异常、左心室高电压。将采集到的从二尖瓣水平至心尖部的左心室短轴电影序列导入飞利浦公司Ingenia 3.0 T超导磁共振仪配套的图像和信息管理软件(IntelliSpacePortal 9.0),自动勾画心脏收缩期及舒张期每帧图像上心内膜心外膜的边界并进行手动修正,得到CMR 左心功能参数及测量值。
1.4 图像处理、分割及影像组学特征的提取
将所有HCM 患者的CMR 图像以DICOM 格式导入Python 软件(https://www.python.org, version3.7)的SimpleITK 代码包中进行N4偏置场矫正。选择从二尖瓣水平至心尖部的左心室短轴未增强亮血电影序列导入3D Slicer(https://www.slicer.org,version 5.0.3)中进行左心室心肌肥厚区域与非肥厚区域的区分和感兴趣区(region of Interest, ROI)勾画。在左心室短轴各层面心肌的心室舒张末期测量舒张末期壁厚(end-diastolic wall thickness, EDWT)以区分HCM患者心肌的肥厚区域及非肥厚区域。肥厚区域诊断标准:无HCM 家族史,EDWT≥15 mm;有HCM家族史,EDWT≥13 mm。非肥厚区域诊断标准:无HCM家族史,EDWT<15 m;有HCM家族史,EDWT<13 mm。在左心室短轴各层面心肌的心室舒张末期进行全室壁心肌、肥厚区域心肌及非肥厚区域心肌的ROI 勾画,仔细避开心内外膜及乳头肌,防止产生噪声和部分容积效应。由两位具有5年以上HCM 诊断经验的放射科主治医师分别勾画ROI,1 周后再行第二次ROI 勾画,提取以上ROI 影像组学特征并行测量者间及测量者自身一致性评估。勾画的ROI 图像及原始图像以.nii格式进行保存,用Python 软件的“Pyradiomics”包从图像提取特征。在提取特征之前,使用线性插值算法将图像重采样到1 mm×1 mm×1 mm(x, y, z)的坐标,将像素空间标准化。
1.5 特征筛选及模型的建立
影像组学特征筛选方式同笔者前期的研究[20]。将筛选得到的最优影像组学特征子集使用logistic回归模型建立影像组学模型,并结合加权系数构建每位患者的影像组学评分。采用单-多变量logistic 回归分析筛选出差异有统计学意义(P<0.05)的临床因素构建临床因素模型。将差异有统计学意义(P<0.05)的临床因素和影像组学评分结合建立联合模型,并绘制列线图将联合模型可视化。
1.6 统计学分析
采用SPSS 25.0软件(https://www.ibm.com/support/pages/downloading-ibm-spss-statistics-25)对临床资料和左心参数进行统计分析。符合正态分布的连续变量以xˉ±s表示,组间比较采用两独立样本t检验;不符合正态分布的连续变量使用中位数(四分位间距)表示,采用Mann-WhitneyU检验;两组间的分类变量比较采用χ2检验或Fisher 精确检验。使用Python 代码包对影像组学特征进行一致性检验。根据约登指数得出敏感度、特异度、准确度、阳性预测值(positive predictive value, PPV)、阴性预测值(negative predictive value, NPV)和采用受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under the curve,AUC)分别评价各个模型的效能;用AUC值及DeLong检验比较各个模型的效能,P<0.05认为差异有统计学意义。用Hosmer-Lemeshow检验(H-L检验)评估联合模型的拟合度,并绘制其校准曲线,P>0.05 表示拟合度良好。通过决策曲线分析(decision curve analysis,DCA)观察各模型的临床应用价值。
2 结果
2.1 临床资料
最终经过纳入与排除标准筛选,共计122 例HCM 患者纳入本研究,根据24 h DCG 结果分为两组,其中未合并VAs 组82 例,合并VAs 组40 例。用分层抽样的方法将HCM 患者以7∶3的比例分为训练集和测试集,训练集与测试集间的临床资料比较结果详见表1。χ2检验结果示合并VAs 的HCM 患者分布在训练集、测试集间差异无统计学意义(P>0.05),可以用于模型的建立与验证。

表1 训练集及测试集中HCM未合并VAs组与合并VAs组比较Tab.1 Comparison between HCM uncomplicated by VAs group and HCM complicated by VAs group in training set and test set
2.2 构建临床模型
通过单因素logistic 回归分析筛选出身高、BSA、体质量、左心房内径、左室壁最大厚度、QT 间期时长、NT-ProBNP、UCG 左心参数[左心室射血分数(left ventricular ejection fraction, LVEF)、左心室舒张末期容积(left ventricular end systolic volume,LVESV)]及CMR左心参数[左心室每搏量、左心室每分输出量、心指数、LVESV、LVESV 指数(LVESV index, LVESVI)、左心室舒张末期室壁质量(left ventricular end diastolic wall mass, LVED wall mass)]共15 个有统计学意义的因素(P<0.05)。由于单因素logistic 回归分析筛选出的有统计学意义因素较多,先将其进行最小绝对收缩与选择算法(least absolute shrinkage and selection operator, LASSO)回归得到系数不为0 的临床因素,再进行多因素logistic 回归并利用向前法逐步筛选,最终筛选出QT 间期时长、UCG 测得的LVEF、CMR 测得的LVED wall mass 及LVEDVI 共4 个临床因素(表2),构建临床因素模型。

表2 多因素logistic回归分析Tab.2 Multiple logistic aggression analysis
2.3 构建影像组学模型
从每位患者的左心室全心肌、左心室肥厚区域心肌及左心室非肥厚区域心肌中均提取出1133个特征,经组内及组间一致性检验(intra-/inter- classcorrelation coefficient, ICC)选取ICC>0.75 的特征后,剩余615、604、490 个特征,随后进行Mann-WhitneyU检验、RFE选出前100个最优特征、基于“glmnet”包的LASSO及十倍交叉验证进行特征降维,选择出最优特征共27 个(其中基于左心室全心肌7 个、左心室肥厚区域心肌10 个、左心室非肥厚区域心肌10 个)。基于这些特征结合加权系数构建每个患者影像组学评分。
2.4 构建联合模型
本研究共构建3种类型的模型:类型一,通过多因素logistic 回归分析筛选出4 个临床危险因素,包括UCG-LVEF、CMR-LVED wall mass、CMR-LVEDVI、QT 间期时长,建立临床因素模型;类型二,将不同ROI提取到的影像组学特征经过筛选得到最优特征,采用逻辑回归模型构建影像组学模型,包括左心室全心肌影像组学模型、左心室肥厚区域心肌影像组学模型、左心室非肥厚区域心肌影像组学模型;类型三,基于临床危险因素与影像组学评分建立联合模型,包括左心室全心肌联合模型、左心室肥厚区域心肌联合模型、左心室非肥厚区域心肌联合模型;绘制列线图将3个联合模型可视化,如图1所示。

图1 联合模型列线图。1A:左心室全心肌联合模型列线图;1B:左心室肥厚区域心肌联合模型列线图;1C:左心室非肥厚区域心肌联合模型列线图。CMR-LVEDVI:心脏磁共振测得的左心室舒张末期容积指数;UCG-LVEF:超声心动图测得的左心室射血分数;CMR-LVED wall mass:心脏磁共振测得的左心室舒张末期室壁质量。Fig.1 Nomogram of the the combined model.1A: Nomogram of the the combined model of left ventricular whole myocardium; 1B: Nomogram of the combined model of left ventricular hypertrophic regions myocardium; 1C: Nomogram of the combined model of left ventricular non-hypertrophic regions myocardium.CMR-LVEDVI: cardiovascular magnetic resonance left ventricular end diastolic volume index; UCG-LVEF: ultrasound cardiogram left ventricular ejection fraction;CMR-LVED wall mass: cardiovascular magnetic resonance left ventricular end diastolic wall mass.
2.5 模型的效能评估
各模型的训练集及测试集ROC 曲线及AUC 值如图2 所示。各模型训练集及测试集的AUC 值(95%置信区间)、敏感度、特异度、准确度、PPV、NPV如表3~4所示,各个模型均表现出良好的鉴别能力。
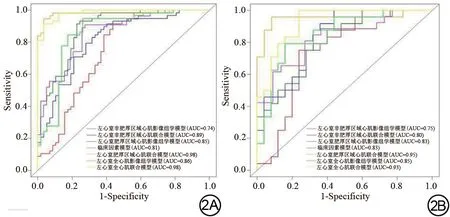
图2 训练集(2A)及测试集(2B)的受试者工作特征曲线。AUC:曲线下面积。Fig.2 The receiver operating characteristic curve of the training set (2A)and the test set (2B).AUC: area under the curve.

表3 训练集中不同模型的预测性能Tab.3 Predictive performance of different models in the training set

表4 测试集中不同模型的预测性能Tab.4 Predictive performance of different models in the test set
对训练集及测试集各模型进行DeLong检验。
在训练集中,首先,对3种类型的模型进行比较,结果显示临床因素模型的AUC 值与3 个影像组学模型的AUC值差异均无统计学意义(P>0.05);3个联合模型的AUC 值均高于其对应的影像组学模型(P<0.05),亦高于临床因素模型(P<0.05)。接着,对3个组学模型进行比较,3个组学模型的AUC值差异无统计学意义(P>0.05)。最后,对3个联合模型进行比较,左心室非肥厚区域心肌联合模型的AUC值小于左心室肥厚区域心肌联合模型及左心室全心肌联合模型(P<0.05),左心室肥厚区域心肌联合模型与左心室全心肌联合模型的AUC 值差异无统计学意义(P>0.05)。在训练集中,左心室全心肌联合模型及左心室肥厚区域心肌联合模型的AUC值高于其他模型(P<0.05)。
在测试集中,首先,对3种类型的模型进行比较,结果显示临床因素模型的AUC 值与3 个影像组学模型、3 个联合模型的AUC 值差异无统计学意义(P>0.05);在影像组学模型与联合模型的比较中,左心室非肥厚区域心肌影像组学模型及左心室肥厚区域心肌联合模型的AUC值低于左心室全心肌联合模型的AUC 值(P<0.05)。接着,对3 个组学模型进行比较,3 个组学模型的AUC 值差异无统计学意义(P>0.05)。最后,对3 个联合模型进行比较,左心室肥厚区域心肌联合模型的AUC值高于左心室非肥厚区域心肌联合模型(P<0.05)。在测试集中,左心室肥厚区域心肌联合模型为最优模型,其AUC 值、特异度、敏感度、准确度、NPV 及PPV 分别为0.95、91.67%、95.83%、93.75%、95.65%及92.00%。
H-L检验显示联合模型在训练集(左心室肥厚区域心肌联合模型P=0.69;左心室全心肌联合模型P=0.16;左心室非肥厚区域心肌联合模型P=0.96)和测试集(左心室肥厚区域心肌联合模型P=0.19;左心室全心肌联合模型P=0.34)中均具有较好的拟合度,且校准曲线显示联合模型的预测结果和实际观察结果一致性较好(图3)。其中左心室非肥厚区域心肌联合模型(P<0.01)拟合度较差。

图3 各联合模型训练集及测试集的校准曲线。3A:左心室肥厚区域心肌联合模型训练集校准曲线;3B:左心室全心肌联合模型训练集校准曲线;3C:左心室非肥厚区域心肌联合模型训练集校准曲线;3D:左心室肥厚区域心肌联合模型测试集校准曲线;3E:左心室全心肌联合模型测试集校准曲线;3F:左心室非肥厚区域心肌联合模型测试集校准曲线。Fig.3 Calibration curves of training sets and test sets of each combined model.3A: Calibration curve of the combined model of left ventricular hypertrophic regions myocardium of the training set; 3B:Calibration curve of the combined model of left ventricular whole myocardium of the training set;3C: Calibration curve of the combined model of left ventricular non-hypertrophic regions myocardium of the training set; 3D: Calibration curve of the combined model of left ventricular hypertrophic regions myocardium of the test set; 3E:Calibration curve of the combined model of left ventricular whole myocardium of the test set; 3F: Calibration curve of the combined model of left ventricular non-hypertrophic regions myocardium of the test set.
决策曲线(图4)提示本研究构建的各个模型临床适用性较高。

图4 各模型训练集(4A)及测试集(4B)的决策曲线。Fig.4 Decision curves of each model's training set (4A) and test set (4B).
3 讨论
本研究初步探讨基于CMR 未增强亮血电影序列影像组学模型对HCM 患者是否合并VAs 的预测价值,结果显示,本研究中构建的临床因素模型、3 个影像组学模型及3个联合模型均具有较好预测效能。在训练集及测试集中,结合临床因素及影像组学特征的联合模型效能高于影像组学模型,表明临床因素与影像组学特征结合可更好地预测HCM 患者是否合并VAs。本研究还对基于左心室全心肌、左心室非肥厚区域心肌及左心室肥厚区域心肌3 个不同ROI 所构建的模型进行比较,结果显示,训练集中左心室非肥厚区域心肌联合模型的效能小于左心室肥厚区域心肌联合模型和左心室全心肌联合模型,测试集中左心室非肥厚区域心肌联合模型的效能小于左心室肥厚区域心肌联合模型,这说明基于不同区域心肌构建的预测模型效能不同。
3.1 临床因素预测HCM者合并VAs的价值
本研究中多因素logistic 分析显示UCG-LVEF、CMR-LVED wall mass、QT 间期时长是HCM 患者并发VAs的独立危险因素,CMR-LVEDVI是HCM 患者并发VAs 的保护因素。有研究[21]结果显示已发生心血管不良事件HCM 患者的LVEF 显著高于未发生心血管不良事件HCM 患者,这与本研究UCG-LVEF 是HCM患者并发VAs的独立危险因素一致。处于病程早期的HCM患者心室壁的不均匀肥厚会导致左心室腔缩小及流出道狭窄,继而出现左心室内压力增高;虽然病变区域心肌收缩能力降低,但为维持正常的心排量,正常区域心肌的代偿使得左心室收缩功能正常甚至增高,LVEF 值增高[1,22],因此LVEF 可作为HCM 患者并发心律失常的独立危险因素。CMR-LVED wall mass 的增加意味着左心室室壁肥厚程度增加,随着室壁肥厚程度增加,部分心肌细胞因心肌细胞能量消耗及微血管功能障碍等因素而死亡,继而被成纤维细胞代替,出现心肌纤维化,影响心脏电传导,使患者出现VAs[23-24]。有研究[24]指出左心室肥厚是HCM 患者出现VAs 的危险因素,也有研究[25]证实有室性心动过速HCM 者的左室肥厚明显多于无室性心动过速患者,均与本研究结果一致,说明CMR-LVED wall mass 是预测HCM 患者VAs 发生的一个重要指标,提示在临床工作中应重视这一心功能参数。本研究中,合并VAs 者的QT 间期时长大于未合并VAs 者,QT 间期延长说明心脏复极时间延长,复极时间延长与其他因素的共同作用会导致心肌电传导功能障碍,出现室内单向传导阻滞和折返激动,进而导致VAs 的发生[26]。LVEDVI 是评价心脏舒张功能的重要指标,在一定范围内,HCM 患者的LVEDVI值越高说明心脏舒张功能越好,反映了心肌受损程度越低,心律失常发生率越低,因此LVEDVI是HCM 患者并发VAs 的保护因素。CMR-LVEDVI作为可方便快捷获取的CMR 常规测量参数,为临床预测HCM 患者是否并发VAs 提供又一个重要评价指标。综上所述,经多因素logistic 分析得出的独立危险因素和保护因素反映了HCM 患者心肌的结构及功能特点,对预测HCM 患者是否并发VAs 有着重要的价值。
3.2 影像组学预测HCM者是否合并VAs的价值
影像组学分析可从图像中提取高维的定量特征,在一定程度上反映生物医学图像中隐藏的潜在病理生理学信息,用以辅助临床医师的诊断[27-29]。大量研究[30-32]认为HCM 患者左心室心肌解剖及结构基质方面的异常主要包括广泛心肌纤维化、心肌细胞紊乱、微血管功能障碍引起的心肌缺血、心脏小血管病变及心肌肥大引起的心外膜冠状动脉在收缩期受压迫。这些因素共同、相互作用导致HCM 患者发生VAs 的高风险且与影像组学特征参数具有潜在相关性。目前已有研究[19]通过分析HCM 患者心肌的CMR-LGE 图像证实有室性心动过速病史HCM 患者的心肌纹理特征与无室性心动过速病史HCM 患者的心肌纹理特征不同,纹理分析可为HCM 患者是否合并室性心动过速诊断提供更多信息。有研究[33-34]结果显示从左心室LGE 图像中提取影像组学特征反映了心肌纤维化的异质性,可以为SCD 事件提供一个独立预后因素,并有助于改善HCM 患者风险分层。但既往研究大多基于HCM 患者的CMR-LGE图像构建影像组学模型,CMR-LGE 虽然亦为HCM 患者CMR 检查常规序列,但对肾功能不全、对比剂过敏、心功能不良无法耐受长时间检查的患者及LGE技术不够成熟的基层医院存在一定应用困难。本研究中构建的3 个影像组学模型不仅基于未增强的常规亮血电影序列,而且在训练集及测试集中均表现出较好的效能,为影像组学在临床广泛应用提供有价值的研究结果。因此,影像组学可为HCM 患者是否合并VAs 的预测提供更多的客观数据,并为HCM患者的预后评价及治疗策略提供更多参考。
3.3 联合模型预测HCM者合并VAs的价值
本研究训练集中,3 个联合模型效能优于其对应的影像组学模型,亦优于临床因素模型;H-L 检验结果显示,3 个联合模型在训练集和测试集中均具有较好的拟合度,且校准曲线显示3个联合模型的预测结果和实际观察结果一致性较好,说明临床特征与影像组学特征的结合能很好反映HCM 患者心肌的异质性,且提高预测HCM 患者是否合并VAs 的预测效能。临床因素模型指标从宏观水平反映HCM 患者整体心肌的解剖特点及功能变化,而影像组学特征则从微观角度对HCM 患者整体心肌的病理生理状态作出客观评估,因此,临床因素与影像组学特征之间存在互补作用,基于两者不同角度特征所构建的联合预测模型可更全面客观解释HCM 患者整体心肌病变特征,提高了预测准确率,使患者获得更大收益。KOTU 等[35]在心肌梗死后心律失常风险评估随访研究中发现,当使用机器学习工具结合影像组学纹理分析、心肌疤痕范围和左心室射血分数数据时,模型的准确率大大提高。EFTESTØL 等[36]也指出当纹理特征结合左心室射血分数数据时,模型识别有心律失常风险患者的表现更好。这些研究结果和本研究结果都进一步证实影像组学特征分析与其他形式的临床数据相结合十分重要,这为临床上更加便捷高效地评估和预测HCM 患者是否合并VAs 提供新思路与方法。
3.4 基于不同ROI构建预测模型的效能比较
通过对本研究的3个联合模型进行比较发现,在训练集中,左心室肥厚区域心肌联合模型及左心室全心肌联合模型效能优于左心室非肥厚区域心肌联合模型,左心室肥厚区域心肌联合模型与左心室全心肌联合模型效能相当;在测试集中,左心室肥厚区域心肌联合模型效能亦优于左心室非肥厚区域心肌联合模型。此研究结果表明,对HCM 患者不同区域心肌影像组学特征提取所构建的模型具有不同的预测效能,即揭示了HCM 患者不同区域心肌的病理生理状态对HCM者并发VAs发生及进展的贡献不同。
HCM患者心肌广泛纤维化被认为是心律失常的基质,它通常出现在室壁增厚区域[37-38]。有研究[39]通过心脏灌注技术对HCM 患者心肌的非肥厚节段及肥厚节段分别进行心肌微血管功能评估,结果发现后者具有更高的达峰时间及更大的LGE 范围,并指出肥厚节段心肌灌注更为不足。一项通过心脏磁共振体素内不相干运动评价HCM 患者心肌微循环功能的研究[40]指出,HCM 患者肥厚节段与非肥厚节段均存在微循环障碍,且肥厚节段的损害程度更为明显。另外,肥厚区域心肌由于室壁肥厚,在收缩期更易压迫邻近心外膜的冠脉,造成心肌缺血加剧[32],因此HCM 患者表现为肥厚区域的心肌因血流灌注降低及微循环障碍更易为VAs 发生提供基质,这成为本研究基于左心室肥厚区域心肌影像组学特征构建的联合模型预测效能更高的病理生理基础,亦说明影像组学方法所提取的未增强常规亮血序列信息可与LGE 同等反映HCM 患者肥厚区域心肌微循环障碍,甚至更敏感、更客观,易于临床推广应用。
本研究中,基于左心室非肥厚区域心肌影像组学特征构建的影像组学模型及联合模型均具有较好的预测效能,表明HCM 患者非肥厚区域心肌在HCM患者并发VAs病情进展中亦有所贡献。有学者指出心肌纤维化常发生在室壁增厚区域,但也会发生在心肌未出现明显肥厚的HCM 病程早期,在纤维化心肌中,已被破坏的细胞间排列引起心脏电传导异常,进而导致心律失常的发生[41-42]。有研究[43]指出HCM患者心肌的壁厚正常节段也存在心肌灌注储备减低,弥散也比健康对照组更具有各向同性,提示存在潜在的心肌细胞紊乱;其他研究[39,44-45]结果显示非肥厚区域心肌存在微灌注障碍、组织特征的改变及功能重构先于其形态改变。综上所述,HCM 患者非肥厚区域心肌存在微观结构及功能改变,为VAs 发生提供潜在基质,这与本研究结果一致,提示无论从病理生理基础还是影像组学角度分析,在临床工作中对HCM 患者非肥厚区域心肌的评估管理也不容忽视。
在训练集及测试集中,左心室肥厚区域心肌联合模型与左心室全心肌联合模型的效能相当,笔者推测一方面在HCM 患者并发VAs 的疾病进程中,肥厚区域心肌的心肌细胞体积更大、纤维化程度相对严重,为VAs 发生提供更多的病理生理基础,同时纤维化心肌细胞间排列的紊乱,导致整个左心室心肌电传导异常;另一方面,虽然本研究提示非肥厚区域心肌对VAs 的发生贡献相对较少,但非肥厚区域心肌亦发生微灌注障碍、心肌细胞紊乱及功能重构,为心律失常的发生提供潜在基质,以上两方面因素并存导致VAs的发生。
3.5 局限性
本研究具有一定的局限性:(1)本研究为小样本、单中心和回顾性研究,今后需要进一步增大样本量,设计多中心和前瞻性研究;(2)本研究中合并VAs者与未合并VAS 者比例不均衡,下一步将加大样本量;(3)本研究仅使用一种影像组学分类器构建模型,今后可能使用多种影像组学分类器构建模型并对比,能得到效能更好的影像组学模型。
4 结论
本研究中多因素logistic 分析提示UCG-LVEF、MR-LVED wall mass、QT 间期时长延长是HCM 患者并发VAs 的独立危险因素,MR-LVEDVI 是HCM 患者并发VAs 的保护因素,为临床预测HCM 患者并发VAs 的发生提供重要且易常规获取的评价参数。本研究通过分析讨论基于不同ROI 影像组学特征构建的影像组学模型、临床因素模型及联合模型对于HCM 患者并发VAs 的预测效能,初步证实结合临床因素及影像组学特征的联合模型效能更高、基于不同区域心肌构建的模型预测效能不同。通过整合临床信息及影像组学特征建立的联合模型可更好地预测HCM 患者并发VAs 风险,对HCM 患者的预后评估及诊疗计划制订有着重要的临床应用价值;而基于不同区域心肌构建模型的效能比较结果则有望为临床决策制订和实施提供新的思路和方法。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:朱力设计本研究的方案,对稿件重要内容进行了修改;吕静设计本研究的方案,撰写稿件,对稿件重要内容进行了修改;朱永琪、朱彦芳、何瑛、胡茜、邵九杰、王艺霖、王霈及刘云获取、分析或解释本研究的数据,对稿件重要内容进行了修改;朱力获得了2022 年度宁夏重点研发计划项目及2020 年宁夏自然科学基金项目的资金资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
