神经突方向离散度和密度成像预测成人型弥漫性胶质瘤IDH基因型的应用
2024-05-20张驰吴琼何金龙谢生辉王鹏王少彧张华鹏高阳
张驰,吴琼,何金龙,谢生辉,王鹏,王少彧,张华鹏,高阳*
作者单位 1.内蒙古医科大学附属医院影像诊断科,呼和浩特 010059;2.西门子医疗系统有限公司,上海 200126
0 引言
胶质瘤是成人最常见的原发性恶性脑肿瘤,全球发病率可达到4.67~5.73/10 万人[1],具有预后差、易复发、病死率高等特点。2021 年世界卫生组织(World Health Organization, WHO)发布了新版中枢神经系统肿瘤分类,这一版本进一步强调了分子遗传特征在实际临床工作及相关研究中的重要性。该版分类将成人型弥漫性胶质瘤(adult-type diffuse glioma, ADG)按照组织学及分子特征联合分为2~4 级[2],其中2~3 级划分为低级别胶质瘤(low grade glioma, LGG),好发于年轻人,肿瘤多呈相对局限性生长,细胞增殖速度慢,恶性程度相对较低,且对治疗表现出一定的敏感性[3]。原发性胶质母细胞瘤则是高级别胶质瘤(high grade glioma, HGG)中最常见的恶性肿瘤,生长速度快,复发率高,预后差,发病率随着年龄的增长而增加,其中位生存年龄约为65岁[4]。既往研究表明[5],与异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)野生型个体相比,IDH 突变型胶质瘤更易于全切除,对放化疗更加敏感,这导致IDH 突变型胶质瘤患者总生存期更长。虽然目前肿瘤分子基因型的方式仍以病理取材为主,但因个体间存在差异,仍有一部分患者不能进行手术或穿刺。因此,在术前采用非侵入性的检查方法预测IDH 状态对于提高ADG的诊断准确性、确定预后和预测治疗反应方面发挥着至关重要的作用。
2012年,有学者[6]提出了神经突方向离散度与密度成像(neurite orientation dispersion and density imaging, NODDI)模型,该模型构建了一个三室生物物理模型,首次证明了临床可行范围内活体大脑的神经突密度和定向扩散成像。与扩散张量成像(diffusion tensor imaging, DTI)相比,NODDI 的成像参数更具体,对微结构的改变更敏感。目前国内外已有学者将NODDI 用于阿尔茨海默病[7-8]、帕金森病[9]、多发性硬化[10-11]和肿瘤性病变[12-14]。对于一些生长部位位于皮质脊髓束(corticospinal tract, CST)附近的患者来说,通常手术难以完全切除肿瘤,并且容易损伤CST,进而影响术后运动功能的恢复。有研究表明,NODDI 似乎可以通过提供有关肿瘤微环境诱导的CST 损伤的神经突密度的额外信息[12],并且进而评估患者的生存质量。高璐月等[15]尝试使用多种扩散模型区分IDH 基因状态,研究发现NODDI 模型所拟合的部分定量参数在IDH 野生型与突变型组间存在明显差异,但GUO 等[16]却得出了相反的结论。此外,也有研究认为NODDI 不能够用于预测IDH 状态[17]。因此,本研究尝试通过NODDI 定量参数描述不同IDH 基因型间肿瘤特征分布,然后通过多流水线构建临床预测模型。
1 材料与方法
1.1 一般资料
回顾性分析2018 年6 月至2022 年6 月在内蒙古医科大学附属医院就诊的51例经病理证实的ADG患者,男28 例,女23 例,年龄(53.76±11.99)岁。IDH 突变型21 例,其中男10 例,女11 例;IDH 野生型30 例,其中男13 例,女17 例。纳入标准:(1)术前行MRI 扫描且图像质量理想;(2)遵照WHO 第五版中枢神经系统肿瘤分类进行病理学诊断;(3)行MRI检查前未进行过放化疗等治疗。排除标准:(1)图像扫描后3 个月内未进行病理取材;(2)病理证实为其他肿瘤;(3)患者年龄小于18 岁。本研究遵守《赫尔辛基宣言》和《人体生物医学研究国际道德指南》的伦理原则,受试者的招募基于自愿原则,均签署了知情同意书。本研究经内蒙古医科大学附属医院伦理委员会批准,批准文号:WZ (2023062)。
1.2 MRI扫描
所有患者均于术前在我院3.0 T 磁共振设备上(MAGNETOM Skyra, Siemens Healthineers, Erlangen,Germany)行相关序列扫描,采用32 通道头颈联合线圈进行。常规扫描序列包括轴位反转恢复T1WI、轴位快速自旋回波T2WI、轴位扩散加权成像(diffusion-weighted imaging, DWI)和3D-磁化准备快速梯度回波(magnetization prepared rapid acquisition gradient echo imaging, MPRAGE)-T1,增强扫描于静脉注射钆喷酸葡胺注射液(Gadovist,Bayer Healthcare)0.1 mmol/kg后进行。多壳扩散扫描通过轴位扩散频谱成像(diffusion spectrum imaging, DSI)进行,主要参数如下:扫描方向数为128,具体 b 值分别为200、400、550、750、950、1150、1500、1700、1850、1900、2050、2250、2450、2650、3000 s/mm2,TR 7000 ms,TE 107 ms,FOV 260 mm×260 mm,扫描层数50 层,扫描序列的具体参数见表1。
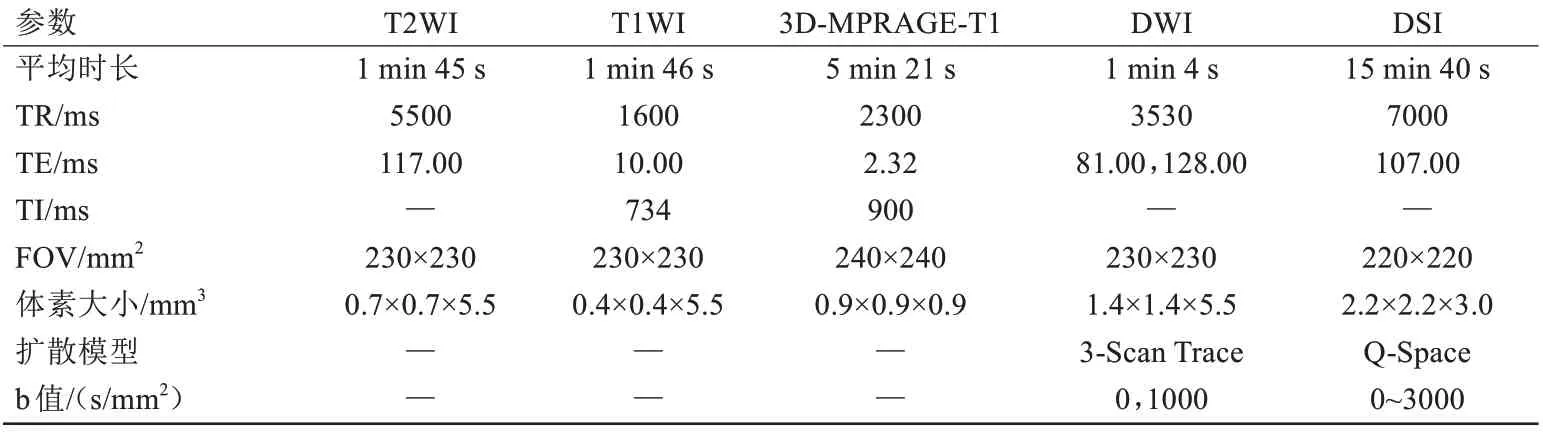
表1 MRI扫描序列参数Tab.1 Different sequence scanning parameters of MRI
1.3 图像预处理和感兴趣区的勾画
首先,使用Diffusion Kit 对DSI 采集得到的原始dicom 数据进行涡流和运动校正。然后,使用Neu-DiLab[18](成都众影医疗科技有限公司)后处理软件计算获得NODDI参数图。NODDI定量参数包括细胞内体积分数(intra-cellular volume fraction, ICVF)、细胞外体积分数(extra-cellular volume fraction, ECVF)、各向同性体积分数(volume fraction of the isotropic compartment, ISOVF)和方向离散指数(orientation dispersion index, ODI)。
3D-Slicer 被用于感兴趣区(region of interest,ROI)的勾画,分别在肿瘤实质区、瘤周水肿区和对侧脑白质区逐层手动选择ROI。肿瘤实质区内需尽可能避免囊变、坏死和出血,如果肿瘤存在强化,则选择强化区域;如果肿瘤无强化且实质内信号不均匀,则选择表观扩散系数 (apparent diffusion coefficient,ADC)图信号最低的区域作为ROI。瘤周水肿区选择肿瘤强化边缘外的T2高信号区域。对侧正常脑组织区选择病变对侧常规MRI下未见明显异常信号的白质区(该区域特征用于横向组间比较,并不参与后续模型构建)(图1)。每种ROI 参数值测量三次,然后计算每个参数值的总平均值。本研究中患者的基本信息和临床病史被盲化,然后由两名医生(分别为10年和11年工作经验)对图像进行分析和测量,意见有分歧时协商解决。

图1 感兴趣区勾画图示。绿色:肿瘤实质区;红色:瘤周水肿区;黄色:对侧正常脑组织区。T1-CE:增强后T1 加权成像;T2:T2 加权成像;3D-ROI:三维感兴趣区。Fig.1 A diagram of the region of interest.Green: parenchyma area; Red:peritumoral edema; Yellow: contralateral normal brain tissue.T1-CE: enhanced T1WI;T2: T2WI; 3D-ROI: three-dimensional region of interest.
1.4 病理学及基因检测方法
所有组织样本均以石蜡块包埋,并在我院的病理学部门使用符合世界卫生组织2021年组织病理学和免疫组织化学指南的方法进行分析。分析图像的病理学家有23 年的工作经验,病理学家对临床信息和成像结果是不知情的。
对于肿瘤基因测序,使用一步法(多重PCR 扩增联合NGS测序)对肿瘤实体进行检测。一步法简易化流程为:(1)从福尔马林固定-石蜡包埋的组织中提取DNA,并对DNA 进行定量评估;(2)利用扩增子的方法对DNA 进行建库,在片段质控合格后定量上机;(3)制备模板,之后进行碱基识别和碱基信息测序并统计;(4)测序结果与人类参考基因组hg19(GRCh37)的比对;(5)对数据进行变异分析和结果注释,生成报告。
1.5 模型构建
FeAture Explorer(FAE, 0.5.2)被用于模型建立[19],在预测模型的开发过程中考虑了多条流水线组合,包括1 种数据降维方法(Pearson 相关),4 种特征选择方法(方差分析、递归特征消除、Kruskal-Wallis和Relief)和4 种线性分类器(逻辑回归,逻辑回归通过最小绝对收缩和选择算子、线性判别分析和支持向量机),共16 个流水线。首先,全部51 例数据通过Pearson 相关减少特征数量,之后通过4 种特征选择方法来分别选择有效特征,最终通过4种线性模型尝试构建最佳模型。留一法交叉验证被用于特征数量选择和超参数调整。然后,如果内部验证集在增加或减少预测因子数量后没有产生令人满意的结果,则重建模型。也就是说,在交叉验证中执行特征数量的选择。
1.6 统计方法
使用受试者工作特征(receiver operating characteristic,ROC)曲线对模型预测IDH 基因型的性能进行了评价。曲线下面积(area under the curve, AUC)的95%置信区间(confidence interval,CI)由1000 个样本的自举法生成。使用综合判别改变指数(integrated discrimination improvement, IDI)、净重分类改善指数(net reclssification improvement, NRI)来比较不同模型之间的性能。模型与实际结果之间的偏差通过校准曲线可视化,并通过Brier 评分量化。采用决策曲线分析最终预测模型在不同阈值概率下的净效益,以增加在临床实践中实际应用的可能性。
定量数据以均数±标准差表示。组间年龄的比较采用独立样本t检验,分类变量比较采用χ2检验和Fisher's 检验。此外,通过单因素ANOVA 比较了肿瘤实质区、瘤周水肿区和对侧脑组织区扩散参数的差异,Bonferroni 被用于P值的校正。所有统计分析均为双侧分析,P<0.05 为差异有统计学意义。所有统计分析均使用SPSS 26.0、 R4.1.2 和Python 3.9.12软件进行。
2 结果
2.1 临床资料
IDH 突变组21 例,其中男10 例,女11 例;IDH 野生组30 例,其中男13 例,女17 例。两组之间年龄差异有统计学意义,IDH 野生型组年龄高于突变型组(P=0.001);性别在两组之间未见差异(表2)。
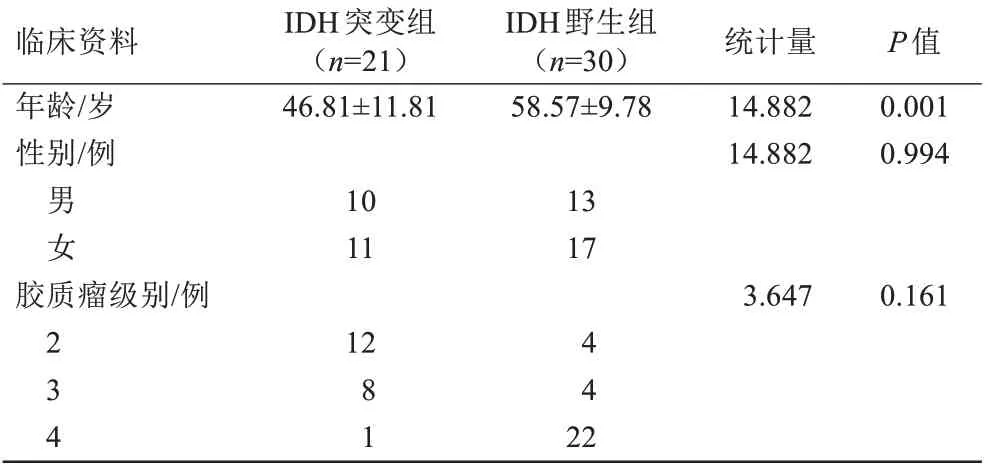
表2 临床基线资料Tab.2 Comparison of general clinical data in different groups
2.2 单因素分析与IDH基因分型的关系
IDH突变组和野生组间NODDI参数的分布状态及单因素特征对于IDH 的预测性能见表3。在比较了肿瘤实体、瘤周水肿及对侧脑组织区域后,IDH 野生组内4 种扩散参数对应的3 种不同区域之间均存在差异(P<0.05),而IDH 突变组内只有ECVF 和ICVF同时存在差异(P<0.05)。

表3 NODDI参数组间分布及单因素ROC 曲线下特征Tab.3 Distribution of NODDI parameters between groups and characteristics under single ROC curve
组间比较后发现,只有IDH 野生型组的瘤周水肿区ODI 值低于IDH 突变型组(P=0.019),余组间ECVF、ICVF 和ISOVF 未见差异。在实质区和水肿区之间,ECVF 和ISOVF 组间未见差异(P>0.05);在水肿区和对侧白质区之间,ODI 组间未见差异(P=0.082);余组间比较差异有统计学意义(P<0.05)。其中,ICVF能够同时鉴别实质区、水肿区和对侧脑组织区(P<0.05),对侧脑组织区和水肿区分别具有最高和最低的ICVF 值。单因素扩散参数预测IDH 的AUC 取值范围为0.508~0.695,只有水肿区ODI 能够用于预测IDH状态(P=0.019)。
2.3 综合预测模型的构建及诊断效能
综合模型的特征选择通过Kruskal-Wallis 进行,然后使用线性判别分析构建模型,其中年龄和水肿区ODI的贡献度分别为0.11和-6.65。综合预测模型的ROI 为0.835(95%CI:0.703~0.941),训练集和验证集的准确度分别为82.4%和80.4%,并且敏感度和特异度均超过了0.750(表4);综合预测模型的诊断性能高于单独使用年龄[0.773(95%CI:0.624~0.894)]和ODI [0.695(95%CI:0.538~0.845)](图2)。IDI 以及NRI证明了综合模型具有最高的诊断性能(所有P值均小于0.001)。决策曲线分析和校准曲线证明了综合模型的临床净收益和最接近真实数据的分布(Brier分数:0.163)(图3)。

图2 综合预测模型在训练队列中的ROC 曲线。综合预测模型诊断效能最高,ROC 曲线下面积为0.835(0.703~0.941),高于单独使用年龄0.773(0.624~0.894)和水肿区ODI 值0.695(0.538~0.845)。ROC:受试者工作特征;AUC:曲线下面积;ODI:方向离散指数。图3 综合预测模型在训练队列中的决策曲线分析和校准曲线。决策曲线显示,阈值大于0.28提示了额外的临床收益。校准曲线显示,综合模型的预测值接近真实分布,Brier值为0.163(当Brier评分越小时,模型损失越小)。Fig.2 ROC curve of comprehensive prediction model in training queue.The comprehensive prediction model has the highest diagnostic efficiency, and the area under ROC curve is 0.835 (0.703-0.941).It is higher than 0.773 (0.624-0.894) of age and 0.695 (0.538-0.845) of ODI in edema area.ROC: receiver operating characteristic;AUC: area under the curve; ODI: orientation dispersion index.Fig.3 Decision curve analysis and calibration curve of comprehensive prediction model in training queue.The decision curve shows that when the threshold is greater than 0.28, it suggests additional clinical benefits.The calibration curve shows that the predicted value of the comprehensive model is close to the real distribution, and the Brier value is 0.163 (the smaller the Brier score, the smaller the model loss).
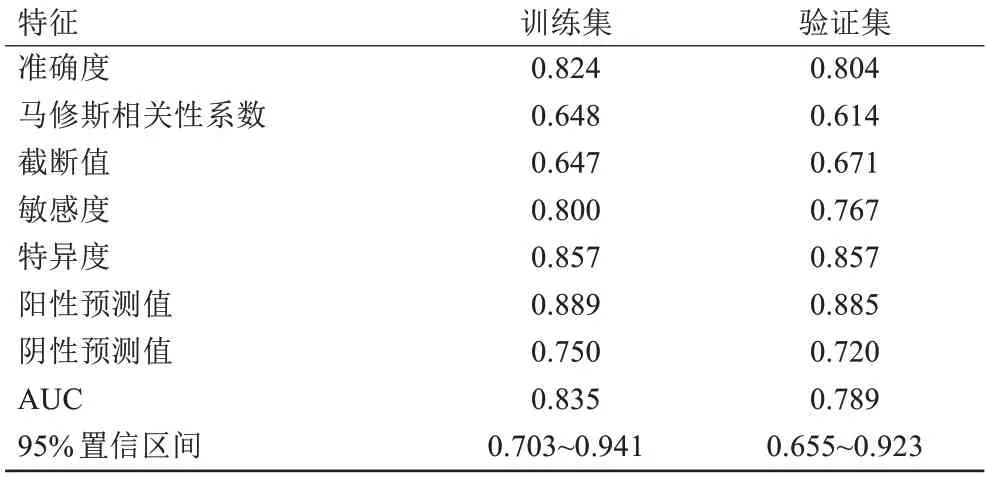
表4 综合预测模型的ROC曲线下特征(n=51)Tab.4 Characteristics under ROC curve of comprehensive prediction model (n=51)
3 讨论
本研究讨论了NODDI 参数预测ADG IDH 基因状态的可行性,结果显示NODDI 定量参数捕捉到了ADG引起的扩散改变,其中ICVF能够同时鉴别实质区、水肿区和对侧白质区。水肿区ODI 能够用于IDH预测(AUC=0.695)。并且相较于单因素模型,结合了临床特征的综合预测模型具有更高的准确性和稳定性。另外,本研究采用了机器学习的方法以构建最优诊断模型,未涉及使用深度学习。最主要原因是小样本量下数据集的划分并不能满足深度学习网络的训练要求,此外还未发现基于先进扩散模型的预训练网络进行迁移来提取额外的深度学习特征。已有大量研究进行了基于深度学习的额外特征获取,暂时不足以获得充足的证据以支持深度学习特征完全优于传统手工特征。我们将继续收集样本以在未来的研究中分析不同应用方法对于临床应用的差异。
NODDI作为一种理论模型相对完善的扩散成像技术,它将微观扩散运动假定为一种三室生物物理组织模型[6],该技术可以用于推断和量化神经突(轴突和树突)的方向和结构。相较于两室物理模型[20],NODDI 更加注重于量化神经突方向的变化,并捕获了垂直于神经突的高度受限的扩散变化,以及遵循沃森分布的沿神经突的无阻碍扩散。既往研究表明[21],在评估年龄和性别对于脑白质微结构的影响时,与平均表观传播磁共振成像相比,NODDI 因其独特的成像原理使得对于检测这种结构改变更加敏感。
3.1 NODDI预测IDH基因型
在本研究中,相较于IDH 野生型胶质瘤患者,突变型患者更年轻,这一现象符合胶质瘤的流行病学特点[22]。既往研究表明[17],HGG 具有更高的ICVFtumor和更低的ICVFedema,而LGG 具有更低的ICVFtumor的和更高的ICVFedema;然而,在区分IDH 突变状态时,NODDI的定量参数没有发现显著组间差异。这与我们得出的结论不同,我们发现ODIedema可以有效地预测IDH 状态,我们认为出现这种结果的原因可能是两项研究中不同的肿瘤类型分布数量不同,并且肿瘤实质区域的勾画不局限于最大肿瘤及临近层面,其次,前者的研究中并未将整个水肿区域进行勾画,而是将肿瘤边缘1 cm 内的T2 高信号影作为瘤周水肿区,这可能会对测量值的准确性产生影响,进而影响统计学结果。
IDH 野生型与突变型胶质瘤在常规MRI 图像上有一定的差异,具体表现为IDH 突变型多为单发病变,更易出现无强化或轻度强化且很少出现坏死,相比之下IDH 野生型常表现为明显异常强化[23-24]。结合病理机制考虑可能是因为IDH 突变型胶质瘤与微血管稀疏相关而导致的生长速度慢,相比之下野生型胶质瘤微结构更复杂、肿瘤异质性更高,由于肿瘤生长速度快,其更丰富的微血管生成及血脑屏障的破坏使得病变常表现为明显强化。与IDH 突变型个体相比,野生型胶质瘤具有更高的细胞数目、核多形性、内皮增殖活性和微血管密度,导致水分子扩散受阻和受限的程度更高。但是我们的研究中并没有发现IDH 野生型的ICVF 值高于IDH 突变型。同样,在理论预期结果中, IDH 野生型所引起的正常脑组织破坏程度比IDH 突变型更明显,神经纤维受压、弯曲和移位将导致更高的ODI 值。但是在我们的研究中,肿瘤实质区的ODI 没有表现出差异,而IDH 野生型组的瘤周水肿区ODI 值低于IDH 突变型组。一个主要的原因可能是IDH 野生型肿瘤由于其恶性程度更高,导致瘤周水肿区以浸润性水肿为主,周边神经纤维破坏得更完全,剩余的神经纤维数量减少,纤维弯曲和交叉的程度更低。另一项使用NODDI鉴别胶质母细胞瘤和孤立性脑转移瘤的研究[25]进一步证实了我们的猜想,并且他们发现瘤周水肿区的ICVF 表现出了最高的诊断效能,这一发现表明NODDI 有可能提供了与肿瘤环境有关的新的有价值的生理信息。
有研究[26]发现LGG 和HGG 肿瘤实质区NODDI的四个扩散参数值均较正常对照区降低,本研究中ODI值高于对侧白质区,细胞浸润造成的影响不能被排除,但是不同基因状态和级别的胶质瘤不能一概而论,病变本身也存在较大的差异,如IDH 野生型的患者病变范围更大,边界更模糊。神经胶质瘤的组织学特征是异常的细胞亢进、细胞核多形性、内皮增殖活性和微血管密度[27],所有这些转化将取代正常的脑组织并渗透到邻近的脑组织中,从而导致大脑微环境的改变。或许可以解释为ODI 主要代表轴突的方向分散度和量化轴突的方向变化,由于神经元纤维破坏,神经纤维交叉而导致更大的ODI 值,这与既往FIGINI 等[28]的研究得出的结果一致。此外,我们发现对侧白质区和瘤周水肿区分别具有最高和最低的ICVF 值,原因可能是肿瘤浸润导致瘤周水肿区的细胞被破坏,使得其水分子在细胞内扩散受限程度相应下降。
3.2 NODDI与DTI、DKI在预测IDH基因型方面的对比
结合年龄变量和瘤周水肿区中ODI 的平均值对ADG 的IDH 基因分型具有最高的诊断性能。LUAN等[29]的Meta 分析中总结了不同的扩散模型对于IDH的预测性能,肯定了扩散峰度成像(diffusion kurtosis imaging, DKI)的应用价值远远高于DTI。另有多项研究[30-31]表明,DKI参数中FA 及MD 值可以用于预测IDH基因状态,进一步肯定了DKI在鉴别胶质瘤IDH基因状态中的临床价值。XIE 等[32]的研究发现NODDI 在预测IDH 时的表现要优于DKI 和DTI,其中ICVF(AUC=0.753)的诊断效能最高,高于FA 值(AUC=0.640)和ADC 值(AUC=0.750),研究的结果肯定了先进扩散模型的优势。但是另有研究[33-34]认为DTI、DKI 的参数在鉴别胶质瘤级别时比NODDI参数表现更好,NODDI并没有提高额外的诊断效能,造成上述研究结果矛盾的可能因素有很多,扫描机器的型号不同、ROI 勾画方式的不同、样本量的大小都会对后续的统计分析具有一定影响。例如,相较于手工特征,卷积神经网络[35]提升了基于NODDI 的综合模型的诊断性能。具有针对性的专有训练模型或搞泛化性的迁移模型是未来通过先进扩散模型进行临床应用的重要研究方向。
3.3 局限性
当前的研究具有几个局限性。首先,本研究为回顾性研究,为了尽可能纠正混杂偏倚进行了严格的样本筛选,导致研究的样本量相对不足,这限制了模型的稳定性和结论的可信度,未来需要更大的样本量或多中心研究来确认NODDI 的实际临床价值。其次,该研究的ROI 为半自动绘制,虽然高年资医师的勾画在一定程度保证了其准确性和再现性,但是全自动肿瘤勾画的方式实际上增加了最终结果的泛化能力。此外,NODDI模型的理论模型是物理模型,与实际人体的组织结构仍具有差异,这可能会限制组织微结构的描述。最后,多模态数据的应用、放射组学对于高阶特征的提取和深度学习的应用有望进一步提高综合预测模型的判别能力。
4 结论
综上所述,NODDI可以解释ADG 因肿瘤异质性引起的水分子扩散异常,与正常区域的比较将进一步阐述肿瘤微环境改变所引起的宏观变化。并且基于NODDI 参数和临床特征构成的综合模型可以用于ADG IDH 基因状态的准确预测,进一步证实了NODDI的理论优势,为ADG 患者的临床诊疗过程提供指导意见,最终改善患者预后和延长生存时间。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:高阳设计本研究的方案,对稿件重要的智力内容进行了修改,获得了内蒙古自治区科技计划项目的资助;张驰起草和撰写稿件,获取、分析和解释本研究的数据;吴琼、谢生辉、王鹏、王少彧、何金龙分析或解释本研究的数据,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
