乳腺癌化疗患者脑结构及功能磁共振成像研究
2024-05-20宋雅琪李一凡夏建国田为中
宋雅琪,李一凡,夏建国,田为中*
作者单位 1.南京医科大学泰州临床医学院,泰州 225309;2.南京医科大学附属泰州人民医院医学影像科,泰州 225399;3.南通大学医学院,南通 226001
0 引言
根据《2020 年全球癌症统计报告》,女性乳腺癌已成为世界上最常见的癌症[1]。接受化疗药物治疗的乳腺癌患者经常出现认知问题[2],主要表现在短期和工作记忆、注意力、执行功能和处理速度方面[3],这种由化疗导致的改变称为化疗相关认知功能损伤(chemotherapy-related cognitive impairment, CRCI)。CRCI 严重影响乳腺癌患者的生活质量,其神经生物学机制受到广泛关注。既往研究发现,化疗通过影响脑结构、功能、代谢和血液灌注导致CRCI[4]。
化疗药物可通过对神经细胞的直接细胞毒性损伤而损害脑代谢和细胞功能。铂类药物可以少量穿透血脑屏障,对包括祖细胞、少突胶质细胞和海马神经元在内较脆弱的神经细胞造成损害,同时还参与诱导线粒体DNA 损伤,从而导致线粒体功能障碍和氧化应激增加,神经元完整性和认知功能最终受损[5-6]。5-氟尿嘧啶可导致髓鞘完整性下降,与海马神经退行性缺陷和线粒体功能障碍有关[7]。甲氨蝶呤破坏白质完整性,并与认知障碍有关[8]。这些都显示了化疗药物对大脑神经元的直接不良影响。目前关于CRCI 的产生机制及治疗方法被广泛研究,但仍未得出明确结论。
本研究采用基于体素的形态学测量(voxel-based morphometry, VBM)方法对乳腺癌患者化疗后脑灰质体积(gray matter volume, GMV)进行研究,并探索GMV 异常脑区与全脑功能连接(functional connectivity, FC)的改变,从结构和功能两方面来研究化疗对乳腺癌患者脑的影响,旨在为CRCI 的发生发展提供影像学依据,为其早期诊断做出贡献,改善化疗患者的预后。
1 材料与方法
本研究遵守《赫尔辛基宣言》,经南京医科大学附属泰州人民医院伦理委员会批准,全体受试者均签署了知情同意书,批准文号:KY2022-041-01。
1.1 一般资料
本研究纳入30 名化疗后1 个月的女性乳腺癌患者及29 名术后未经放化疗的女性乳腺癌患者,分别作为化疗组(C+组)和对照组(C-组)。
所有的参与者均进行了局部手术治疗。乳腺癌化疗后患者纳入标准:(1)均为术后患者,且证实为浸润性乳腺癌;(2)无放疗或内分泌治疗史;(3)采用常规标准剂量化疗方案;(4)教育水平能理解所告知内容。
化疗前患者纳入标准:(1)术后患者;(2)未接受任何化疗药物治疗;(3)无放疗或内分泌治疗史。
所有受试者排除标准:(1)既往癌症病史;(2)远处转移(包括脑转移)的存在;(3)脑和脑血管疾病(即脑肿瘤、发育异常、外伤性脑损伤、头颈部大动脉血流动力学显著狭窄及其他相关病理);(4)恶病质或其他躯体失代偿;(5)怀孕及其他磁共振检查禁忌证。
1.2 神经心理学测试
所有患者的社会人口学和临床数据由同一神经科医生收集。两组的所有患者都接受了一系列的认知评估,包括主观神经认知测量和神经心理学测试。认知测试包括简易精神状态测试(Mini Mental State Examination, MMSE)、蒙特利尔认知评估(Montreal Cognitive Assessment, MoCA);神经认知测试包括焦虑自评量表(Self-rating Anxiety Scale, SAS)、抑郁自评量表(Self-rating Depression Scale, SDS)、肿瘤患者生活质量评估等。
1.3 数据处理与分析
1.3.1 结构像数据处理
在MATLAB 软件中,使用SPM(Statistical Parametric Mapping)(https://www.fil.ion.ucl.ac.uk/spm/)的CAT12(http://dbm.neuro.uni-jena.de/cat/)工具箱对VBM 的高分辨率T1加权结构图像进行预处理分析。将图像转换为NII 格式后,首先使用统一的分割模块[9]将解剖图像分割为灰质(grey matter, GM)、白质(white matter, WM)和脑脊液(cerebrospinal fluid,CSF)。然后,通过DARTEL 工具[10],利用微分同胚解剖配准将分割后的GM 图像归一化到蒙特利尔神经学研究所(Montreal Neurological Institute, MNI)标准空间。在MNI 空间中对GM 模板进行仿射和非线性配准后,对图像进行调制,以确保在空间归一化过程中保留相对的GM 体积。对图像和预处理质量进行检查,并进行全脑指标评估。最后,用8 mm 的半高宽(full width at half maximum, FWHM)高斯核对得到的GM图像进行平滑。
1.3.2 功能MRI的数据分析
使用SPM8 和静息态功能MRI(resting state functional MRI, rs-fMRI)数据分析工具包对符合条件的数据进行处理,排除不符合条件的数据。预处理步骤如下:
(1)由于初始图像信号不稳定,将前10个时间点去除。
(2)对剩余的230 幅功能血氧水平依赖(blood oxygenation level dependent, BOLD)图像进行切片时序校正、运动校正和重新对齐。任何方向最大位移大于2 mm或旋转大于2°的fMRI扫描图像被排除。
(3)空间归一化,重采样至3 mm 各向同性体素。用6 mm 全宽半最大值高斯核平滑后,去除线性趋势、带通时间滤波(0.01~0.08 Hz)和协变量,包括头部运动参数、全脑、白质和脑脊液信号。
1.3.3 fMRI指标计算
FC:在自动解剖标记图谱[11]所包含的脑区(90个)中,将GMV差异脑区作为感兴趣区(region of interest,ROI)。计算所有受试者的平均时间序列与所有其他大脑体素的时间序列之间的皮尔逊相关系数,完成Fisher 转换为z值,提高数据的正态性,生成全脑的zFC图。
1.4 统计学处理
(1)一般资料:采用SPSS 26.0 进行统计分析。对两组患者年龄、性别、受教育年限、神经心理学量表评分等连续变量符合正态分布的采用均数±标准差表示,不符合正态分布的计量资料采用中位数(四分位数间距)表示,两组比较采用独立样本t检验或Mann-WhitneyU检验,P<0.05为差异有统计学意义。
(2)GMV 数据分析:对平滑后的灰质图像运用基于Matlab 平台的SPM 软件进行两组间的双样本t检验,以P<0.001,cluster size>90 得到的脑区为GMV差异有统计学意义的脑区。结果通过在MRIcroGL及BrainNetViewer软件进行可视化。
(3)FC 数据分析:对C+组与C-组的FC 图像运用基于Matlab 平台的SPM8 软件进行双样本t检验,观察FC 差异有统计学意义的脑区。多重比较校正采用体素水平P<0.001,FWE-corrected<0.05;记录有差异有统计学意义的团块大小、所包含的脑区、峰值区域MNI坐标以及相关强度(以t值表示,t值绝对值越大代表差异越显著)。结果在BrainNetViewer软件中显示。
(4)相关性:将GMV 差异有统计学意义脑区的GMV 值提取出来,采用SPSS 26.0 统计学软件,将年龄及受教育年限作为控制变量,采用偏相关分析探讨差异脑区的GMV 值及FC 值与神经心理认知测试结果之间的相关性,P<0.05认为有相关性。
2 结果
一般资料:采用双样本t检验评估C+组及C-组两组间一般资料之间的差异是否具有显著性,结果显示两组之间年龄、受教育年限差异不具有统计学意义(P>0.05)。神经心理学测试结果显示,焦虑及抑郁自评量表、肿瘤患者生活质量评估差异无统计学意义(P>0.05);MMSE、MoCA 评分差异具有统计学意义(P<0.05),结果见表1。
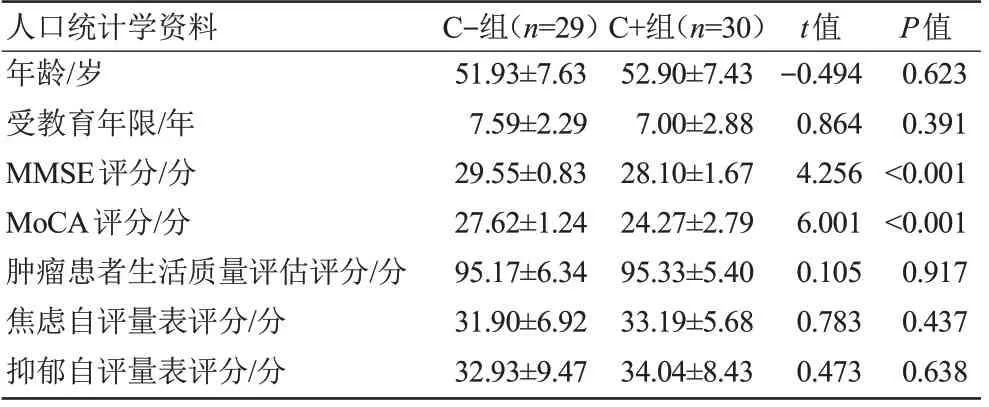
表1 研究对象的一般资料Tab.1 General data of the study subjects
GMV:与C-组相比,C+患者左侧枕中回(MNI:X,Y,Z=-10.5,-105.0,0.0)、右侧距状裂周围皮层(MNI:X,Y,Z=15.0,-103.5,-1.5)GMV减小(表2,图1)。

图1 C+组与C-组灰质体积比较,蓝色代表灰质体积减小区域(左侧枕中回、右侧距状裂周围皮层)。C+:化疗后;C-:化疗前。Fig.1 Comparison of differences in gray matter volume (GMV) between the C+ and C- groups, blue indicates areas of reduced gray matter volume(left middle occipital gyrus; right calcarine fissure and surrounding cortex).C+: chemotherapy treatment; C-: without chemotherapy treatment.

表2 C+组及C-组两组间脑灰质体积差异有统计学意义的脑区Tab.2 Brain regions with statistically significant differences in gray matter volume between the C+ and C- groups
FC:以左侧枕中回为种子点,与右侧颞极:颞上回(MNI:X,Y,Z=63,3,-3)、左侧颞上回(MNI:X,Y,Z=-54,-12,3)FC 减弱(FWE cluster size>84,P<0.001);以右侧距状裂周围皮层为种子点,与左侧舌回(MNI:X,Y,Z=-33,-87,-15)FC减弱(FWE cluster size>104,P<0.001)(表3~4,图2~3)。
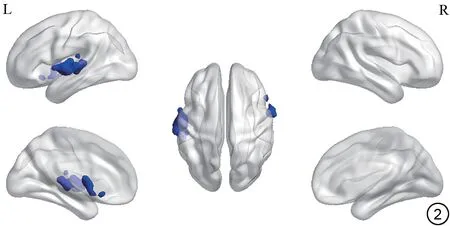
图2 C+组与C-组以左侧枕中回为感兴趣区,功能连接存在差异的脑区(右侧颞极:颞上回、左侧颞上回)。C+:化疗后;C-:化疗前。Fig.2 The brain regions with differences in functional connectivity with the left posterior cingulate gyrus as ROI between the C+ group and the Cgroup (right temporal pole: superior temporal gyrus, left superior temporal gyrus).C+: chemotherapy treatment;C-: without chemotherapy treatment;ROI: region of interest.
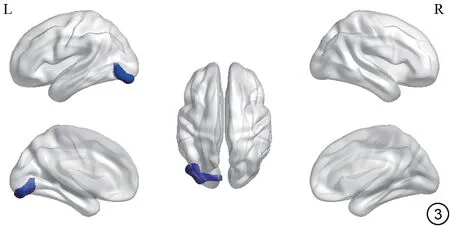
图3 C+组与C-组以右侧距状裂周围皮层为感兴趣区,功能连接存在差异的脑区(左侧舌回)。C+:化疗后;C-:化疗前。Fig.3 The brain regions with differences in functional connectivity with the right calcarine fissure and surrounding cortex as ROI between the C+group and the C- group (left lingual gyrus).C+: chemotherapy treatment;C-: without chemotherapy treatment; ROI: region of interest.

表3 C+组与C-组以左侧枕中回为ROI的功能连接比较Tab.3 Comparison of functional connectivity between the C+and C- groups with the left middle occipital gyrus as the ROI

表4 C+组与C-组以右侧距状裂周围皮层为ROI的功能连接比较Tab.4 Comparison of functional connectivity between groups C+ and C- using the right peritalar fissure cortex as the ROI
相关性:在将年龄及受教育年限作为控制变量进行偏相关分析,结果显示C+患者GMV 值与FC 值与心理认知结果之间未存在明显相关性。
3 讨论
本研究采用VBM 及FC 方法观察乳腺癌化疗患者大脑结构及功能异常,旨在为CRCI 的发生发展提供影像学依据。结果发现化疗患者左侧枕中回右侧距状裂周围皮层GMV 减小;FC 结果表明,以左侧枕中回为种子点,与右侧颞极:颞上回、左侧颞上回FC减弱;以右侧距状裂周围皮层为种子点,与左侧舌回FC 减弱。这项研究通过结构及功能MRI 结合方法为CRCI发生发展提供了新的见解。
3.1 化疗患者GMV变化
GM 是一种神经组织,含有密集的神经元细胞体,是信息处理的中心,能对外界的各种刺激做出反应,GM 萎缩可能表明神经退行性变或功能障碍[12]。本研究结果显示乳腺癌患者化疗后GMV 萎缩区域分布在枕叶及距状裂周围。人脑中的注意网络分为背侧和腹侧系统,背侧注意网络起源于额顶叶,反应于枕叶[13]。几项研究发现,与健康对照相比,化疗患者在静息状态下背侧注意网络及额顶叶网络功能连通性均发生改变[14-15],从而导致出现CRCI 相应症状,如注意力、记忆、解决问题能力减退。乳腺癌患者化疗后注意力和处理速度出现功能障碍[16]。记忆、注意力、处理速度和执行功能是易受化疗影响的认知领域[2]。之前的纵向研究结果表明,接受化疗的乳腺癌患者在化疗后六个月或一年后,在上述四个领域认知能力下降更明显,尤其是在工作记忆和执行功能方面[17]。从解剖学上看,枕叶与颞叶和额叶有广泛的纤维连接,功能相互影响[18],相关脑DTI研究发现,化疗后额叶、颞叶、枕叶和顶叶脑区白质纤维束完整性均受损[19]。CIORBA等[20]的研究结果发现先天性帕金森病和嗅觉功能障碍患者的枕部GMV减小,同时,在嗅觉正常的志愿者中,气味刺激后枕叶皮层出现广泛激活。因此枕区也被认为与嗅觉加工有关[21]。由此推断枕叶可能在嗅觉过程中发挥了气味识别的作用,化疗药物广泛影响患者身体各项功能,可能出现嗅觉及味觉的改变,且与枕叶结构改变有密切联系。枕叶作为接收和处理视觉信息最重要的大脑皮层,既往研究表明重度抑郁症(major depressive disorder, MDD)患者快感缺乏的严重程度与枕叶谷胱甘肽水平呈负相关,提示MDD 患者枕叶可能存在异常的氧化应激[22-23]。由此,我们可以推测乳腺癌患者化疗后枕叶GMV减小与其出现的抑郁症状密切相关。距状裂周围皮层位于枕叶内侧面,是一种典型的感觉型粒状皮层,主要输入来自丘脑外侧膝状体的视觉信息[24],将视觉信息进行初步加工整合,并与视觉相关记忆及注意等神经心理活动密切相关[25]。这些区域GMV改变可能与化疗诱导的相应认知障碍表现有关。
3.2 FC强度改变
目前已有研究证明化疗会对大脑整体的FC 产生影响[26]。VBM 结果说明乳腺癌患者化疗后已经存在脑结构的改变,为了从功能方面进一步解释认知障碍出现的病理机制,本研究以GMV 差异脑区为种子点进行全脑FC 分析,结果表明以左侧枕中回为种子点,与右侧颞极:颞上回、左侧颞上回FC 减弱;以右距状裂周围皮层为种子点,与左侧舌回FC 减弱。大脑连接对于阐明神经元和神经网络如何处理信息至关重要,揭示了空间分离的脑区之间的功能整合关系[27],脑区间相互连接构成复杂脑网络,而化疗药物可以透过血脑屏障导致神经元受损、连接紊乱进而导致连接完全中断。先前相关纵向研究结果显示,化疗后1 个月额颞叶脑GM 密度急性减小,从而证明额颞叶是对化疗损伤最敏感的大脑区域。化疗后常见的认知问题是记忆力损害,包括情景记忆和工作记忆。内侧颞叶结构对情景记忆至关重要[28-29]。舌回也被称为枕颞叶内侧回,介于侧副沟和距状沟之间,舌回的后部属于枕叶,前部则归入颞叶,属于初级视觉皮层,与外周枕叶皮质共同参与视觉信息的整合与处理,尤其是与字母加工及记忆相关[30]。舌回同样被证实在逻辑分析和视觉编码方面起作用。本研究结果与既往大部分研究相似,表明额叶、颞叶及枕叶为易受化疗药物影响的区域,但这种“易感区域”的机制目前仍未明确。可能与髓鞘化的速度有关,即最晚进行髓鞘化的区域更易受到化疗药物的影响[31]。既往关于认知障碍相关疾病(肝性脑病、阿尔茨海默病)等脑结构及功能研究结果也出现上述相关脑区的改变[32-33],这说明上述脑区与认知障碍的发生发展有着密切联系。
3.3 局限性
本研究存在一定的局限性。第一,试验样本量相对较少,不同化疗药物的作用机理不同,可能会对试验结果产生不同的影响。在接下来的研究中,将会继续收集患者,探讨不同化疗药物影响认知的具体机制;第二,研究对象存在一定异质性,如绝经状态的不同,由于目前样本量较小,无法进行分层评估;第三,本研究观察患者化疗后短期内脑改变,后续应增加观察时限,详细探索不同时期脑结构及功能损害程度。
4 结论
综上所述,本研究通过VBM 与FC 相结合的方法,为乳腺癌患者化疗后产生认知障碍提供了神经解剖学基础,从影像学角度上进一步解释了CRCI 发生发展机制,为化疗患者认知功能康复干预提供了重要依据。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:田为中设计本研究的方案,对稿件重要内容进行了指导与修改,获得了江苏省卫健委科研课题和江苏省333 高层次人才科研项目的资助;宋雅琪起草和撰写稿件,获取、分析和解释本研究的数据;李一凡、夏建国获取、分析或解释本研究的数据,对稿件重要内容进行了修改,其中夏建国获得了江苏省第五期“333 工程”科研项目的资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
