用于分离单糖与寡糖的亲水色谱材料制备及应用进展
2024-05-20张丹丹矫芮文米春孝汪秋宽任丹丹何云海
张丹丹,矫芮文,米春孝,陈 菊,李 想,2,3,汪秋宽,2,3,任丹丹,2,3,何云海,2,3,武 龙,2,3,周 慧,2,3,*
(1.大连海洋大学食品科学与工程学院,辽宁 大连 116023;2.国家海藻加工技术研发分中心,辽宁 大连 116023;3.辽宁水产品加工及综合利用重点实验室,辽宁 大连 116023)
在食品科学、医药科学、生命科学等领域中,糖类化合物起着不可或缺的作用。按组成糖类化合物可分为3 类:单糖、寡糖和多糖。单糖是不能进一步水解的多羟基醛或多羟基酮,为最小的糖类分子,其中L-阿拉伯糖、D-葡萄糖、D-甘露糖和D-核糖等单糖已广泛用作食品添加剂和营养补充品[1]。寡糖是由2~10 个单糖通过糖苷键组合而成的低聚物[2],具有抗氧化、抗癌、抗菌、抗病毒等多种生物活性[3],是一种新型功能性糖源。目前,自然界中主要存在的单糖是戊糖和己糖,前者大都以形成多糖的成分存在,后者则以游离或结合的形式存在;自然界中存在的天然寡糖很少,仅有极少数的植物含有天然的功能性寡糖[4-5]。更多的单糖、寡糖是以多糖为原料通过化学降解或酶降解,然后分离制得。因此,无论是天然存在的单糖和寡糖,还是通过降解获得的单糖和寡糖,都需要分离纯化。
自20 世纪70 年代起,高效液相色谱(high performance liquid chromatography,HPLC)法因其灵敏度高、选择性好、分离效率高等优点而广泛应用于复杂化合物的分离和分析[6-7]。根据固定相与分析物之间的相互作用,分离模式可分为离子色谱(ion chromatography,IC)、亲水作用色谱(hydrophilic interaction chromatography,HILIC)、反相液相色谱(reversed-phase liquid chromatography,RPLC)和正相液相色谱(normal-phase liquid chromatography,NPLC)等。IC主要包括3 种色谱模式,其中应用最广泛的是离子交换色谱(ion-exchange chromatography,IEC),该方法主要用来分离含有电解质的混合物,其固定相通常采用具有离子交换功能的不溶性高分子化合物[8];RPLC通常用来分离中低极性和非极性的化合物,该固定相通常是以硅胶为基质,表面接枝极性较弱的官能团[9];NPLC的固定相一般采用硅胶、极性基团键合的硅胶和氧化铝等,分离对象为中等极性和较高极性的化合物。
单糖和寡糖分子中的极性基团与RPLC固定相之间缺乏偶极矩作用,样品难以或无法被保留[10],单糖和寡糖难溶于典型的NPLC流动相,因此RPLC和NPLC不适用于分离糖类化合物。糖类化合物一般呈弱酸性,在碱性流动相中带负电荷,可以通过IC实现分离。Li Yuqing等[11]采用新型IEC固定相在7 min内完全分离了6 种单糖,且分离度超过1.56,柱效高达20 400~27 300 N/m。曹莉[12]采用商用CIC-300型IEC色谱柱分离了8 种单糖,回归率都大于0.996。然而,大部分糖类化合物具有相似的结构单元或分子结构,且保留性极弱,只有拥有足够容量和高选择性的IC固定相才能实现糖类化合物的分离[13]。Alpert等[14]于1990年提出了HILIC并阐述了其保留机理,图1显示了HILIC与其他3 种色谱的主要特点。近几十年来,将HILIC应用于糖类等强极性化合物的分离一直是色谱领域的研究热点。相比于RPLC、NPLC,HILIC的流动相和固定相均采用强极性物质,这样既可以溶解又可以保留极性分析物[15],成为分离单糖和寡糖的重要手段。HILIC固定相通常采用裸硅胶或接枝极性官能团的硅胶[16],其中,后者的应用更为广泛。目前已发展了氨基键合固定相、酰胺类键合固定相、糖类键合固定相、两性离子键合固定相等数种HILIC固定相[17]。
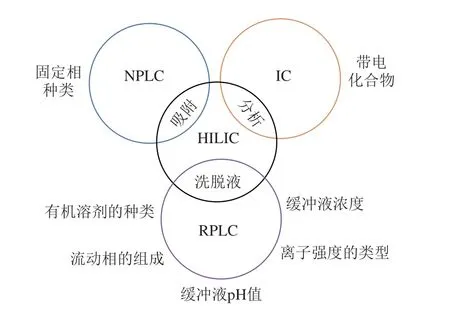
图1 HILIC和其他3 种液相色谱的特征[18]Fig.1 Characteristics of HILIC and three other kinds of liquid chromatography[18]
本文对用于分离单糖和寡糖的HILIC固定相进行综述,并分析影响HILIC行为的主要指标,以期为单糖和寡糖的分离提供参考。
1 HILIC固定相的种类及制备方法
1.1 氨基键合固定相
氨基键合固定相主要通过氨基基团直接键合到硅胶表面制得,是最早用于HILIC模式的极性固定相。其中氨丙基固定相为最经典的氨基固定相[19],结构如图2所示。该固定相的分离机制主要是吸附与分配,根据不同糖类在固定相和流动相之间的分配系数不同实现分离。
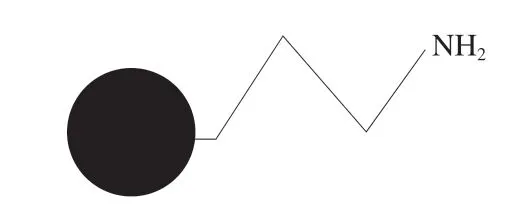
图2 氨丙基固定相的结构Fig.2 Structure of aminopropyl stationary phase
1975年Linden等[20]利用氨基修饰硅胶固定相成功分离单糖(葡萄糖、果糖)和寡糖(蔗糖、麦芽糖、蜜二糖、蔗果三糖以及棉子糖)。此类固定相制备简单、分离范围较宽,但氨基呈弱碱性,氨基柱与酸性物质有较强结合能力,易与强酸性物质产生不可逆吸附;同时氨基官能团反应活性高、易与还原糖中的醛基反应生成席夫碱,从而改变固定相与分析物的性质,导致氨基键合固定相稳定性差、寿命短、色谱峰保留时间长。
为了解决传统氨基固定相反应活性高的问题,研究人员开发了改进的键合氨基固定相。薛昆鹏等[21]将硅烷化试剂(3-氨丙基二异丙基乙氧基硅烷)键合到硅胶表面,合成了具有异丙基侧链的新型氨基键合硅胶固定相,使氨基固定相不仅含有氨丙基官能团,还增加了异丙基官能团。其中,异丙基官能团主要起到保护氨基的作用,增强氨基在硅胶表面的稳定性,从而避免氨基在硅胶表面脱落。因此该新型固定相具有更高的稳定性和更好的耐水性,能够有效地屏蔽氨基对分析物的吸附作用,减少拖尾现象。为了测定该固定相对糖类化合物保留的影响,该学者进一步研究了乳糖和蔗糖的色谱保留行为。结果表明,乳糖和蔗糖在14 min内完全实现了基线分离,分离度高达3.03,而且峰形正常、无拖尾现象。
咪唑类化合物作为离子液体前体化合物,具有蒸气压低、热稳定性高和易溶于水的特点。咪唑含有定域对的氮环原子,可以与氨基形成配体。近年来咪唑离子液体与氨基联用广泛应用于HILIC固定相的制备,可用于分离多种复杂分析物。刘士佳等[22]已证实咪唑嵌合的氨基亲水固定相不仅可以实现极性化合物和异构体的有效分离,且结果优于传统的氨基固定相。Song Liujun等[23]将咪唑离子液体衍生的碳点(imidazolium ionic liquidsderived carbon dots,ImCDs)包覆在氨基硅胶表面制备了咪唑离子液体碳点改性氨基固定相(图3)。该固定相同时提供了咪唑、羟基和羧酸等丰富的官能团,提高了对亲水化合物的分离能力。在分离单糖(脱氧核糖、核糖、来苏糖、阿拉伯糖、果糖)和二糖(蔗糖、乳糖)时,所有糖类均实现了基线分离。该色谱柱不仅解决了未经咪唑改性的氨基柱分离不完全和峰形过宽的问题,还缩短了分离时间。同时,Guo Dandan等[24]利用咪唑类化合物易与卤代烃实现一步反应的特点,直接将咪唑基团引入3-氯丙基固定相的表面,随后通过离子交换反应制备得到3 种接枝不同阴离子的固定相(SilprAprIm Cl、SilprAprIm BF4、SilprAprIm Tf2N)(图4)。其中,BF4-离子对比Cl-和Tf2N-离子具有更好的分离效果和更长的保留时间。此外,由于咪唑基团的引入,该固定相与氨丙基硅胶柱相比,除了具有吸附和分配作用,还增加了静电相互作用和偶极-偶极相互作用,因此在更短时间内分离出8 种糖类混合物,且成功分离出寡果糖中的蔗果三糖、蔗果四糖和蔗果五糖。离子液体改性后的氨基键合固定克服了传统氨基固定相容易吸附部分糖(如阿拉伯糖和半乳糖)和存在拖尾的现象等缺点,耐用性也大大增强。
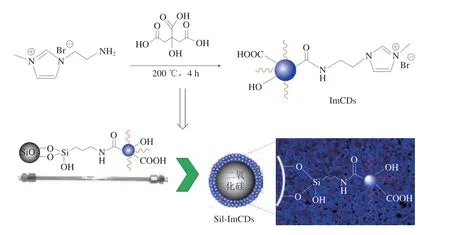
图3 Sil-ImCDs的制备示意图[23]Fig.3 Schematic diagram of Sil-ImCD synthesis process[23]
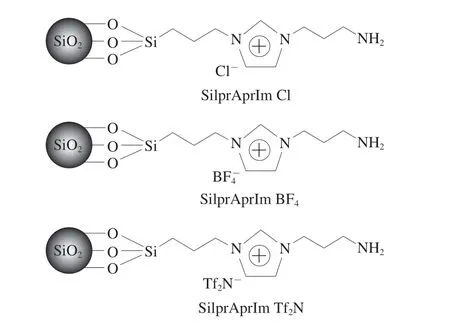
图4 3 种咪唑嵌合氨基键合固定相的结构[24]Fig.4 Structures of three imidazolium-bridging amino-bonded stationary phases[24]
1.2 酰胺类键合固定相
酰胺键合固定相是在硅胶或聚合物微球上接枝氨基甲酰基或酰胺基,基于氢键吸附原理和亲水分配机理实现糖类等极性化合物的分离。固定相中的亲水基团与糖分子之间形成的氢键越多,吸附则越强。酰胺键合固定相的传统制备方法(两步合成法)如图5所示,首先将硅胶表面氨基化,然后酰卤与硅胶表面的氨基反应即可得到含酰胺官能团的色谱固定相[25]。但是该合成路线制备的固定相表面键合链不均一,而且会产生酯和氨基等副产物。此外,该固定相表面的氨基容易与酸性溶质发生离子交换反应,造成柱效降低和峰形的拖尾。
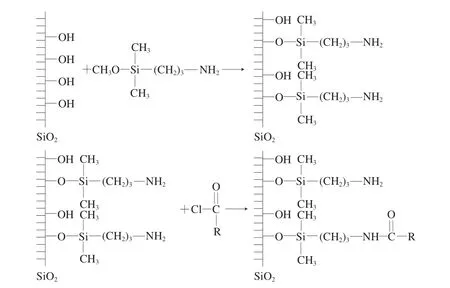
图5 酰胺键合固定相的传统制备方法[25]Fig.5 Traditional preparation process of amide bonded stationary phase[25]
N-异丙基丙烯酰胺(N-isopropyl acrylamide,NIPAM)是一种高极性聚合物,具有很好的亲水性和热响应特性,易通过温控分离技术制备硅胶固定相[26]。2020年,Fan Fangbin等[27]采用水热法,利用加成反应在包覆L-半胱氨酸的二氧化硅球表面接枝NIPAM,制得含有羧酸、羟基和酰胺官能团的酰胺固定相(图6)。在该固定相条件下,以乙腈、水和乙酸铵为流动相,10 种极性不同的单糖(核糖、木糖、阿拉伯糖、果糖、葡萄糖)和寡糖(蔗糖、麦芽糖、乳糖、松三糖、棉子糖)标准品在60 min内分离完全,异构体(葡萄糖和果糖)的分离结果证明了此酰胺固定相具有结构选择性。其中,松三糖的实际塔板数可达到45 700 板/m,显著高于同条件下的裸硅胶柱。该柱子还具有良好的稳定性,标准品的峰形和分辨率在连续3 d检测下仍基本保持不变。此外,聚丙烯酰胺因其优良的亲水性,在酰胺类HILIC固定相中已得到较多应用[28]。在碱性溶质的保留方面,聚丙烯酰胺固定相表现出了比纯硅胶柱更好的分离性能和重现性。Cai Jianfeng等[29]通过引发剂偶氮二异丁腈将聚丙烯酰胺固定到硅胶表面,合成了含有氨基、羟基和酰胺官能团的聚丙烯酰胺型色谱固定相。与商用X-Amide酰胺柱相比,该固定相对低聚木糖、低聚果糖和低聚壳寡糖表现出更显著的分离效果,柱效高达121 000 N/m。在该固定相条件下,以乙醇-水体系为流动相替代有毒的乙腈-水体系,该方法使整个分离过程更安全,且有效控制了成本。杨铎等[30]使用丙烯胺修饰硅胶,以偶氮二异丁腈为引发剂,通过巯基-烯烃点击化学反应将亲水的聚丙烯酰胺固定在烯基修饰的二氧化硅颗粒上,制备了含有酰胺和氨基亲水性官能团的聚丙烯酰胺固定相。该相仅在8 min内便实现了不同聚合度(2~7)β-1,4-低聚半乳糖的分离,分离度大于1.5,且无拖尾现象,展现了该固定相在寡糖等极性化合物分离中的可行性和高效性。
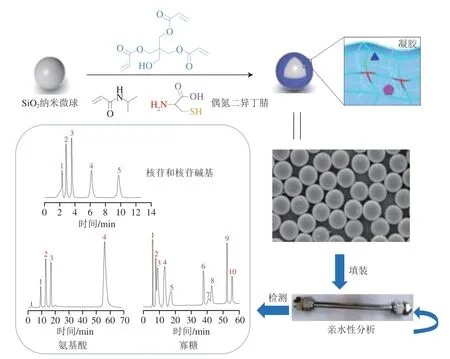
图6 Cys-Si-NIPAM的合成流程[27]Fig.6 Synthesis process of Cys-Si-NIPAM[27]
酰胺键合固定相的亲水性官能团较多、亲水性强,适用于分离强极性化合物;由于酰胺官能团排斥带正电荷的碱性溶质,在酸性或中性环境下会阻碍溶质与硅醇基间的离子交换反应,因此酰胺类硅胶色谱柱不易产生不可逆吸附、稳定性更好、使用寿命更长[31];此外,酰胺键合固定相的pH值适用范围较广,在典型的HILIC流动相pH值范围内不会发生离子化,使其对溶质的保留效果受离子交换作用的影响很小,而且酰胺官能团可与硅胶表面的水合层作用,从而改善碱性溶质的选择性[32]。
1.3 糖类键合固定相
糖类化合物表面暴露的高密度羟基基团使其具有良好的亲水性。糖类键合固定相上羟基可与极性分子等形成很强的氢键作用,能够吸附流动相中的水分子,在固定相表面形成一层水化膜,从而对单糖、寡糖等极性化合物产生极强的保留作用。
叠氮-炔环加成反应因灵敏度高、特异性好和稳定性强等独特优势,已成为点击反应中应用最广泛且经典的反应[33]。通过叠氮-炔环加成反应制备糖类固定相时,首先要实现糖类的炔烃化和硅胶的叠氮化,然后在Cu(I)的催化下,糖类化合物中的炔烃与硅胶中叠氮基的不饱和键发生1,3-偶极环加成反应,即可将糖类化合物引入二氧化硅表面,制得糖类固定相[34-35]。早在2009年,Fu Qing等[36]采用此方法通过麦芽糖的炔烃化(图7a)制备了麦芽糖键合的固定相(图7b)。该色谱柱通过糖和麦芽糖之间的直接氢键作用和表面吸附机制对糖进行保留,可在15 min内完成7 种糖类混合物(山梨糖、葡萄糖、松二糖、纤维二糖、海藻糖、松三糖、棉子糖)的基线分离,对糖类有着优异的选择能力。近年来,亲和开环反应在合成色谱材料中也得到较多应用,Rathnasekara等[37]以γ-环氧丙氧基丙基三甲氧基硅烷为硅烷偶联剂,将裸硅胶转化为环氧活化硅胶,在三氟化硼乙醚络合物的催化下,通过开环反应分别将麦芽糖和山梨醇接枝到环氧树脂改性的硅胶表面,即通过两步法得到了均含有羟基官能团的两种糖类固定相;这两种固定相对极性溶质(如衍生的葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖、麦芽七糖)表现出很好的分离效果。其中麦芽糖固定相由于具有更多的羟基官能团,因而极性分析物在麦芽糖柱固定相上具有更高的分离效率和保留值。
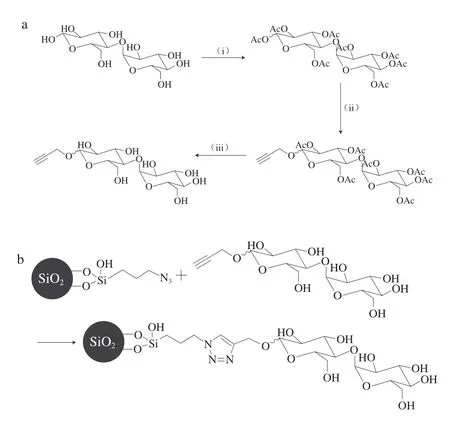
图7 炔烃化麦芽糖的合成路线(a)和炔烃化麦芽糖在二氧化硅表面的固定化(b)[36]Fig.7 Synthesis route of alkynylated maltose (a) and immobilization of alkynylated maltose on the silica surface (b)[36]
环糊精(β-cyclodextrin,β-CD)是具有空腔结构的环状低聚糖(图8)[38],特殊的分子结构使其能够选择性地与溶质形成包合物;此外,β-CD外侧结构中的伯羟基基团赋予了其亲水特性,提高了水溶性差的有机化合物的溶解度[39],使其可制备得到具有HILIC特性的固定相,用于分离极性及亲水性物质。李强等[40]首先通过酰胺键将氧化石墨烯键合到氨基硅胶上,随后通过氢键作用将β-CD化学键合到氧化石墨烯上,制备了基于氧化石墨烯的环糊精型固定相;该固定相存在大量羟基和醛基等含氧的极性官能团,具有典型的亲水色谱特征。将该固定相用于胸腺嘧啶、胞嘧啶、肌苷和鸟苷的分析发现,这些分析物在40 min内全部得到了分离。除此之外,该固定相还可用于分离手性化合物,具有手性色谱和HILIC两种分离模式,有效扩大了分析样品的范围。
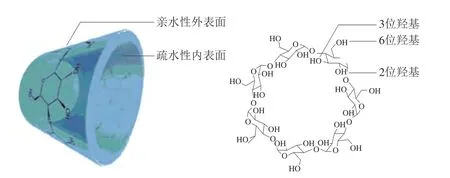
图8 β-环糊精的结构[38]Fig.8 Structure of β-cyclodextrin[38]
糖类固定相含有丰富的羟基,能够在空间上形成多位点的氢键作用[41],因而对糖类有着较强的识别和保留能力。然而,该固定相制备流程较为复杂,部分糖分子需要通过特定基团修饰后,方能与二氧化硅表面的官能团反应[42];此外,该固定相适用范围窄,更适合分离单糖等结构简单、分子质量小的糖类,对于结构复杂和分子质量大的糖类分离效果较差。
1.4 两性离子键合固定相
两性离子键合固定相表面或内部含有数目相同的正负电荷,整体呈现电中性[43];理想情况下,两性离子固定相含有等量的强酸性和强碱性基团。该固定相上极性较强的活性基团能通过氢键作用形成牢固的吸附水层,使亲水性大大增加。因此,该固定相主要通过离子交换和亲水混合作用分离糖类等极性化合物。
两性离子固定相的键合方法主要有直接合成法和间接合成法。直接法主要是将化合物(大多采用1,3-丙磺酸内酯)和含叔胺基团的单体反应得到两性离子单体,然后通过自由基聚合反应将两性离子单体接枝到基质上制备得出(图9a)[44];间接合成法是先在基质上聚合一个连接臂,再将含两性离子基团的化合物接枝到基质的连接臂上(图9b)[45],该方法比直接合成法过程简易可控,但两性离子的利用率较低。
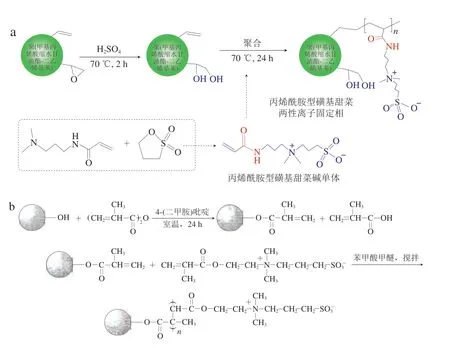
图9 直接合成法(a)和间接合成法(b)制备两性离子固定相[44-45]Fig.9 Preparation of zwitterionic stationary phase by direct (a) and indirect (b) synthesis[44-45]
根据功能基团的分子结构,两性离子固定相的种类主要分为甜菜碱型、离子液体型、氨基酸型和磷酰胆碱型[46],这4 种类型固定相的结构特点如表1所示。
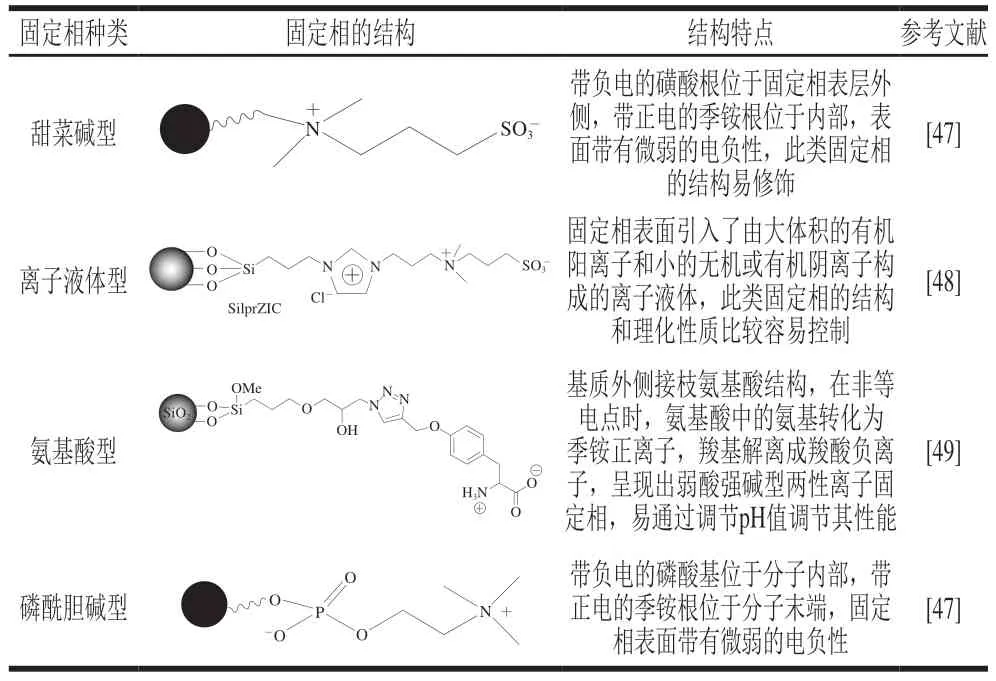
表1 两性离子固定相的种类Table 1 Types of zwitterionic stationary phases
其中,甜菜碱型和磷酰胆碱型是最具代表性的两性离子固定相,此类两性离子固定相的制备方法是基于可逆加成-断裂链转移自由基聚合法[50]和原子转移自由基聚合法(atom transfer radical polymerization,ATRP)[51]。甜菜碱还可分为羧基甜菜碱[52]、磺基甜菜碱[1]和磷酸脂甜菜碱[53]。磺基甜菜碱固定相是最早应用于亲水色谱的甜菜碱型两性离子固定相。2021年,Liu Xuefang等[44]以1,3-丙磺酸内酯和N-[3-(二甲氨基)丙基]丙烯酰胺为原料,通过开环反应合成了丙烯酰胺型磺基甜菜碱单体,再通过该单体和聚(甲基丙烯酸缩水甘油酯-二乙烯基苯)的侧双键共聚反应,制备了一种基于聚合物的磺基甜菜碱两性离子固定相。该固定相具有磺基甜菜碱型两性离子官能团,对单糖、二糖和三糖等8 种寡糖全部实现了分离,显示出其对强极性分析物良好的分离能力。此外,该固定相还能够精确分离核糖、木糖、葡萄糖的α-和β-异构体,弥补了HILIC在分离同分异构体糖中的不足。
咪唑离子液体由于其独特的结构特性和物理化学性质,在两性离子键合固定相领域也得到了应用。杨晨曦等[48]利用3-二甲胺基丙胺和乙二醛的反应生成咪唑单体,将其接枝到3-氯丙基硅胶制备了咪唑型离子液体硅胶,再与N,N-二甲基甲酰胺和1,3-丙烷磺内酯反应,得到了含有叔胺基和磺基甜菜碱型两性离子官能团的离子液体型两性离子色谱固定相,其中咪唑基团发挥亲水分离作用,两性离子官能团发挥离子交换分离作用。通过对多种糖类化合物进行分离,发现该色谱材料对单糖、二糖和三糖具有良好的分离效果。
两性离子固定相因带有相同物质的量的相反电荷基团,不易产生自发聚合,而且固定相表面形成的吸附水层可以避免硅羟基的死吸附[54]。此外,该色谱固定相制备简单、易改性,具有生物相容性高、抗污染、亲水性强、pH值耐受范围较宽、分离效率高、能够改善同分异构体的分离选择性以及与质谱有良好的兼容性等优点[55-58]。不过目前该色谱材料种类较少,但由于其显著的优点,两性离子固定相已成为了HILIC前沿的研究热点,大量研究者专注于研制新型两性离子色谱分离材料,极大拓展了该固定相在HILIC领域的应用。
1.5 混合模式固定相
混合模式色谱(mixed-mode chromatography,MMC)是一种固定相同时通过多种作用力(通常为2~3 种)实现溶质保留和分离的色谱方法[59]。1986年,Halfpenny等[60]首次提出混合模式色谱的概念,并使用反相和离子交换模式分离了核苷、碱基等极性化合物。适用于单糖/寡糖分离的MMC模式主要有离子交换/亲水型混合色谱(IEC/HILIC)、亲水/疏水型混合色谱(HILIC/RPLC)和离子交换/亲水/疏水型混合色谱(IEC/HILIC/RPLC)。
IEC/HILIC型混合色谱是将亲水基团和具有离子交换作用的基团通过ATRP和点击化学反应键合到色谱材料表面,利用溶质和固定相之间的亲水作用和电荷作用达到分离糖类化合物的目的。在该模式下,分离样品先根据离子作用力的强弱进行洗脱,对于含有相同电荷的样品再通过亲水作用力的大小进行二次洗脱。因此,相比于单一的IEC和HILIC,该混合模式有效提高了分离选择性和灵活性。娄旭华等[61]利用亲核取代反应将聚乙烯马来酸酐键合到氨基硅胶表面,再将残余马来酸酐水解,制备了IEC/HILIC型色谱固定相,其中氨基亲水官能团提供HILIC模式,水解得到的羧基官能团则提供IEC模式;将该固定相用于分离单糖混合物、核苷和核酸碱基等极性化合物时,8 种单糖在氢键、离子交换和亲水等多种作用力下,仅在12 min内就实现了完全分离。IEC/HILIC型混合色谱将离子交换作用和亲水色谱的吸附、分配作用结合,扩大了分析物的范围,弥补了单一色谱模式在分离中的不足。目前该混合模式色谱固定相多用于分离多肽和蛋白质,在糖类分离中仍有较大的发展空间。
HILIC/RPLC型混合模式色谱是将亲水基团和疏水基团同时连接到色谱固定相表面,同时具有亲水与疏水两种保留机制,根据糖类物质不同的亲疏水性达到分离的目的[62]。金属有机框架(metal-organic frameworks,MOFs)作为一种晶体多孔结构材料,在吸附和分离方面具有十分广阔的前景。然而,MOFs未改性材料存在形状和粒径分布不均匀的缺点,在分离中容易出现柱效低、柱压高的问题,所以制备尺寸均匀的MOFs复合材料是一种提高色谱分离性能行之有效的方法。因此Si Tiantian等[63]将聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)包覆在镍金属有机骨架上有效控制颗粒的形状和尺寸,随后将改性后的MOFs材料直接键合到SiO2表面,得到可分离亲水和疏水化合物的混合色谱固定相。其中,PVP为该固定相提供了大量的C—N、C—O疏水基团,同时固定相中的酰胺和羧酸基团又为其提供了亲水效果。研究发现,该固定相可实现多种单糖(鼠李糖、核糖、果糖)、二糖(蔗糖、乳糖)和三糖(松三糖、棉子糖)等糖类的分离,单糖首先被洗脱出,其次是二糖、三糖。这种混合色谱柱分离效率高、流动相兼容性好,但在碱性环境中的稳定性还需进一步提高。近年来,HILIC/RPLC型混合色谱固定相多用于分离核苷和核酸碱基[64-66]、多芳香烃[67-68]、酚类物质[69]等,在糖类分离分析中应用较少。
混合模式固定相结合了两种及以上的色谱模式,在分配过程中表现出多种作用力和分配机理。因此,相比于单一的色谱模式,该固定相色谱性能更强、适用范围更广,不仅对复杂样品具有很好的分离效果,在分离常见样品时也具有更好的分离选择性[70]。然而,混合色谱固定相还存在分离材料合成步骤复杂、耐久性低、产率低和重复性较差等缺陷[71],而且在糖类分离中的应用仍十分有限。
综上所述,表2总结了亲水色谱固定相的种类以及适用单糖和寡糖特点、分离优缺点及柱效。
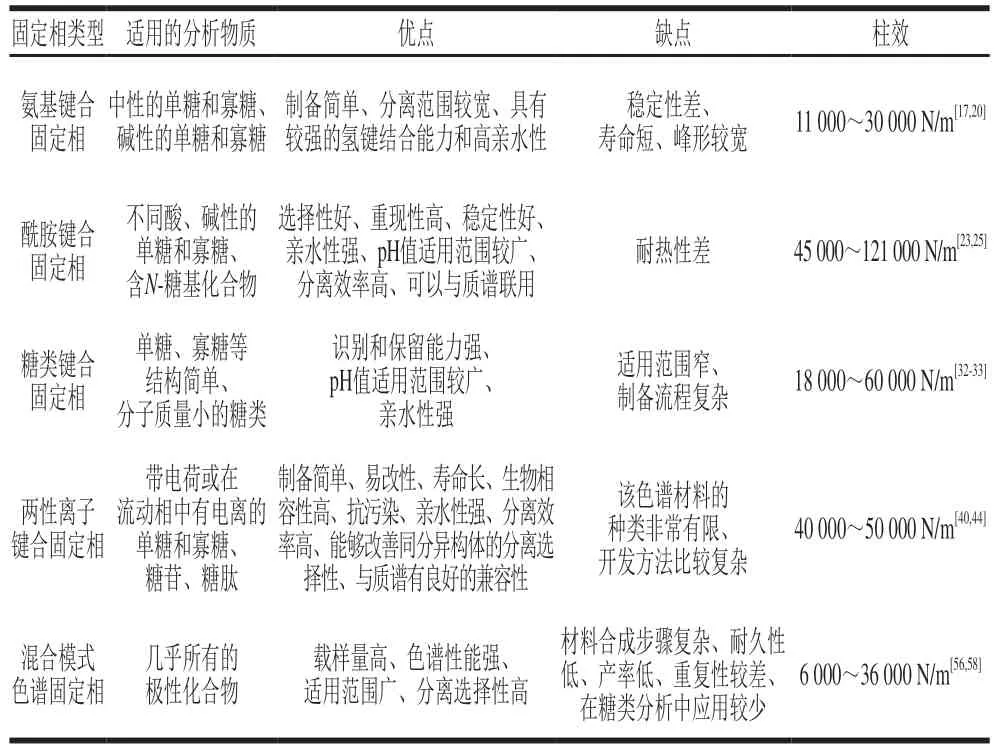
表2 各类型色谱固定相适用单糖和寡糖的特点、优缺点及柱效Table 2 Characteristics,advantages and disadvantages and column efficiency of various types of chromatographic stationary phases for the separation of monosaccharides and oligosaccharides
2 HILIC行为影响指标
在HILIC分离过程中,除了固定相的化学和物理性质,有机溶剂种类及比例、流动相的盐浓度、pH值和柱温等色谱分离条件对单糖和寡糖的选择及保留有很大影响[72]。
2.1 流动相中乙腈含量
HILIC模式中常用的有机溶剂有乙腈、甲醇、乙醇、丙酮等。甲醇是一种质子型溶剂,当其作为流动相时,分析物的容量因子较小,进而导致分离效果降低或出现峰形不对称、峰展宽的情况[73]。乙醇分子中的羟基可形成氢键,因此会产生不易与待测组分分离和黏度较大的问题,进而引起色谱柱压力过高。丙酮溶解度高、黏度和毒性较低,理论上是一种理想的流动相,但其截止吸收波长较高,仅适用于吸收高于330 nm波长的样品,该特点限制了其适用范围。乙腈因易与水混溶、无法提供或接受质子、不会与固定相发生氢键作用、截止吸收波长低等优点,得到了最为广泛的应用。
当改变流动相中乙腈比例时,色谱的分离选择性会随之发生改变[74]。通常乙腈的体积分数在70%~97%之间[27,75]。在此范围内,随着乙腈含量的提高,分析物与固定相之间的氢键相互作用不断加强,大多分析物的保留也随之增强。例如,利用SilprZIC亲水色谱柱分离12 种糖类化合物(5 种单糖、5 种二糖和2 种三糖)时,在70%~90%乙腈体积分数范围内,所有糖类的保留因子均随着流动相中乙腈体积分数的增加而逐渐增加,如在乙腈体积分数为70%时,海藻糖的保留因子仅为3,在体积分数为90%时可达22[48]。Guo Dandan等[24]验证了在典型的HILIC硅胶色谱柱条件下,提高流动相中乙腈含量会增强糖类化合物的保留和分离。以8 个糖类样品为分析物,研究了乙腈含量在氨基键合相上对极性分析物的分离影响。结果显示,使用75%乙腈作为流动相时,分析物不能被分离,而使用95%乙腈时,分析物被完全分离。显然,流动相中乙腈含量的增加不仅增加了保留因子,而且改善了分离效果。
2.2 流动相缓冲盐浓度
带电荷溶质与HILIC固定相之间会产生静电相互作用,从而影响溶质在色谱柱上的保留[76]。为了改善溶质的保留特性,可以在流动相中加入适宜浓度的缓冲盐调节溶质与固定相之间的作用力,从而调整分析物的保留时间和色谱峰形。在HILIC分析中,最常用的缓冲盐是乙酸铵和甲酸铵,浓度范围通常为5~100 mmol/L[16,77]。
升高缓冲盐浓度会使带电糖类与固定相的静电相互作用(包括吸引与排斥)降低,所以当分析物与固定相之间的作用力为静电排斥时,保留时间延长;当作用力为静电吸引时,保留时间缩短。此外,提高缓冲盐浓度还会导致吸附水层的增厚,从而影响分析物在流动相和吸附水层间的分配,延长分析物的保留时间,但该影响较小[78]。当缓冲盐浓度过高时,流动相容易在高压条件下产生结晶,引起色谱柱和管路的堵塞和损坏[79],而且还会引起分析物峰形过宽,导致选择性较差[80];当缓冲盐浓度过低时,对分析物保留的影响较小;因此选择适合浓度的缓冲盐至关重要。当糖类化合物与固定相之间只有亲水分配作用时,其保留时间随着盐浓度的增加而延长。Česla等[81]考察了两种浓度的乙酸铵溶液对5 种麦芽寡糖(麦芽糖二糖、三糖、四糖、五糖、六糖)在TSKgel Amide-80酰胺柱上保留行为的影响。研究发现,当缓冲盐浓度由10 mmol/L提高至30 mmol/L,5 种麦芽寡糖的保留时间均延长,这是因为盐浓度会影响寡糖与固定相之间的静电排斥作用,盐浓度越高,静电相互作用越小。姜舸等[82]研究了木糖、甘露糖、半乳糖、唾液酸、蔗糖、麦芽糖、乳糖、松三糖和棉籽糖在不同浓度甲酸铵溶液中的保留时间,发现不添加甲酸铵时,带负电的唾液酸和带正电的固定相(Click TE-Cys)之间存在静电相互作用;当甲酸铵溶液浓度增加到10 mmol/L,唾液酸的保留因静电相互作用的减弱而缩短。对于除唾液酸以外的中性糖类化合物在色谱柱上的保留反而因盐浓度的增大而增强,这是因为这些物质与固定相间没有静电相互作用,仅存在亲水分配作用使固定相表面吸附水层的厚度和极性与缓冲盐浓度呈正相关,此时增加盐浓度会增大样品在水相中的分配系数,从而引起溶质的保留时间延长。
2.3 流动相pH值
在HILIC模式下,流动相pH值会改变固定相和溶质的电荷状态,从而影响带电固定相与带电溶质之间的静电相互作用(吸引或排斥),进而影响分析物的保留性[74]。当固定相与极性分析物所带电荷相同时,由于静电排斥作用,分析物的保留性会减弱;反之保留性增强。Yan Jun等[83]在BEH Amide色谱柱上考察了流动相pH值为9.8和10.8时单糖标准溶液混合物(葡萄糖、阿拉伯糖、鼠李糖、半乳糖、甘露糖、木糖、岩藻糖和果糖)的保留行为。单糖pKa值一般为12~13,当pH值为10.8时,与pKa相差1.2~2.2 个pH值单位,可实现pKa与流动相pH值相差不足2 个pH值单位的单糖部分去质子化,从而使酰胺柱上的硅烷醇基团发生静电排斥作用,缩短单糖的保留时间。但是,由于几种单糖酸性太弱,在pH值为9.8的流动相中,几种酸性太弱(即pKa与流动相pH值相差2 个以上单位)的单糖无法解离即去质子化,对单糖的分离无影响。因此在该实验中,随着流动相pH值的降低,静电排斥作用减弱,单糖的保留时间加长、洗脱减慢。为了研究静电相互作用对HILIC固定相分离离子型糖类化合物的影响,Fu Qing等[84]选用酸性葡萄糖醛酸(pKa=1.10)和碱性氨基葡萄糖(pKa=7.78)[85]为分析物,探讨了4 种固定相(相互Clickβ-CD、Click Maltose、XAmide和Click TE-Cys)(图10)在不同流动相pH 6.8和3.0条件下对样品保留行为的影响。当pH值从6.8变化到3.0时,4 种固定相的表面电荷性质均由负电荷转变为正电荷,碱性糖被质子化带正电荷,酸性糖的电离被抑制。碱性糖与固定相之间的作用力会从静电吸引作用变为静电排斥作用,为避免峰形拖尾,pH值为3.0时更适合分离碱性糖,为了减少酸性糖与固定相间的离子交换作用,pH值为6.8时更适合分离酸性糖。
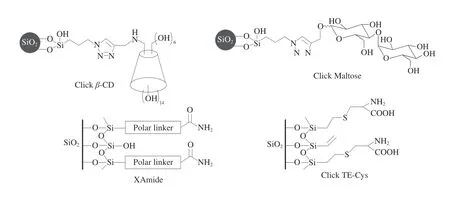
图10 4 种HILIC柱的结构信息[84]Fig.10 Structural information of four HILIC columns[84]
2.4 柱温
色谱柱温度会影响溶质的扩散系数、流动相的黏度以及溶质与固定相之间的相互作用。通常情况下,柱温升高会增大溶质扩散系数,缩短保留时间[86]。例如,杨晨曦等[48]使用自制的SilprZIC两性离子亲水固定相分离鼠李糖、木糖、果糖、甘露糖和葡萄糖时,柱温在25 ℃升至45 ℃的过程中,所有单糖的保留时间都不断下降。但是当溶质与固定相之间的保留机制以静电吸引为主时,溶质的保留会随着温度的升高而增强,分离蔗糖、麦芽糖和海藻糖的保留时间呈现先延长再缩短的趋势,可能是因为二糖和固定相间的作用力开始时主要是静电吸引。此外,柱温还会影响糖的峰形[85-86]。如图11所示,采用新型的Daicel DCpak PTZ酰胺柱分离果糖时,随着温度的升高,果糖的峰形逐渐尖锐且洗脱时间逐渐缩短,不过此时温度对洗脱时间的影响较小[87]。柱温对于分析物在HILIC柱上保留的影响复杂且难以预判,且温度变化对保留率的影响显著小于流动相的组成,因此通常不将温度用作调节色谱选择性的首要参数。一般情况下,色谱柱的适宜温度为30 ℃[24,84,88]。
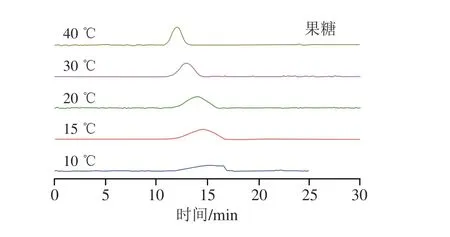
图11 果糖在Daicel DCpak PTZ酰胺柱上的温度依赖性色谱图[87]Fig.11 Temperature-dependent chromatograms of fructose on Daicel DCpak PTZ column[87]
3 结语
单糖和寡糖的色谱分离对于深入进行结构表征和研究生物活性具有重要意义。传统的RPLC和NPLC在极性化合物的分离上受到限制,HILIC是一种更为理想的色谱分离方法。目前已报道的HILIC固定相如氨基键合固定相、酰胺类键合固定相、糖类键合固定相、两性离子键合固定相等已经广泛应用于糖类化合物的分离分析。其中,氨基键合固定相和酰胺类键合固定相已发展为成熟且商业化的色谱固定相,现阶段实验室研究的热点是两性离子键合固定相。在糖类化合物的分离过程中,不同类型的色谱固定相具有不同的适用糖类及优缺点。
尽管单糖/寡糖分离HILIC材料目前已取得重要的研究进展,但仍面临着诸多问题和挑战。第一,能够同时分离酸性、中性和碱性单糖/寡糖的色谱柱较为缺乏,如何制备分离更全面、操作更简单的色谱固定相是一个重要挑战;第二,乙腈是HILIC中最常用的流动相有机组分,但是其毒性高且易挥发,对人体危害较大,因此亟需寻找低毒或无毒的流动相替代乙腈;第三,相对于单一模式的色谱材料,MMC(IEC/HILIC、HILIC/RPLC、IEC/HILIC/RPLC)具有更多优点,尤其是IEC/HILIC/RPLC型混合色谱固定相。该固定相将离子交换、亲水和疏水3 种作用力相结合,大大提高了单根色谱柱的分离能力。然而,MMC固定相制备繁琐,色谱分离条件要求严苛,在糖类化合物分离领域的实际应用较少。为解决上述问题,首先应对不同酸碱性的单糖和寡糖进行结构分析,探索合适的官能团对固定相进行修饰,寻找最适宜的色谱行为指标,发展分离范围更宽的色谱材料;其次,选择极性与乙腈相似,同时无毒或低毒且不会在紫外区有吸收的非质子化有机溶剂作为流动相,以减少乙腈对人体的危害。此外,MMC对糖类的分离不仅需要实验的摸索,更需要色谱分离理论的指导,以实现单糖和寡糖的高效分离。
总地来说,制备适合单糖/寡糖分离的HILIC材料有望推进糖类化合物的深入研究和发展,为食品科学和生命科学等领域提供强有力的技术支撑。在此,期待更多简单高效且适宜糖类分离的色谱材料早日问世,随着色谱分离技术的不断完善与成熟,单糖和寡糖会在各个领域发挥更大的作用。
