黑果枸杞多糖结构表征及对乙醇诱导胃黏膜上皮细胞损伤的影响
2024-05-20安佳鑫续晓琪陈爱君
钱 荣,安佳鑫,续晓琪,2,*,张 涛,陈爱君,李 莎,徐 虹
(1.南京工业大学食品与轻工学院,江苏 南京 211816;2.保龄宝生物科技有限公司,山东 德州 251200;3.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023)
黑果枸杞(LyciumruthenicumMurr.,LRM)是一种茄科多年生刺灌木,广泛地分布在中国西北部,果实被称为黑枸杞[1]。黑枸杞是我国传统的药食同源滋补食物,具有多种生物活性,例如抗疲劳、保护肝脏、降低血糖、保护脑皮质神经元、增强免疫功能等[2-6]。黑枸杞常见的食用方法是热水浸泡后饮用,此时大量水溶性多糖溶于水中,因此,挖掘黑枸杞水溶多糖结构和功能对其在食品工业的开发和应用具有研究意义。多糖的生物活性取决于其主要结构和链构象,据已有报道,黑果枸杞多糖(LyciumruthenicumMurr.polysaccharide,LRMP)为高度分支的α(1→3)键连接的β-半乳糖基,具有不同的分支链取代基[7-9],在β(1→6)-半乳糖的侧链中,末端阿拉伯糖残基数量增加的同时半乳糖残基减少,表明阿拉伯糖残基附着在半乳糖的O-3位置[10],但是LRMP溶解液的高分子链构象尚未明晰。
近年来,胃黏膜损伤导致的胃部疾病频发,这与不恰当的生活方式有关,例如不规律的饮食方式、过大压力和过度饮酒等[11]。胃黏膜上皮细胞(gastric mucosal epithelial cells,GES-1)顶端与相邻细胞侧膜紧密连接形成抵挡胃酸的黏膜屏障[12],组成维持消化道健康的重要一环。据报道,多种功能性多糖具有保护胃黏膜的作用,例如,Liao Bingwu等[13]研究表明,猴头菇多糖可保护GES-1细胞免受H2O2诱导的损伤;Yang Ke等[14]从铁皮石斛叶片中分离出的多糖可抑制造成GES-1细胞损伤的炎症因子。因此,本研究使用乙醇诱导的GES-1细胞损伤模型模拟酒精对人体胃黏膜屏障的影响,并探究LRMP是否具有相似的抑制GES-1细胞损伤的功能。
本研究从市售的黑枸杞中分离纯化了一种水溶性多糖LRMP,分析其单糖组成、糖苷键的连接方式、分子质量和链构象等结构参数,在此基础上,利用GES-1细胞模型评估该多糖对乙醇诱导的细胞损伤的影响,并通过氧化损伤和线粒体染色的结果探究其作用机理,旨在为LRMP作为功能性多糖在健康食品中开发提供理论基础。
1 材料与方法
1.1 材料与试剂
黑果枸杞干果 青海秦仁堂商贸有限公司;GES-1武汉赛维尔生物科技有限公司;三氟乙酸(trifluoroacetic acid,TFA)、1-苯基-3-甲基-5-吡唑酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、乙腈、乙醇、磷酸钠、岩藻糖、鼠李糖、木糖、阿拉伯糖、葡萄糖、甘露糖、半乳糖、葡萄糖酸、半乳糖酸等(均为分析纯)美国Sigma-Aldrich公司;细胞计数(cell counting kit-8,CCK-8)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒 南京草本源生物科技有限公司。
1.2 仪器与设备
752S紫外-可见分光光度计 上海棱光技术有限公司;DEAE Fast Flow琼脂凝胶柱(3.8 cm×10 cm)、ÄKTATMUPC 100系统 美国GE公司;U3000高效液相色谱仪、Nicolet Nexus 470光谱仪 美国赛默飞世尔科技有限公司;Zorbax Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5 μm)美国Agilent公司;QP2010气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)柱上海默克技术有限公司;OHpak SB-806 HQ色谱柱(8.0 mm×300 mm)昭和电工科学仪器(上海)有限公司;Viscostar-II黏度计 美国怀雅特技术公司。
1.3 方法
1.3.1 LRMP的分离纯化
将干燥的黑枸杞干果按1∶4质量比浸入蒸馏水,80 ℃加热搅拌4 h后,离心收集上清液,加入3 倍体积的95%乙醇溶液,4 ℃过夜沉淀并收集粗多糖。采用离子交换柱层析色谱法将收集的粗多糖进行梯度洗脱纯化,洗脱条件:使用ÄKTATMUPC 100系统和DEAE Fast Flow柱(3.8 cm×10 cm),0.2~2.0 mol/L NaCl溶液线性洗脱,洗脱速率为5 mL/min,以2 min/管收集洗脱液,最终收集NaCl浓度为1.4~1.6 mol/L的样品,透析并冷冻干燥后进行实验。使用H2SO4-苯酚法[15]和Bradford法[16]测定LRMP总碳水化合物含量和蛋白质含量。
1.3.2 LRMP的结构表征
1.3.2.1 单糖组成分析
采用PMP衍生-高效液相色谱(high performance liquid chromatography,HPLC)法对LRMP样品单糖组成进行分析。首先,称取2 mg LRMP样品溶解在2 mol/L TFA溶液中,120 ℃条件下水解反应3 h,用NaOH溶液中和水解产物,并用PMP标记;随后,将产物过膜,使用U3000 HPLC系统和XDB-C18色谱柱(4.6 mm×150 mm,5 μm)进行组分分析。以岩藻糖、鼠李糖、木糖、阿拉伯糖、葡萄糖、甘露糖、半乳糖、葡萄糖酸和半乳糖酸作为标准品。通过标准品的保留时间和紫外信号响应值确定单糖组成。HPLC条件:流动相A为乙腈,流动相B为0.1 mol/L磷酸钠缓冲液(pH 6.7),流动相A与B体积比为17∶83;进样体积20 μL;流速1 mL/min;柱温30 ℃;检测波长245 nm。
1.3.2.2 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
将LRMP样品与干燥的KBr混合,压片后进行实验。样品的光谱采用Nicolet光谱仪分析并记录,波长范围为4 000~400 cm-1。
1.3.2.3 甲基化分析
使用改良法甲基化LRMP样品,将LRMP样品溶解在2 mol/L TFA中,121 ℃条件下水解2 h并用NaBH4还原,然后乙酰化将其单糖转换为部分甲基化的糖醇乙酸酯。随后使用GC-MS分析乙酰化样品,通过质谱鉴定甲基化糖的峰,结合GC的峰面积和相应的响应值估计其相对分子质量,并通过有效的碳反应计算部分甲基化糖醇乙酸酯的响应因子。使用的毛细管柱为RXI-5 SIL MS(30 m×0.25 mm,0.25 μm),GC-MS条件:以3 ℃/min速率升至250 ℃,保持5 min;载气为氦气;流速为1.0 mL/min;注射端口和检测器的温度为250 ℃。
1.3.3 LRMP分子特征及链构象分析
使用高性能尺寸排阻色谱(high-performance sizeexclusion chromatography,HPSEC)、多角度激光散射仪和折射率检测器系统测定LRMP的分子特征,使用OHpak SB-806 HQ色谱柱(8.0 mm×300 mm)进行样品分离,流动相为磷酸盐缓冲液(phosphate buffered saline,PBS)(含150 mmol/L NaCl的10 mmol/L Na2HPO4溶液(pH 7.4)),样品的质量浓度为2.5 mg/mL,进样量为50 μL。得到分子质量/kDa、重均分子质量(mw/kDa)、数均分子质量(mn/kDa)和均方半径(Rg),使用ASTRA 6.2.1软件计算特性黏度([η])和流体力学半径(Rh),计算参考式(1)、(2):
式中:Vh为流体动力学体积/nm3,由串联黏度计得到;γ为2.5;NA为阿伏伽德罗常数/mol-1。
1.3.4 GES-1细胞实验
1.3.4.1 细胞培养条件及存活率测试
GES-1培养在1640完全培养基中(含10%胎牛血清、1%青霉素和链霉素),置于37 ℃、5% CO2培养箱中,使用0.25%胰蛋白酶进行消化和传代。在倒置显微镜下观察后取状态良好的细胞进行消化并计数,调节细胞悬液浓度至1×105个/mL,并接种于96 孔板中,每孔100 μL,完全培养基培养12 h直至贴壁。小心弃去上清液,加入含不同质量浓度LRMP样品的培养基中孵育;其中,LRMP样品质量浓度梯度为200、400、600 μg/mL,提前溶解在1640培养基中(不含血清和双抗),孵育时间梯度为12、24、48 h并作为实验组,以在1640完全培养基中培养相同时间的细胞作为对照组,仅添加培养基作为空白组。孵育结束后,每孔加入10 μL CCK-8溶液,继续培养4 h,利用酶标仪在450 nm波长处测定吸光度,以细胞存活率表示细胞活性,参考式(3)计算:
1.3.4.2 构建GES-1乙醇损伤模型
GES-1按照浓度1×105个/mL接种在96 孔板中,完全培养基培养12 h直至贴壁[17]。弃去上清液,换成含有不同体积分数(3%、5%、7%、10%和20%)乙醇溶液的1640培养基(不含血清和双抗)孵育15 min,按照式(3)计算细胞存活率,得到50%存活率时对应的乙醇体积分数。将未添加乙醇的空白对照组和乙醇损伤模型组的细胞存活率与添加不同质量浓度(200、400、600 μg/mL)LRMP样品孵育后再建模的细胞存活率作对比,分析LRMP样品对乙醇损伤细胞的抑制作用。
1.3.4.3 LRMP对细胞乙醇损伤的保护效果评价
总SOD活力测定:按照1.3.4.1节方法布板并加样孵育12 h,用含乙醇的培养基处理细胞15 min,乙醇溶液的体积分数为1.3.4.2节细胞损伤模型所得结果。通过反复冷冻和解冻破坏细胞并释放细胞内成分,2 000~3 000 r/min离心20 min,收集上清液。用酶标仪在450 nm波长处测量吸光度,根据总SOD试剂盒计算细胞液中总SOD的活力。
吖啶橙/溴乙锭(acridine orange/ethidium bromide,AO/EB)荧光染色检测:根据1.3.4.2节构建细胞损伤模型,用2 mL PBS(含1% AO+1% EB)处理20 min。弃去上清液,用PBS洗涤细胞两次。在荧光倒置显微镜下观察细胞形态并拍照。使用Image J 1.47b软件对荧光图像进行定量分析。通过计算绿色和橙红色荧光的比例评估LRMP对GES-1乙醇损伤的影响。
1.4 数据处理
2 结果与分析
2.1 LRMP的一级结构
通过热水提取和色谱柱纯化,LRMP的产率相对于干质量果实为(5.16±0.82)%,LRMP样品纯度较高,其中总糖相对含量为(88.60±1.97)%,蛋白质相对含量为(2.31±0.36)%;如表1所示,LRMP主要由阿拉伯糖、木糖、半乳糖、葡萄糖、岩藻糖和半乳糖醛酸6 种单糖组成。

表1 LRMP单糖组成及物质的量占比Table 1 Composition and content of monosaccharides in LRMP
LRMP的FTIR如图1所示,3 450 cm-1和2 935 cm-1处的吸收峰分别是由O—H和C—H拉伸振动引起。1 620 cm-1和1 418 cm-1处的吸收峰分别由COO—基团的不对称和对称拉伸振动引起。1 330 cm-1处的吸收峰由O—H变形振动引起。在1 090 cm-1和995 cm-1处的吸收峰表明LRMP结构中的糖环存在吡喃糖[18-19]。根据单糖组成的结果,半乳糖是LRMP的主要单糖组分,其次是阿拉伯糖和葡萄糖。
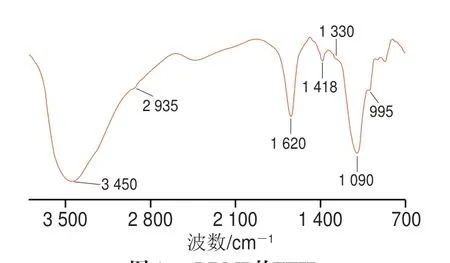
图1 LRMP的FTIRFig.1 FTIR spectrum of LRMP
甲基化反应后进行GC-MS分析是解析多糖结构的有效方法,结合图1,获得多种糖残基的物质的量占比(表2),结果表明LRMP是具有许多单糖分支点的多糖,残基的连接方式共有12 种。阿拉伯糖残基类型包括末端阿拉伯呋喃糖和(1→5)-阿拉伯呋喃糖;葡萄糖残基包括末端葡萄糖和(1→4)-葡萄糖;木糖残基类型包括末端木糖和(1→4)-木糖;半乳糖残基包括末端半乳糖、(1→3)-半乳糖、(1→4)-半乳糖、(1→6)-半乳糖和(1→3,6)-半乳糖。其中,最主要的糖苷键末端单元为阿拉伯呋喃糖-(1→,物质的量占比为19.82%;其他糖苷键末端单元为半乳糖-(1→、葡萄糖-(1→和木糖-(1→,物质的量占比分别为4.44%、3.51%和2.69%;最主要的糖苷键分支单元为在3号位取代的→3,6)-半乳糖-(1→和→3)-半乳糖-(1→糖苷键,物质的量占比分别为14.1%和7.51%;其余未取代的残基为→4)-葡萄糖-(1→、→4)-木糖-(1→、→5)-阿拉伯呋喃糖-(1→、→3)-半乳糖-(1→和→6)-半乳糖-(1→,物质的量占比分别为14.48%、11.41%、8.04%、7.51%和5.63%。这表明LRMP的主链可能由(1→3)-半乳糖或(1→6)-半乳糖构成,与Lv Xiaopeng等[9]分离纯化得到的LRP4-A结果大致相似。
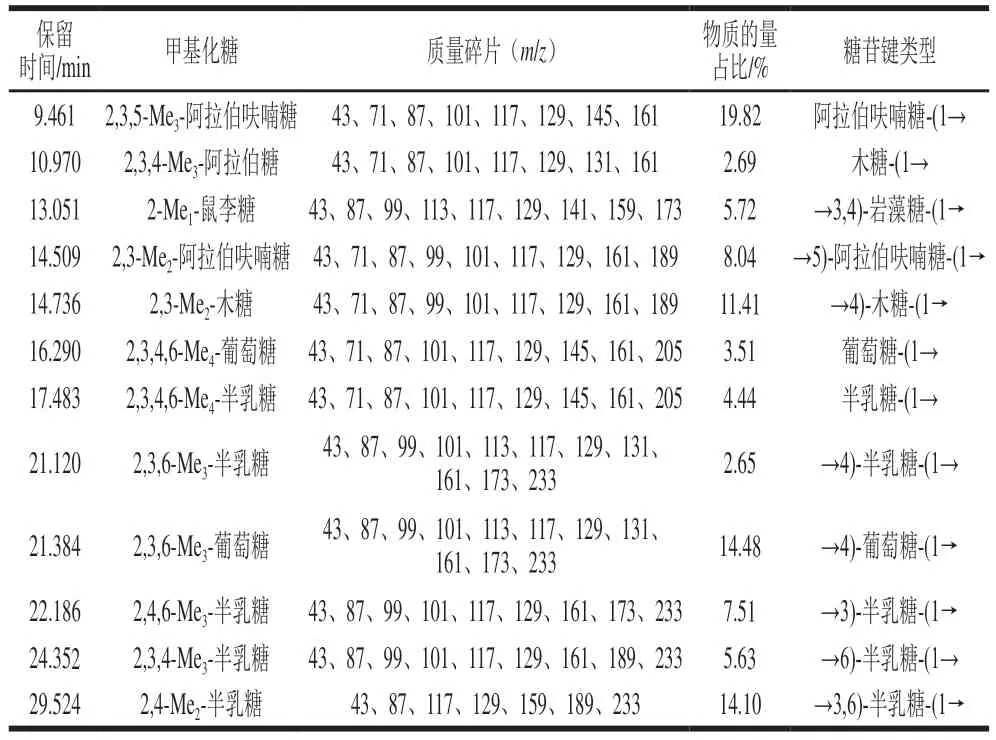
表2 LMRP的连接分析结果Table 2 Glycosidic linkage analysis of LMRP
2.2 LRMP分子质量及链构象分析
从图2A可知,LRMP的HPSEC图峰形单一且分布对称,多分散性指数(mw/mn)为1.30,接近1,说明LRMP的平均分子质量分布较均一。LRMP的mw为(1 589.0±21.9)kDa,Rg为(80.4±1.0)nm,[η]和Rh分别为(1 437.34±2.73)mL/g和(83.49±0.50)nm(表3)。
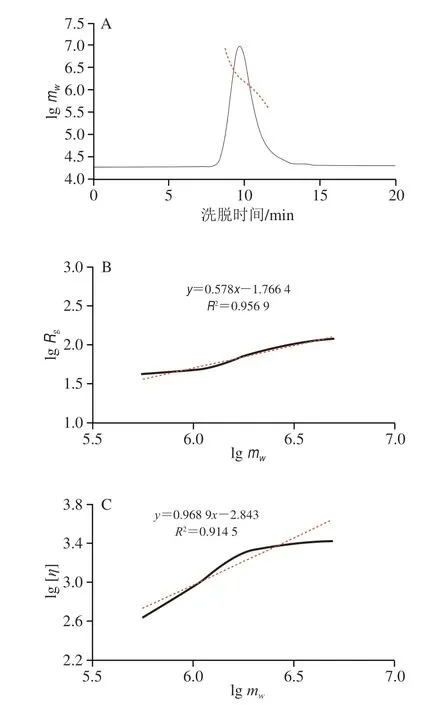
图2 LRMP分子质量及链构象Fig.2 Molecular mass and chain conformationanalysis of LRMP
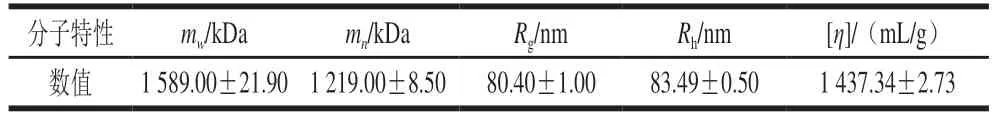
表3 LMRP的mw、分子大小、[η]参数Table 3 mw,molecular size and [η]parameters of LRMP
由图2B、C可知溶液中的链构象参数。构象参数αs为的指数值,αs=0.33时,高分子链在溶液中为球状链;当αs=0.5~0.6时,高分子链为柔性链;当αs=1时,高分子链在溶液中呈刚性链[20]。马克-霍温克方程的指数αη也可表征多糖构象,αη=0.22时,高分子链在溶液中为球状链;当αη=0.5~0.8时,高分子链为柔性链;当αη=1~2时,高分子链在溶液中呈刚性链[21]。高聚物的结构参数ρ(ρ=Rg/Rh)是高聚物在溶液中的特性参数,当ρ=0.78时,高分子链在溶液中为球状链;当ρ=1时,高分子链在溶液中呈半刚性链;当ρ=2时,高分子链在溶液中呈刚性链[22]。图2B的αs(0.578)和图2C的αη(0.968 9)表明LRMP在0.15 mol/L NaCl溶液(pH 7.4)中以柔性链或半刚性链形式存在,ρ为0.96表明LRMP呈线性无规卷曲,和αs、αη的结果相符。周声怡[23]的研究表明,碱提枸杞多糖在溶液中多呈现柔性链构象,而酸提或热水提枸杞多糖在溶液中会有刚性链构象,这可能是高温释放更多的阿拉伯糖与半乳糖,多糖链结构变短造成。
2.3 GES-1细胞模型
2.3.1 乙醇损伤GES-1模型条件
LRMP对GES-1细胞的毒性如图3A所示。当孵育12、24 h和48 h后,细胞活性均保持在100%左右,与猴头菇多糖[13]和铁皮石斛叶多糖[14]处理后的细胞活性相比,无明显细胞毒性。
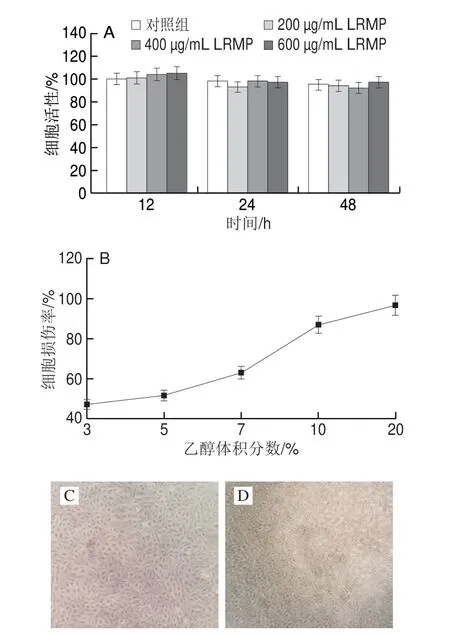
图3 乙醇损伤GES-1模型Fig.3 Evaluation of ethanol-induced damage in GES-1 cells
如图3B所示,GES-1的细胞损伤率随着乙醇体积分数的增加而增大,当乙醇体积分数为5%时,细胞损伤率为(50.00±5.32)%。在显微镜下观察GES-1的细胞形态,相比正常GES-1(图3C),乙醇损伤后GES-1变圆(图3D)。因此,采用体积分数5%乙醇溶液为后续实验构建损伤模型。
如图4A所示,经5%乙醇损伤的GES-1细胞活性显著下降,但当使用200、400、600 μg/mL LRMP进行预孵育后再建模,细胞活性分别为(63.4±3.2)%、(78.2±3.9)%和(86.4±4.3)%,相较模型组分别提高了13.4%、28.2%和36.4%,表明用LRMP预处理可以保护乙醇诱导的细胞损伤,显著提高细胞存活率。
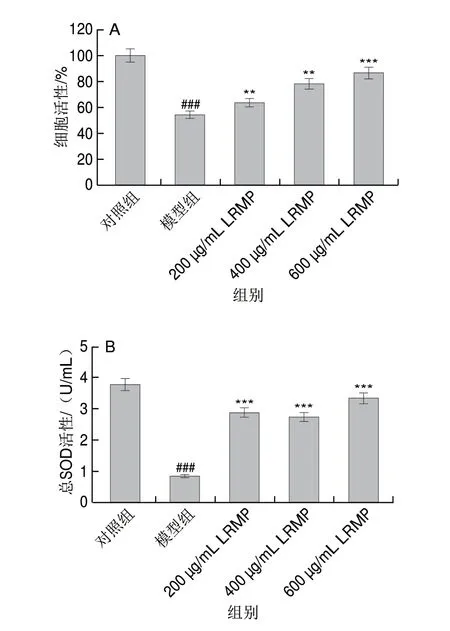
图4 LRMP样品对乙醇损伤GES-1细胞活性(A)和SOD活力(B)的影响Fig.4 Protective effect of LRMP on ethanol-induced injure in GES-1 cells (A) andits influence on SOD activity (B)
SOD具有抗氧化活性,能清除活性氧(reactive oxygen species,ROS)。如图4B所示,与模型组相比,提前孵育LRMP后再进行乙醇损伤,GES-1中总SOD活力显著提高,样品质量浓度为600 μg/mL时,SOD活力与对照组无显著差异。这表明LRMP处理后的细胞在乙醇损伤时,具有更强的抗氧化能力,低水平的ROS更有利于细胞增殖[24]。结果表明,LRMP可以抑制乙醇对细胞的氧化损伤,增强乙醇损伤后细胞清除自由基的能力,具有保护胃黏膜损伤的潜力。
2.3.2 AO/EB荧光染色结果
乙醇摄入可能影响细胞的许多功能[25],本研究中的细胞模型表明,乙醇可以破坏GES-1的细胞膜,导致细胞膜通透性异常,最终导致细胞凋亡。AO可以穿透活细胞完整的细胞膜并对细胞进行染色,产生绿色荧光;当细胞坏死时,AO和EB在细胞中结合,导致橙红色核染色质和椭圆形细胞,红色荧光比例的增加代表更多的细胞凋亡[26-27]。如图5A所示,与对照组相比,模型组的红色荧光数量增加,红绿荧光比显著提高到1.13±0.05,远高于对照组(0.66±0.03)(图5B),这表明更多的GES-1在乙醇损伤后出现非自然凋亡。在预先用LRMP样品孵育的GES-1实验组中,红绿荧光比分别为0.65±0.03、0.73±0.03、0.59±0.03,红色荧光的分布和强度显著降低,基本恢复至对照组水平。这表明LRMP样品对GES-1的乙醇损伤具有更好的保护作用。多糖样品对细胞损伤修复或预防的功效已有报道[28],本研究证实了LRMP能够恢复细胞的SOD活力,提高抗氧化能力,减轻氧化损伤导致的细胞凋亡,对乙醇诱导损伤的GES-1有保护作用。
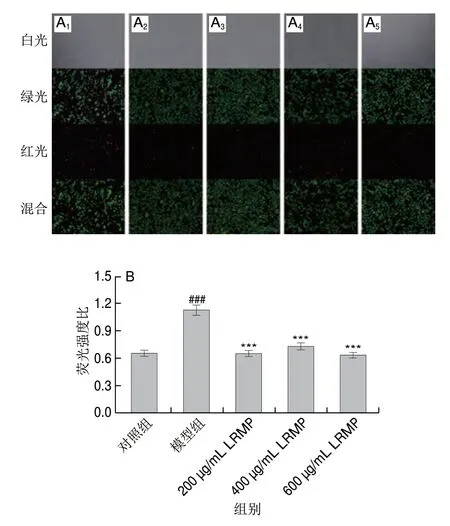
图5 LRMP对乙醇损伤GES-1细胞凋亡的影响Fig.5 Effect of LRMP on ethanol-induced apoptosis in GES-1 cells
3 结论
本研究采用热水提取法从黑枸杞果实中提取多糖,并对LRMP的单糖组成、糖苷键连接方式、链构象等信息进行测定。结果表明,LRMP由阿拉伯糖、木糖、半乳糖、葡萄糖、岩藻糖和半乳糖醛酸组成,结构末端主要由阿拉伯糖、木糖、葡萄糖和半乳糖残基组成,在溶液中呈典型的无规卷曲构象,Rg为(80.4±1.0)nm。在细胞实验中,LRMP(600 μg/mL)可以显著抑制乙醇对GES-1细胞造成的损伤,恢复细胞内SOD活性,通过抑制氧化损伤降低GES-1细胞凋亡率。综上,LRMP有提高免疫力、抗氧化、保护胃黏膜等生物活性,具有作为功能性多糖用于健康食品开发的潜力。
