基于静电相互作用的卵白蛋白与岩藻多糖相行为分析及流变学分析
2024-05-20袁一心嵇竞弘龚泠灵吴昕玲刘静波尚晓敏
张 婷,袁一心,嵇竞弘,龚泠灵,吴昕玲,刘静波,尚晓敏
(吉林大学食品科学与工程学院,吉林省营养与功能食品重点实验室,吉林 长春 130062)
蛋白质和多糖是食物中的两种重要生物大分子,二者的相互作用可以调控食物结构、稳定乳液、制备脂肪替代物和设计微胶囊等[1–4]。在水溶液中,蛋白质与多糖通过静电力驱动形成复合凝聚体[5-6]。静电相互作用强度主要取决于蛋白质和多糖的种类、电荷密度、分子质量,以及溶液体系pH值、温度、离子强度、蛋白质/多糖复配比和生物聚合物浓度等[7-8],通过调节这些因素可以有效获得多尺度的复合凝聚体。浊度滴定法常用于监测不同pH值条件下蛋白质/多糖复合凝聚相行为变化过程。随着pH值降低,复合体系会经历3 个临界pH值,对应4 种不同的相行为:当pH>pHc时,复合体系共溶;当pHc<pH<pHφ1时,可溶性复合凝聚体形成;当pHφ2<pH<pHφ1时,不溶性复合凝聚体发生宏观相分离;当pH<pHφ2时,复合凝聚体完全解离回到共溶状态[5,9]。虽然蛋白质和多糖之间的相互作用机制已被广泛研究,但对于特定来源的蛋白质和多糖,其复合凝聚相行为和凝聚体的结构变化仍有较大差异。
卵白蛋白(ovalbumin,OVA)是蛋清蛋白中含量最高的蛋白质(约占54%)[10],由385 个氨基酸组成(分子质量为45 kDa),是影响蛋清蛋白加工特性的主要物质。研究者们针对不同种类的OVA/多糖复合体系开展了系统研究,阐明了复合体系的相行为及物性变化[9,11-12]。Niu Fuge等[13]发现添加阿拉伯胶显著改善了OVA溶液的乳化稳定性,这是由于OVA与阿拉伯胶相互作用产生了高电荷的表面层,静电排斥减少了液滴之间的相互作用。Xiong Wenfei等[14]发现电荷密度较高的羧甲基纤维素可以增强复合体系的网络交联和黏弹性。综上所述,蛋白质和多糖之间的相互作用强度可以调控复合体系的结构,进而影响复合体系的透明度、稳定性和凝胶特性[15-16]。有研究发现,硫酸化多糖(如硫酸葡聚糖和κ-卡拉胶等)可以调控蛋清蛋白分子的电荷密度和构象,从而调节其加工特性[17-18]。但这些硫酸化多糖在食品加工的实际应用中存在一定的问题,如硫酸葡聚糖不能用于食品加工;κ-卡拉胶是一种凝胶化多糖,在食品热加工过程中会先于蛋白质形成凝胶阻碍食品结构调节。岩藻多糖(fucoidan,FUC)是一种天然的硫酸化多糖,具有无毒和高生物相容性的特点,其碳链结构主要由含有硫酸基团的岩藻糖残基组成[19]。FUC是一种高电荷的水溶性阴离子聚合物,在生物学和医学领域有着广泛的应用[20-21],如抗传染性非典型肺炎病毒、降血脂、抗动脉粥样硬化等[22-23]。因此,OVA/FUC不仅可作为安全、大容量的载体用于靶向给药,还可作为具有生物活性的营养物质使用,在制备蛋白质纳米颗粒方面表现出充足的潜力[24]。目前针对FUC的研究仍局限于分离纯化、结构鉴定、活性检测等方面,而关于FUC调控蛋白质物性变化的研究较少。
目前针对OVA/FUC的相行为变化及相互作用机制鲜有研究,严重限制了OVA/FUC复合体系在食品加工中的应用。因此,本研究采用浊度滴定法、Zeta电位测量等分析方法,测定OVA/FUC复合体系在不同蛋白质/多糖复配比和盐浓度下的相行为变化,明确二者复合凝聚的临界pH值;利用圆二色光谱(circular dichroism,CD)、荧光光谱和流变学等手段,解析FUC对蛋白构象和物性的影响,阐释OVA和FUC相互作用的机制。以期为理解硫酸化多糖与蛋白质相互作用机制奠定良好理论基础,并为开发基于硫酸化多糖/蛋白质复合凝聚体的功能性食品提供理论依据。
1 材料与方法
1.1 材料与试剂
OVA(纯度≥98%)美国Sigma-Aldrich公司;FUC(纯度85%)北京源叶生物科技有限公司。其他试剂均为分析纯。
1.2 仪器与设备
UV-2550紫外-可见分光光度计、F-7000荧光分光光度计 日本岛津公司;Discovery HR-1流变仪 美国TA仪器公司;MOS-450 CD仪 法国Bio-Logic公司;Starter2C pH计 奥豪斯仪器(上海)有限公司。
1.3 方法
1.3.1 OVA和FUC储备液的制备
准确称取适量OVA和FUC样品分别溶解于去离子水中,制备得到质量浓度为1 mg/mL的储备液,在室温条件下搅拌2 h后,置于4 ℃冰箱中过夜以保证样品充分水合。添加质量分数为0.02%的叠氮化钠溶液避免细菌生长。
1.3.2 OVA/FUC复合物的制备
将OVA与FUC的储备液按不同质量比(1∶1、5∶1、10∶1、20∶1和50∶1)进行混合得到OVA/FUC复合溶液,同时保证复合溶液中生物聚合物的总质量分数为1%,此时溶液中的pH值为6.0。为了研究离子强度对OVA/FUC复合物形成的影响,向OVA/FUC复合溶液(20∶1)中添加不同质量的NaCl得到不同盐离子浓度(c(NaCl)=0、50、100、200、400 mmol/L)的OVA/FUC复合溶液。
1.3.3 浊度测定
利用浊度滴定法观察样品溶液复合凝聚过程中的浊度与pH值的关系。参照Yang Lan等[25]的方法,利用紫外-可见分光光度计在600 nm波长处对OVA/FUC复合溶液的浊度进行表征,比色皿的夹缝宽度为1 cm。用HCl溶液(0.1、0.5、1.0 mol/L)将OVA/FUC复合物的pH值从6.0调整到2.0,溶液的pH值每变化0.25时,取样进行浊度测定,并记录其对应pH值。
1.3.4 Zeta电位测定
参考Liu Jingbo等[9]的方法,将OVA储备液、FUC储备液、不同质量比(1∶1、5∶1、10∶1、20∶1和50∶1)的OVA/FUC复合溶液和不同盐离子浓度(c(NaCl)=0、50、100、200、400 mmol/L)的OVA/FUC复合溶液稀释10 倍后,利用激光纳米粒度仪测定酸化过程中复合凝聚物表面的Zeta电位,平衡时间为120 s。
1.3.5 内源荧光光谱测定
参照Antonov等[26]的方法,将不同pH值(4.5和6.0)样品中的蛋白质量浓度稀释至0.5 mg/mL,在室温条件下测定复合溶液荧光光谱。发射光谱范围为300~450 nm,激发波长为270 nm,激发和发射的狭缝宽度均为3 nm,狭缝宽度为5 nm,激发电压为400 V。
1.3.6 CD测定
根据Greenfield[27]的方法。将不同pH值(4.5和6.0)样品中的蛋白质量浓度稀释到0.5 mg/mL,在室温条件下用CD仪测定样品溶液在200~250 nm范围的CD。用不含蛋白质溶液的光谱进行校正。使用BESTSEL软件(https://bestsel.elte.hu/index.php)分析光谱并对样品二级结构含量进行计算。
1.3.7 流变特性测定
参照Wang Chenying等[28]的方法,使用配备直径40 mm夹具的流变仪进行流变测试。将大约1.5 mL样品置于旋转流变仪样品盘上,夹具与样品盘之间的间隙为1 mm,25 ℃稳定30 min,以1%的应变从0.1 rad/s到100 rad/s进行频率扫描得到样品的储能模量(G’)。
1.4 数据处理和分析
2 结果与分析
2.1 OVA/FUC复合凝聚相行为分析
2.1.1 pH值对OVA/FUC复合凝聚的影响
多糖和蛋白质之间产生复合凝聚现象是由于带相反电荷的生物聚合物之间的静电引力驱动[29]。复合体系的pH值是决定生物聚合物表面电荷密度的关键。如图1所示,在酸性滴定过程中,OVA/FUC复合物的浊度明显高于OVA或FUC单一溶液,这主要归因于静电引力作用促进了蛋白质和多糖之间形成复合凝聚体。在酸滴定过程中单一的FUC溶液相对澄清,其浊度低且相对恒定,这归因于FUC分子表面的硫酸基团产生了抑制多糖分子间聚集的强静电斥力[30]。OVA的浊度取决于pH值,在OVA的等电点(pH 4.72)附近达到最大。对于OVA/FUC复合物,有4 个关键的pH值临界点(pHc、pHφ1、pHmax和pHφ2),pHc为浊度曲线斜率初次变化时的pH值,pHφ1是浊度曲线斜率突然增大时的pH值,pHmax是浊度达到峰值时的pH值,而pHφ2值是浊度曲线下降至稳定时的pH值[5]。当pH>pHc时,OVA与FUC在溶液中都带负电,由于复合物之间的静电排斥作用,OVA和FUC之间无法形成复合物(共溶区)。当pHφ1<pH<pHc时,复合溶液浊度开始增加,表明溶液中OVA和FUC形成了具有一定散射光线能力的可溶性复合物[31]。当pH值高于蛋白质等电点时,依然可以通过静电相互作用形成可溶性复合物,这主要是蛋白质表面少量带正电的氨基酸与聚阴离子多糖带负电的硫酸基团相互作用的结果,也称之为“正电补丁”效应[9]。随着进一步滴定,浊度急剧上升,当pH<pHφ1时,出现明显的相分离,形成不溶性复合凝聚体。OVA和FUC之间的静电相互作用在pHmax时达到最强,导致不溶性OVA/FUC复合凝聚体的积累量达到最大。而后,随着pH值的不断降低,由于多糖的质子化,OVA/FUC复合凝聚物开始出现解离,乳浊液逐渐变澄清。但并未观察到OVA/FUC复合凝聚物完全解离(即未出现pHφ2)[32]。主要原因在于含有硫酸基团的FUC酸解离常数(pKa)较低,在强酸条件下仍然未被全部质子化,因此即便在较低pH值时,OVA与FUC仍然存在强静电吸引力,较难解离。OVA/硫酸葡聚糖互作体系及OVA/果胶体系在酸化过程中均存在类似现象[9,33]。
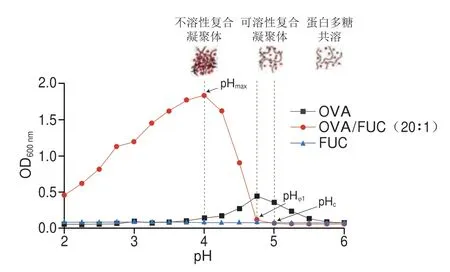
图1 OVA、FUC和OVA-FUC复合溶液浊度随pH值的变化Fig.1 pH-Dependent changes in turbidity of OVA,FUC and OVA-FUC mixed solutions
2.1.2 蛋白质/多糖复配比对复合凝聚相行为的影响
蛋白质/多糖复配比是影响复合物形成的关键因素之一,对复合体系的临界pH值影响显著[34]。本研究进一步探讨了无盐添加条件下OVA/FUC复配比对复合凝聚体形成的影响。如图2所示,随着OVA/FUC质量比的增加(从1∶1增加至50∶1),OVA/FUC复合体系的浊度曲线逐渐趋于正态分布(图2a),临界pH值向更高pH值迁移(图2b)。当蛋白质/多糖质量比为1∶1时,复合溶液浊度较低,表明FUC处于过量状态,体系内蛋白分子可完全结合到糖链上,此时体系静电斥力较强,进一步抑制了蛋白质-蛋白质分子相互作用。当蛋白质/多糖质量比从5∶1增加到50∶1时,复合溶液的浊度曲线逐渐呈现先上升后下降的趋势,表明在较高蛋白质浓度条件下促进了复合凝聚体的形成,此时FUC糖链可结合多个OVA分子。图2c为不同蛋白质/多糖复配比复合凝聚物的外观,质量比为50∶1与20∶1的样品随着pH值降低出现了明显的宏观相分离,而在5∶1的体系中未观测到类似现象。相分离由热力学不相容而产生的排除体积效应影响,而非絮凝作用[35]。综上所述,当OVA/FUC质量比为20∶1时,OVA和FUC的结合达到饱和,二者在复合凝聚过程中形成最稳定的复合凝聚体。
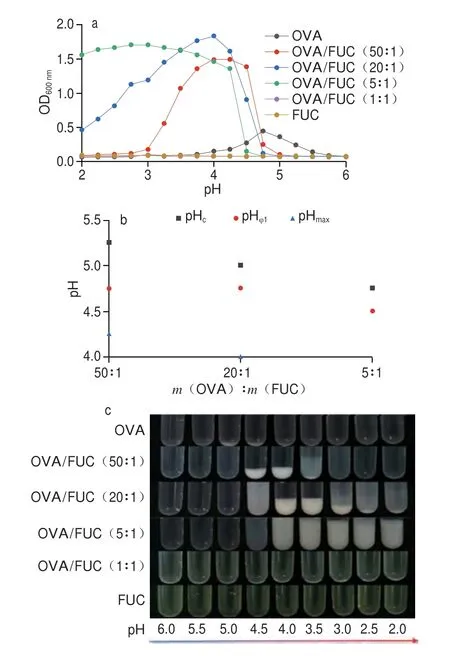
图2 不同生物聚合物质量比OVA-FUC复合溶液的浊度(a)、临界pH值(b)和外观(c)随pH值的变化Fig.2 pH-Dependent changes in turbidity (a),critical pH (b) and appearance (c) of OVA-FUC mixed solutions with different mass ratios
2.1.3 离子强度对OVA/FUC复合凝聚的影响
盐离子可通过静电屏蔽作用调控生物聚合物之间的相互作用。本实验以OVA/FUC质量比20∶1为条件制备复合溶液,分析NaCl浓度对OVA与FUC复合凝聚过程的影响。如图3a所示,随着NaCl浓度的增加,复合体系的浊度曲线在pH<pHmax后逐渐趋于平缓。特别是当盐浓度大于50 mmol/L时,复合溶液的浊度曲线有一个较宽的平台期。当盐浓度大于200 mmol/L时,浊度由于强静电屏蔽效应而显著提升,溶液的表观形貌进一步证明了该变化趋势(图3a、c)。如图3b所示,随着盐浓度的增加,pHc与pHφ1均呈现先上升后下降的趋势,而pHmax在盐浓度提升至100 mmol/L时消失。这一现象可解释为在低盐浓度(0~100 mmol/L)条件下,盐离子可在一定程度上提高生物聚合物的溶解度,促进形成生物聚合物之间的静电引力,诱导凝聚体形成。在高盐浓度下,NaCl的竞争性吸附抑制了OVA和FUC之间的静电引力,导致临界pH值的降低。Liu Jingbo等[9]对OVA/硫酸葡聚糖的相行为研究中同样观测到类似变化趋势。
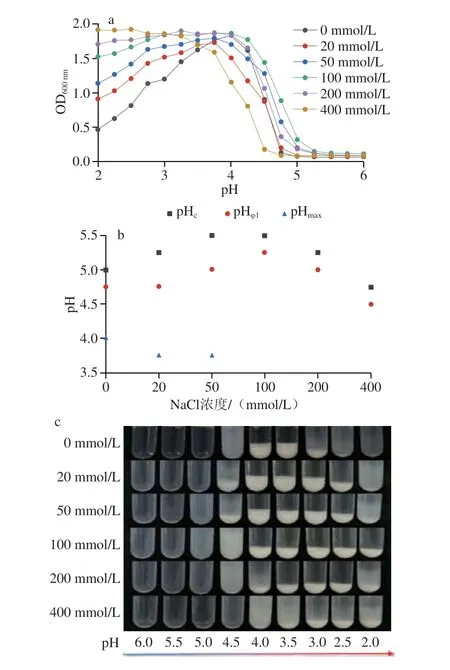
图3 不同NaCl浓度OVA-FUC复合溶液的浊度(a)、临界pH值(b)和外观(c)随pH值的变化Fig.3 pH-Dependent changes in turbidity (a),critical pH (b) and appearance (c) of OVA-FUC mixed solutions with different NaCl concentrations
2.2 OVA/FUC复合凝聚物的Zeta电位分析
静电引力是水溶液中复合凝聚体形成的主要驱动力[36]。此外,蛋白质和多糖的表面电荷种类与大小受溶液中环境条件的影响。通过测定OVA、FUC和OVA/FUC复合物的Zeta电位解析OVA/FUC复合物在复合凝聚过程中的静电复合机理。如图4a所示,在酸滴定过程中所有样品的Zeta电位均逐渐增加。本研究中测得OVA的等电点为4.58,与之前的研究结果接近(等电点为4.5)[37]。当溶液的pH值大于OVA的等电点时,OVA分子带负电,溶液pH值小于OVA等电点时则带正电。FUC的pKa值极低,因此FUC溶液在整个酸性滴定过程中带较高的负电荷[24]。当溶液pH值小于OVA等电点时,二者带相反电荷,可在静电引力的驱动下形成复合凝聚体。当pH值从6.0降至5.0时,所有样品的Zeta电位均未发生明显变化,且带有一定量的负电荷(Zeta电位<-20 mV),结合浊度滴定结果可知,可溶性复合物形成时(pH=pHφ1)体系的净电荷相对较高。此外,当溶液pH<5.0时,OVA/FUC复合物(质量比为20∶1和50∶1)的表面电位迅速增加,在酸滴定过程中经历了从带负电到带正电的过程。同时,OVA/FUC复合物(质量比为20∶1和50∶1)的等电点与pHmax几乎相同(图2a),表明当OVA/FUC复合物的净电荷接近0时,凝聚体的堆积量达到最大。另外,当质量比<20∶1时,过量的FUC导致复合物的Zeta电位增加幅度变小,在整个pH值范围内带净负电荷。这与2.1.2节的结果相吻合,在比例小于20∶1时没有检测到浊度的最大值。
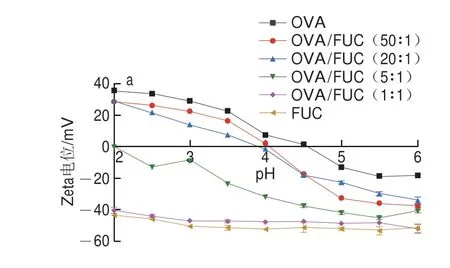
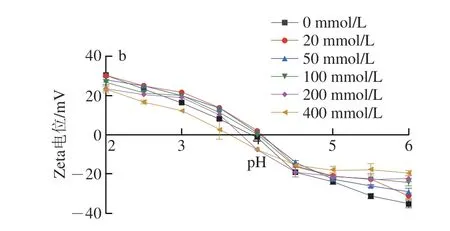
图4 不同质量比(a)和不同NaCl浓度(b)OVA/FUC复合物的Zeta电位变化Fig.4 Changes in zeta potential of OVA/FUC mixtures with different ratios (a) and different NaCl concentrations (b)
不同盐浓度的OVA/FUC溶液(质量比为20∶1)中Zeta电位与pH值的关系如图4b所示。在不含NaCl的溶液中,OVA/FUC的等电点为4.07。盐离子的添加使复合物的等电点发生了轻微的左移,并且复合物的等电点随着溶液中NaCl的浓度升高而降低,这是由于NaCl的静电屏蔽作用[38]。在较高的离子强度下(c(NaCl)≥100 mmol/L),过量的离子屏蔽了聚合物的带电活性位点,OVA和FUC之间的静电引力减少,这导致过多的硫酸基团无法与阳离子氨基基团结合。因此高NaCl浓度(c(NaCl)≥100 mmol/L)的复合溶液浊度在pH值小于OVA等电点时较高,且在低pH值时出现平台期。此外,在整个pH值范围内,OVA/FUC复合物Zeta电位绝对值与溶液中盐浓度的变化趋势相反。Zeta电位绝对的大小与系统的稳定性有关[39],因此高盐浓度会导致体系的稳定性降低。Ding Lan等[40]也发现了类似的结果,NaCl的加入导致壳聚糖/酪蛋白混合物Zeta电位的降低,促进了复合物聚集的形成,降低了复合物的稳定性。综上,静电相互作用为OVA/FUC凝聚体形成的主导力,且当复合物的浊度达到峰值(pHmax)时,OVA与FUC带有相反电荷。
2.3 OVA/FUC复合体内蛋白质构象解析
2.3.1 内源荧光光谱分析
在蛋白质/多糖复合体系中,蛋白质的分子结构变化与二者的复合凝聚过程密切相关。本研究进一步分析OVA与FUC在共溶区间(pH 6.0)和静电复合凝聚区间(pH 4.5)条件下的荧光光谱。由图5a可知,pH 6.0条件下复合物的荧光强度峰值改变,表明OVA分子的内部构象发生了变化。与单一OVA溶液相比,少量FUC加入(质量比为10∶1、20∶1、50∶1)使OVA荧光光谱出现一定程度的猝灭。然而,当复合体系中的FUC过量时(质量比为5∶1、1∶1),OVA的荧光强度峰值显著提高,这表明蛋白质内部荧光基团周围微环境的极性增加和疏水性降低[41]。在pH 4.5时,OVA及OVA/FUC复合物的荧光强度显著提升(图5b),这与酸性条件下蛋白质分子展开导致荧光基团暴露有关[42]。值得注意的是,当OVA/FUC的质量比为5∶1和1∶1时,OVA荧光强度的最大值提升了5 倍。由相行为和Zeta电位结果可知,pH 4.5条件下质量比为5∶1和1∶1的OVA/FUC复合物处于可溶性复合凝聚体区,此时复合体系中过量的聚阴离子抑制了OVA的聚集,使OVA分子在酸性条件下充分展开,荧光基团大量暴露[43],从而导致荧光强度显著提高。此外,在共溶区间内FUC所有比例的复合均使OVA荧光峰值发生了明显的红移,这是由于OVA/FUC复合物的形成可能改变了OVA内部色氨酸残基所处的极性疏水微环境[44],说明疏水相互作用也参与了OVA/FUC复合物的形成。
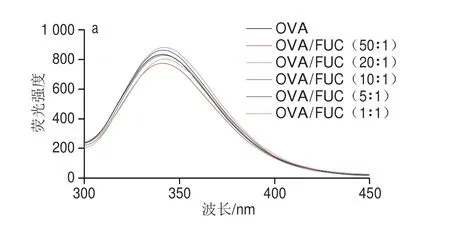
图5 不同生物聚合物比例下OVA/FUC复合物在pH 6.0(a)与pH 4.5(b)条件下的荧光光谱Fig.5 Fluorescence spectra of OVA/FUC mixtures with different ratios at pH 6.0 (a) and pH 4.5 (b)
2.3.2 CD分析
为进一步分析OVA与FUC复合凝聚过程中二者之间相互作用的分子机制,测定在pH 6.0与pH 4.5条件下不同比例OVA/FUC复合物的蛋白质二级结构变化,结果如图6所示。蛋白质中α-螺旋的特征峰位于约208 nm和222 nm波长处,β-折叠和β-转角的特征峰位于约216 nm和206 nm波长处[27]。如图6a、b所示,单一OVA的光谱峰值位于约222 nm,FUC的加入使所有样品的光谱峰发生了不同程度的蓝移,表明OVA/FUC复合物中蛋白质分子的二级结构发生了变化。在pH 6.0的复合溶液中,少量FUC的加入降低了OVA光谱峰的强度(质量比≥10∶1)。相反,过量的FUC会导致OVA光谱的峰值增大(质量比<10∶1)。而当复合溶液的pH值为4.5时,任何添加量的FUC均会使OVA光谱峰的强度降低,此时OVA的二级结构发生显著变化。由此可见,FUC的复合凝聚改变了OVA的二级结构构象(α-螺旋与β-折叠)[45]。
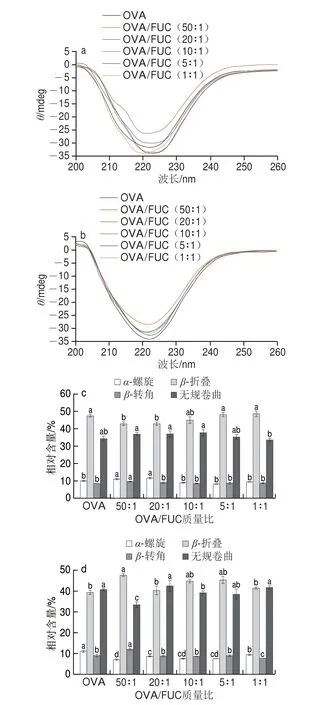
图6 OVA和OVA/FUC复合溶液在pH 6.0(a、c)和pH 4.5(b、d)时的CD及其二级结构的相对含量Fig.6 Circular dichrogram spectra and relative contents ofsecondary structure of OVA and OVA/FUC mixtures at pH 6.0 (a and c) and pH 4.5 (b and d)
为了进一步量化FUC复合对OVA二级结构的影响,使用BESTSEL软件分析了蛋白质二级结构的含量,结果如图6c、d所示。当pH 6.0时,FUC的添加对OVA的二级结构的影响不显著。当pH 4.5时,FUC的存在使OVA的α-螺旋含量下降而β-折叠含量上升,这表明添加FUC后OVA分子发生了一定程度的解螺旋。此外,FUC对OVA的解螺旋效应在50∶1时达到最大值,而在1∶1时达到最小值,该变化归因于溶液中过量的阴离子对OVA二级结构变化的抑制作用。Zhang Ting等[43]在蛋清蛋白与硫酸葡聚糖的相互作用研究中也发现了类似现象。Tang Honggang等[46]同样发现带有硫酸基团卡拉胶的复合作用促进了蛋清蛋白分子α-螺旋向β-折叠的转变。然而大量研究表明,除硫酸化多糖外的其他阴离子多糖(如羧甲基纤维素)与蛋白质的静电复合对蛋白质的二级结构无显著影响,这一现象可能与多糖中的硫酸基团有关。
2.4 OVA/FUC复合凝聚体流变学特性分析
为更深入地了解OVA/FUC凝聚体的宏观特性,利用频率扫描进一步探究了在pH 4.5条件下NaCl浓度和OVA/FUC质量比对凝聚体黏弹性的影响。储能模量(G’)反映复合体系的黏弹性,是溶液中大分子相互交联形成大尺寸聚集体的结果[47]。如图7a所示,复合溶液的G’随着FUC的添加呈现先上升后下降的趋势,且在OVA/FUC质量比为20∶1时达到最大值,表明在该条件下复合溶液中蛋白质分子间的交联程度达到最大,聚集体的尺寸达到最大。相反,当质量比为5∶1或1∶1时,OVA/FUC复合物的G’远低于OVA,这一结果与相行为结果基本相符,此条件下的OVA/FUC复合物处于可溶性复合凝聚阶段和共溶阶段,体系中大量的聚阴离子阻碍了蛋白质分子的进一步聚集。Niu Fuge等[48]研究表明,由于空间位阻效应,高度支化的多糖在混合体系中比线性大分子难以形成交联结构。因此,过多的FUC削弱了复合体的复合凝聚过程中的聚集行为。不同盐浓度下的流变结果表明,随着盐浓度的增加,样品的G’呈现先减小后增加的趋势(图7b)。这可能是由于在pH 4.5溶液体系中少量盐的加入会抑制OVA与FUC之间的相互作用,削弱复合物的相互交联。在50 mmol/L的NaCl浓度下,体系的G’最低。然而,当NaCl浓度达到400 mmol/L时,OVA/FUC凝聚体的G’达到最大值。这可能是由于高盐促进了OVA分子的变性,从而促进了OVA分子间的聚集。这些结果与浊度和Zeta电位随离子强度的变化基本一致。综上所述,体系中过量蛋白质或多糖的存在影响凝聚体的G’,这归因于体系的排斥力和空间位阻效应。当蛋白质/多糖结合接近饱和时,复合体系作为一个电中性的整体,分子间排斥力最小,导致OVA/FUC质量比为20∶1的复合物表现出最高的G’。
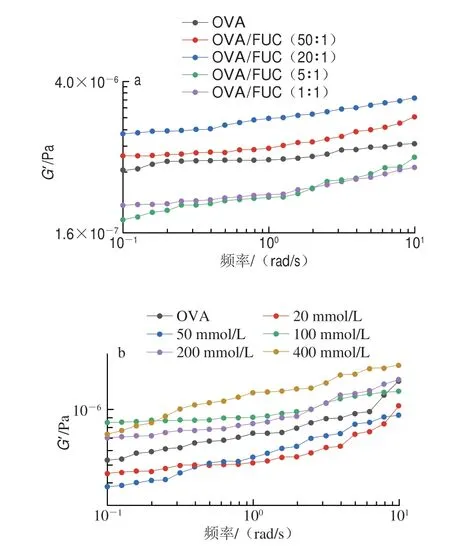
图7 pH 4.5条件下不同质量比(a)和NaCl浓度(b)的OVA/FUC复合溶液的G’Fig.7 G’ of OVA/FUC mixtures with different mass ratios (a) and NaCl concentrations (b) at pH 4.5
3 结论
本实验探究了pH值、离子强度和生物聚合物质量比对OVA和FUC复凝聚相行为的影响。随着OVA/FUC复配比的增加,可以与FUC结合的OVA分子数量增加,复合物的临界pH值(pHc和pHφ1)向高pH值方向移动。当OVA/FUC的质量比从1∶1增加到5∶1时,由于OVA和FUC之间强烈的静电相互作用,没有出现明显的pHmax。形成复合物的最佳OVA/FUC质量比是20∶1,它表现出最高的浊度,且具有较高的储能模量。OVA和FUC之间的静电相互作用具有显著的盐离子依赖性。当盐的浓度小于100 mmol/L时,复合物的临界pH值向更高的pH值方向移动,表明低盐离子浓度可促进复合凝聚体的形成。然而当盐浓度大于100 mmol/L时,静电屏蔽效应会改变OVA与FUC之间的静电复合状态,临界pH值显著下降。同时,FUC的加入改变了OVA蛋白质的分子构象,促进了OVA的解螺旋和三级结构的展开。综上所述,通过改变OVA和FUC溶液的复合条件可以调控二者的复合凝聚特性,本研究可为设计基于OVA/FUC复合物的新型水凝胶和功能性纳米载体奠定理论基础。
