三种猪日本脑炎疫苗免疫效果比较
2024-05-20丁林玲刘璐陈云蕾张泽林汤冠涛程国华袁伟琴吴昊
丁林玲 刘璐 陈云蕾 张泽林 汤冠涛 程国华 袁伟琴 吴昊

基金项目:杭州市农业与社会发展科研引导项目(20220919Y203)
作者简介:丁林玲(1984-),女,兽医师,主要从事动物防疫工作
*通信作者:陈云蕾(1991-),男,兽医师,主要从事兽医技术服务和兽医实验室检测工作;E-mail:506658911@qq.com
摘 要:为筛选出免疫效果较好的猪日本脑炎疫苗,本研究从某猪场选出15头45日龄左右的仔猪,随机分成3组(A组、B组和C组),分别接种3种不同厂家的猪日本脑炎疫苗。采集疫苗免疫前、首次免疫后21 d和二次免疫后21 d三个时间点猪血液样本,通过荧光定量PCR和ELISA方法对免疫前病毒感染情况和免疫后抗体水平进行对比和分析。结果显示,试验仔猪未出现猪日本脑炎病毒感染;A组所用疫苗较B组、C组所用疫苗,抗体水平最高,首次免疫、二次免疫均表现出极显著差异(P<0.01),表明A组所用疫苗的免疫效果最好,可用于易感动物猪的免疫,以减少病毒由蚊虫向马匹感染的风险。
关键词:猪日本脑炎;疫苗;免疫;抗体水平
中图分类号:S851.3 文献标志码:A 文章编号:1001-0769(2024)02-0022-04
日本脑炎 (Japanese encephalitis,JE)是由黄病毒科黄病毒属日本脑炎病毒(Japanese encephalitis virus,JEV)引起的一种人畜共患病,主要导致人和马出现脑炎症状,但人和马感染后通常表现为隐性感染。JE同样可引起母猪繁殖障碍,导致母猪流产、产死胎和木乃伊胎,但怀孕母猪通常没有临床症状,且不影响后期怀孕[1]。相关研究发现JEV主要存在于蚊子、野鸟和猪中[2]。猪是JEV重要的扩增宿主,鸟类也可增殖和传播病毒,在猪中存在无病媒传播的可能[3]。JE严重影响我国养猪业和马匹竞技性能的健康发展。
2023年第19届亚运会马术项目在杭州桐庐成功举办,为保障参赛人员与马匹健康安全,将JE列为19种马属动物疫病中两种强制免疫的疫病之一。猪作为JEV重要的扩增宿主,增加了蚊虫向马匹传播的风险。因此,为充分保障参赛人员与马匹的健康安全,保证规定区域内易感动物的JE“零发生”,选择适合的疫苗对易感动物——猪进行强制免疫显得尤为重要。本试验选取桐庐县某猪场15头45日龄左右仔猪,随机分成3组(A组、B组和C组),分别接种3种不同厂家的猪日本脑炎疫苗,通过临床观察、荧光定量RT-PCR、ELISA等方法比较试验猪群的免疫效果,选出免疫效果最好的猪日本脑炎疫苗为猪免疫,以减少病毒由蚊虫向马匹感染的风险。
1 材料与方法
1.1 试验动物和疫苗
15头未接种过猪JE疫苗的健康断奶仔猪;试验疫苗为国内3家生物制品厂生产的疫苗:A疫苗(生产批号为202302005)、B疫苗(生产批号为202304010)和C疫苗(生产批号为20230208)。
1.2 主要试剂与仪器设备
日本脑炎病毒荧光RT-PCR检测试剂盒(生产批号为2023005)由哈尔滨国生生物科技股份有限公司生产;日本脑炎抗体检测试剂盒(生产批号为20230704)由武汉科前生物技术有限公司生产;荧光定量PCR仪(ABI 7500)由美国赛默飞世尔科技公司生产;核酸提取仪购买于济凡生物科技有限公司;酶标仪由美国赛默飞世尔科技公司生产;移液器由上海普兰德贸易有限公司生产。
1.3 试验方法
1.3.1 免疫程序
15头断奶仔猪随机分成A组、B组和C组,分别注射3家不同生物制品厂生产的疫苗。按厂家推荐,试验仔猪在45日龄进行首次免疫, 90日龄进行二次免疫,剂量为每头猪1头份。
1.3.2 采样及样本检测方法
试验仔猪在疫苗免疫前、首次免疫后21 d和二次免疫后21 d分别进行前腔静脉采血,每份采样量不少于3 mL。对免疫前采集的抗凝血提取核酸,进行JEV核酸检测;对3个时间点(免疫前、首次免疫后21 d和二次免疫后21 d)采集的样本进行抗体检测。具体操作步骤参照试剂盒说明书,检测结果按照核酸CT值和抗体阳性率等进行统计分析。
1.3.3 判断标准
核酸检测判断标准:①FAM通道Ct值≤35且扩增曲线为典型的S型,同时HEX通道或VIC通道Ct值≤35,则判定样本为JEV阳性;②FAM通道无Ct值显示或Ct值>40,同时HEX通道或VIC通道Ct值≤35(低于试剂盒检测下限),则判定样本为JEV阴性;③FAM通道无Ct值显示或Ct值>40,同时HEX通道或VIC通道內标Ct值>40或无Ct值显示,则检测样本结果无效。
抗体检测判断标准:①对照成立条件为阳性对照平均OD630 nm值≥0.5,阴性对照平均OD630 nm值<0.3;②计算公式中S/P值=样本OD630 nm值/阳性对照平均OD630 nm值,若样本S/P值≥0.21,则判定JEV抗体为阳性,若样本S/P值<0.21,判定JEV抗体为阴性。
1.4 数据分析
应用EXCEL和GraphPad Prism Vol.8.0软件对检测结果进行统计和分析。“**”表示存在统计学意义上的极显著差异(P<0.01)。
2 结果与分析
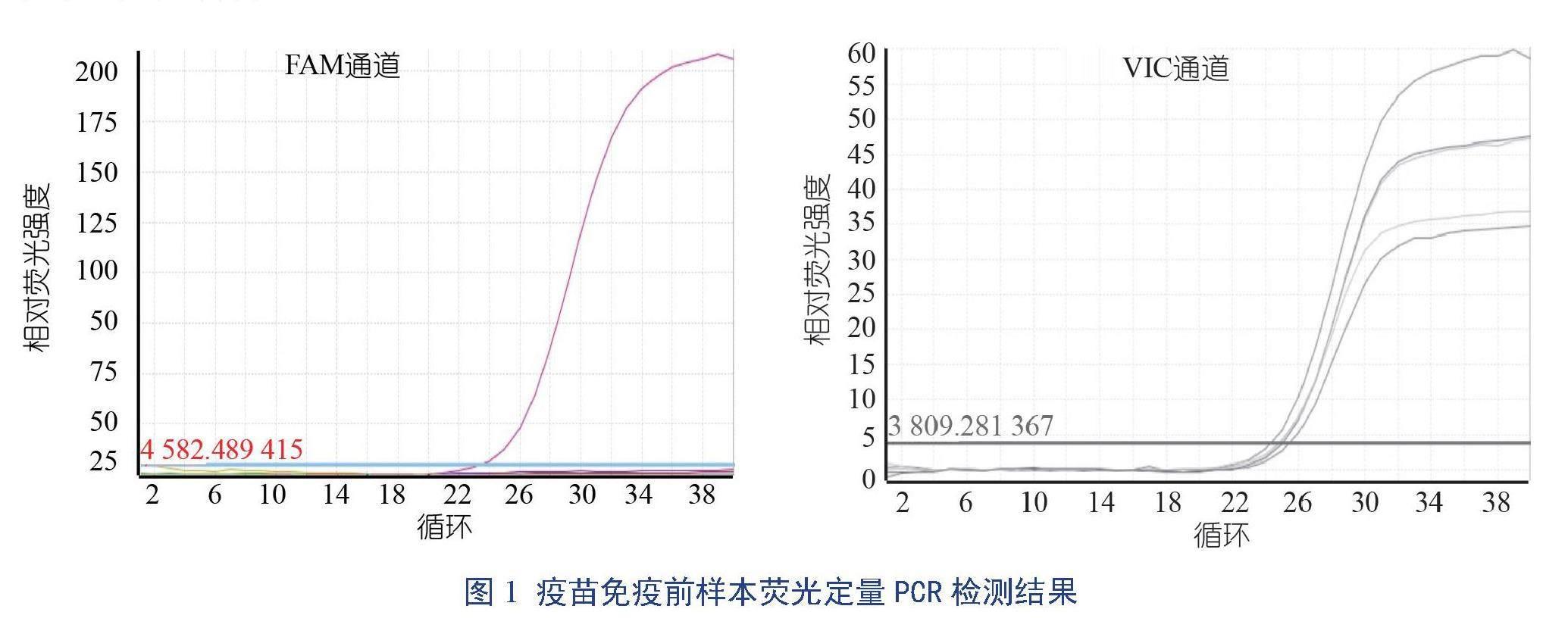
2.1 疫苗免疫前日本脑炎病毒核酸检测
使用荧光定量RT-PCR方法对采集的抗凝血进行核酸检测(图1)。从图1可知,该猪群样本检测中FAM通道阳性对照Ct值为23.56(阳性对照Ct值≤35),其余均无Ct值;样本VIC通道:阳性对照Ct值为24.38,阴性对照Ct值为25.05,其余样本Ct值分别为25.51、24.89和24.91,Ct值均≤35,检测结果判定JEV核酸阴性,表明该猪群在免疫前未感染日本脑炎病毒。
2.2 疫苗免疫后抗体水平检测
将疫苗免疫前、首次免疫后21 d和二次免疫后21 d采集的试验仔猪全血离心,收集血清进行抗体水平检测(图2)。由图2可知,免疫前A组、B组、C组试验仔猪的抗体水平无明显差异;首次免疫后21 d检测抗体水平发现,A组试验仔猪(接种A疫苗)免疫效果明显高于B组的(接种B疫苗)和C组的(接种C疫苗),且差异极显著(P<0.01);二次免疫后21 d检测抗体水平发现,免疫A疫苗(A组)的试验仔猪的抗体水平明显高于免疫B疫苗(B组)的和C疫苗(C组)的,且差异极显著(P<0.01)。
3 討论与分析
选择优质的疫苗和合理的免疫程序对于猪场疫病的预防至关重要[4]。一般情况下,厂家推荐仔猪日本脑炎疫苗的免疫程序为45日龄左右进行首次免疫,90日龄左右加强免疫一次。为验证疫苗免疫效果,在仔猪母源抗体最低或无母源抗体(45日龄左右)时,进行病毒核酸检测,可避免外源病毒对疫苗免疫效果的影响。
本试验接种疫苗前核酸检测结果:FAM通道阳性对照CT值小于35,且扩增曲线为典型的S型,而样本和阴性对照均无CT值,同时VIC通道CT值均小于35,表明该猪群在接种前均未感染日本脑炎病毒。随后对不同时间点(免疫前、首次免疫后21 d和二次免疫后21 d)的血清样本进行抗体水平检测时发现,在免疫前,三组试验的抗体水平(A组、B组和C组)未有明显差异,但在首次免疫后21 d和二次免疫后21 d两个时间点,三组试验仔猪的免疫效果出现极显著差异,A组试验仔猪与B组和C组试验仔猪之间差异极显著(P<0.01),说明A组所注射疫苗的免疫效果明显高于其他两种疫苗的。但A组试验仔猪在二次免疫后21 d的抗体水平比首次免疫后21 d出现了下降,有可能是首次免疫和二次免疫之间接种过其他疫苗或猪抵抗力下降等原因引起的,具体原因有待进一步深入探究。在三种疫苗免疫效果比较过程中发现,B组和C组所用的疫苗虽在首次免疫后、二次免疫后均出现抗体水平的升高,但与A组所用的疫苗相比,B组和C组所用的疫苗免疫效果明显不足,表明A组所用的疫苗免疫效果较好。
综上所述,A组所用的疫苗是三种疫苗中免疫效果最好的疫苗,但在实际生产中,疫苗的选择和合理的免疫程序并不是一成不变的,而是需要根据自身的实际情况进行合理的调整。要坚持监测常态化,更好地了解猪群的JEV抗体水平,做到及时补免[5],才能充分做到猪日本脑炎真正的“零发生”,从而降低病毒由蚊虫向马匹感染的风险。
参考文献
[1] ZIMMERMAN J,KARRIKER L A,RAMIREZ A,et al.Diseases of swine(10th Edition)[M].Wiley-Blackwell Publishing. 2012.
[2] OLIVEIRA ARS,STRATHE E,ETCHEVERRY L,et al.Assessment of data on vector and host competence for Japanese encephalitis virus: a systematic review of the literature[J].Preventive Veterinary Medicine,2018,154:1-89.
[3] RICKLIN ME,GARC?A-NICOL?S O,BRECHB?HL D,et al. Vector-free transmission and persistence of Japanese encephalitis virus in pigs[J].Nature Communications,2016,7:10832.
[4] 张宁,佘桐,李旭,等.两种不同猪瘟疫苗对育肥猪的免疫效果比较[J].畜牧兽医杂志,2023,42(5):16-19.
[5] 吴成林,武瑞.3种不同毒株猪伪狂犬病疫苗免疫效果的对比研究 [J].畜牧与饲料科学,2017,38(4):102-104.
