熊果酸通过调控雌激素受体抑制甲状腺癌BCPAP细胞增殖、迁徙、侵袭的机制研究
2024-05-17段祥凯陈红跃
段祥凯,陈红跃
1. 河南中医药大学第二临床医学院,河南 郑州 450000
2. 河南中医药大学第二附属医院甲乳外科,河南 郑州 450000
甲状腺癌属于常见的内分泌恶性肿瘤,临床中甲状腺乳头状癌(PTC)最为常见[1]。国际流行病学报告显示,女性患甲状腺癌的概率是男性的3 至4 倍,女性性激素,尤其是雌激素在甲状腺癌的发展过程中起到了重要作用[2]。雌激素通过其受体ERα、ERβ发挥作用,ERα 大多促进恶性肿瘤细胞的增殖,与之相反,ERβ 通常抑制恶性肿瘤细胞的生长[3]。熊果酸是中药夏枯草的提取物之一,具有广泛的药理学作用,如抗炎、抗氧化、抗病毒等[4-5]。随着近年对中医药更为深入的探索,熊果酸在抗肿瘤方面也表现出了巨大的应用前景,如甲状腺癌、结肠癌、肝癌、前列腺癌等[6]。目前,熊果酸在PTC 发展进程中的作用机制尚不明确。本研究观察熊果酸对甲状腺癌BCPAP细胞生物学的影响及具体作用机制。
1 材料与方法
1.1 实验材料与试剂胎牛血清、RPMI 1640 培养基、胰蛋白酶溶液(Biological 公司),RIPA 组织裂解液、PMSF(索莱宝公司)。CCK-8 试剂盒(上海同仁公司),蛋白电泳凝胶制备盒(陕西中晖赫彩公司)。ERα、ERβ 抗体(武汉三鹰公司)。Transwell 小室(美国Corning 公司)。甲状腺癌BCPAP 细胞:人甲状腺乳头状癌细胞(赛百慷公司);Nthy-ori3-1 细胞:人甲状腺正常细胞株(北京北纳生物技术研究院);熊果酸(索莱宝公司)。
1.2 细胞培养甲状腺癌BCPAP 细胞,采用含10%胎牛血清的RPMI 1640 培养液进行培养,置于37 ℃、5%CO2及饱和湿度细胞培养箱内,待细胞生长至对数期时,收集细胞用于后续实验。
1.3 熊果酸配置称取25 mg 熊果酸粉剂,加入到1 mL DMSO内进行溶解。为提高熊果酸在DSMO中的溶解度,可进行超声波震荡并加热,配置好的熊果酸母液用直径0.22 μm 的滤网在超净工作台中进行过滤。
1.4 Westernblot 实验检测Nthy-ori3-1 细胞和BCPAP 细胞中ERα 和ERβ 表达当Nthy-ori3-1 细胞与BCPAP 细胞处于对数生长期时,胰蛋白酶消化收集细胞。RIPA 裂解液和PMSF 提取细胞总蛋白。BCA 法配平2 组细胞蛋白总量。以每孔10 μL 的规格上样后电泳,随后将目的条带转移至PVDF 膜上转模,脱脂牛奶封闭后一抗孵育过夜,TBST 液洗膜5 次,每次5 min。二抗孵育1 h,TBST 液洗膜5 次,每次5 min。ECL 液发光显影,以目的蛋白条带与内参灰度值比值为相对蛋白含量,实验重复3次。
1.5 CCK-8 检测熊果酸对BCPAP 细胞增殖的影响当BCPAP 细胞处于对数生长期时,胰酶消化;将细胞浓度调整为10×103/mL,按照每孔100 μL,将细胞悬液打入96 孔板中。每组设置4 个复孔,将细胞置于培养箱中继续培养至细胞贴壁。细胞贴壁后,弃去原培养基。将不同浓度的熊果酸培养基(0、4、8、16、32、64 μmol/L)分别加入各孔中,置于培养箱中继续培养24 h、48 h,加入CCK-8溶液,继续培养1~4 h;用酶标仪在450 nm 下检测吸光值。并计算半数抑制浓度(IC50)。
1.6 细胞划痕实验检测熊果酸对BCPAP 细胞迁移能力的影响当BCPAP 细胞处于对数生长期时,胰酶消化;将细胞浓度调整为10×104/mL,在无菌6 孔板中每孔加入2 mL 细胞悬液。BCPAP 细胞在孔底生长面积接近100%时,用200 μL 无菌枪头进行划痕,PBS 清洗2 次。6 孔板中分别加入浓度不同的熊果酸(浓度分别为0 μmol/L、4 μmol/L、8 μmol/L)无血清培养基2 mL。置于ZOOM 培养箱中,拍摄间隔时间设置为每6 h拍摄一次。使用Image J软件测量各组BCPAP细胞划痕愈合面积。
1.7 Transwell 检测熊果酸对BCPAP 细胞侵袭能力的影响RPMI 1640 培养基与Matrigel 胶按8∶1 的比例进行稀释,BCPAP 细胞无血清RPMI 1640 培养基饥饿培养,胰酶消化离心,用不含血清1640 培养基重悬细胞,调整细胞浓度为1×106/mL,在Transwell小室上室中每孔均匀铺入100 μL,下层小室加入浓度为0 μmol/L、4 μmol/L、8 μmol/L 的熊果酸溶液500 μL。37 ℃孵箱培养24 h 后甲醇固定30 min,结晶紫染色10 min,200 倍光镜下随机选取5 个视野的细胞数目计数,实验重复3次。
1.8 Westernblot 实验检测熊果酸干预BCPAP 细胞后ERα 和ERβ 表达情况BCPAP 细胞常规消化接种于无菌6 孔板,待细胞融合至80%时,将6 孔板内培养基更换为无血清熊果酸培养基(0 μmol/L、4 μmol/L、8 μmol/L)。24 h 后胰酶消化收集细胞,RIPA 裂解液和 PMSF 提取细胞总蛋白。BCA 法配平各组细胞蛋白总量。以每孔10 μL 的规格上样后电泳,随后将目的条带转移至PVDF 膜上转模,脱脂牛奶封闭后一抗孵育过夜,TBST 液洗膜5 次,每次5 min。二抗孵育1 h,TBST 液洗膜5 次,每次5 min。ECL液发光显影,以目的蛋白条带与内参灰度值比值为相对蛋白含量,实验重复3次。
1.9 统计学方法使用SPSS21.0 进行数据处理。符合正态分布的计量资料以均数±标准差(±s)表示,满足正态性、方差齐性采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 Nthy-ori3-1细胞与BCPAP 细胞中ERα和ERβ的表达情况见图1。Nthy-ori3-1 细胞与BCPAP 细胞比较,ERα 的表达水平较低(P<0.05),ERβ 的表达水平较高(P<0.05)。

图1 Nthy-ori3-1细胞与BCPAP细胞中ERα和ERβ的表达情况
2.2 熊果酸对BCPAP 细胞增殖活性的影响见表1和图2。不同浓度的熊果酸(4、8、16、32、64 μmol/L)对BCPAP 细胞增殖活性具有抑制作用,呈时间和浓度依赖性(P<0.05)。IC50为11 μmol/L。后续试验采用24 h为药物作用时间。
表1 熊果酸对BCPAP细胞增殖活性的影响(± s) %

表1 熊果酸对BCPAP细胞增殖活性的影响(± s) %
注:①与B0组比较,P<0.05
48 h存活率100 ± 0.00 77.28 ± 1.22①60.12 ± 2.27①22.09 ± 3.37①13.89 ± 1.35①4.43 ± 1.25①组别B0 B4 B8 B16 B32 B64 n4 4 4 4 4 4 24 h存活率100 ± 0.00 80.48 ± 1.56①64.72 ± 0.97①26.99 ± 1.45①17.89 ± 0.38①5.45 ± 0.98①

图2 熊果酸对BCPAP细胞增殖活性的影响
2.3 熊果酸对BCPAP 细胞迁移率的影响见表2。同时间点,B4 组、B8 组BCPAP 细胞迁移率低于B0组(P<0.05)。熊果酸浓度越高,BCPAP 细胞迁移能力受到的抑制就越强。
表2 熊果酸对BCPAP细胞迁移率的影响(± s) %
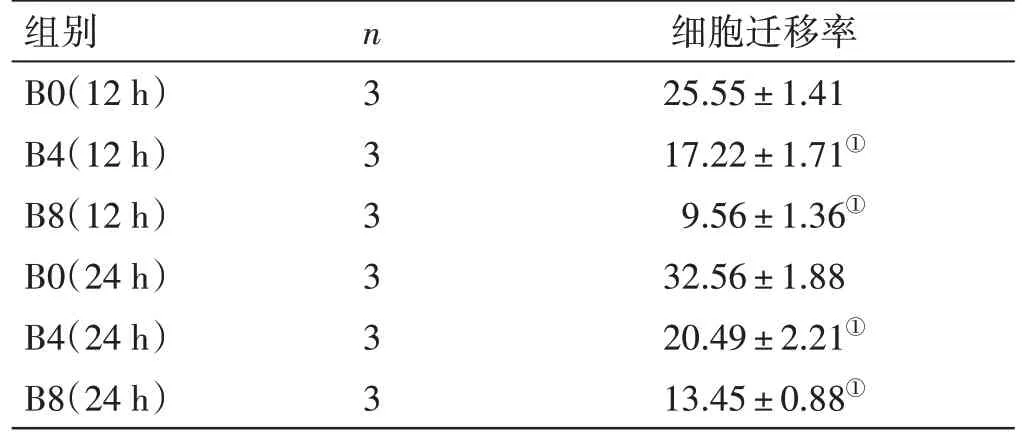
表2 熊果酸对BCPAP细胞迁移率的影响(± s) %
注:①与同时间点B0组比较,P<0.05
细胞迁移率25.55 ± 1.41 17.22 ± 1.71①9.56 ± 1.36①32.56 ± 1.88 20.49 ± 2.21①13.45 ± 0.88①组别B0(12 h)B4(12 h)B8(12 h)B0(24 h)B4(24 h)B8(24 h)n3 3 3 3 3 3

注:N是Nthy-ori3-1细胞;B是BCPAP细胞
2.4 熊果酸对BCPAP 细胞侵袭力的影响见图3。与B0 组比较,B4 组、B8 组BCPAP 细胞侵袭数明显降低(P<0.05),细胞侵袭数量随熊果酸浓度上升逐渐下降。而B0 组和阴性对照组细胞透膜量比较,差异无统计学意义(P>0.05)。

图3 熊果酸对BCPAP细胞侵袭力的影响
2.5 熊果酸对BCPAP 细胞中ERα 和ERβ 表达情况的影响见图4。熊果酸作用24 h 后,B4 组、B8 组ERα 表达水平低于B0 组(P<0.05),ERβ 表达水平高于B0 组(P<0.05)。实验结果证明,熊果酸可以抑制ERα的表达,促进ERβ的表达。
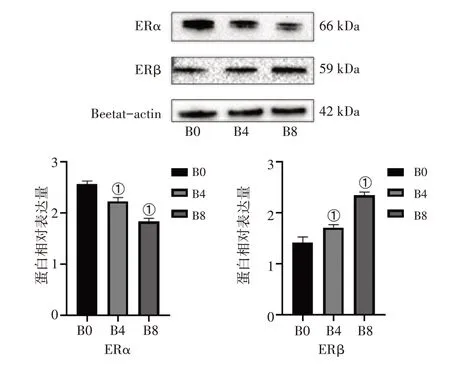
图4 熊果酸对BCPAP细胞中ERα和ERβ表达情况的影响
3 讨论
PTC是最常见的甲状腺恶性肿瘤,约占甲状腺癌发病率的80%[7]。PTC 在早期即可进行淋巴结转移,增加患者死亡风险。目前PTC 的治疗方式以手术治疗为主,但少数患者经手术加碘放射治疗后效果并不明显[8]。对此,天然药物治疗及靶向治疗或许是一个新的方向。
PTC的发展与雌激素及其受体密切相关,体外实验表明雌激素可以促进PTC 的发生发展[9]。雌激素主要通过雌激素受体ERα 和ERβ 发挥生物学效应。ER基因位于人体染色体的6q24-27 区域,ERα 和ERβ的编码基因存在一定差异,两者表现出的生物学效应也表现不同。ERα 和ERβ 两者均在PTC 肿瘤细胞中表达,但PTC 患者组织中ERα 的表达明显高于正常甲状腺组织,而ERβ 的表达低于正常甲状腺组织。在分化较差的未分化甲状腺癌中,这种表达差异更为明显[10]。研究表明,高表达的ERα可以促进甲状腺癌细胞的增殖,ERβ 则促进甲状腺癌细胞进行分化和凋亡,使用ERα 激动剂可以促进抗凋亡Bcl-2的表达,使用ERβ 激动剂可以促进抗凋亡蛋白Bax 的表达,ERα 和ERβ 在甲状腺癌的发展进程中起到拮抗作用[11]。除甲状腺癌外,ER 在多种雌激素相关恶性肿瘤的发展进程中起到关键作用,如乳腺癌、卵巢癌、结肠癌等[12]。研究表明,ERα和ERβ的表达比例对肿瘤发生发展起到重要作用,当促进肿瘤细胞生长的ERα表达明显高于抑制肿瘤细胞生长的ERβ时,就会诱导雌激素反应器官肿瘤的产生[13]。
甲状腺癌属于中医学石瘿范畴,《三因极一病证方论》中明确提出了石瘿的概念。甲状腺癌的病机为肝郁脾虚、气滞痰浊,用药多以祛痰散结、活血化瘀为主[14]。夏枯草具有化痰散结、清热解毒的作用,广泛应用于甲状腺疾病[15]。熊果酸是一种五环三萜酸,为抗肿瘤中药夏枯草提取物之一[16]。近年因其抗肿瘤功效成为研究的热点之一。熊果酸可以从多方面发挥抗癌作用,如诱导肿瘤细胞凋亡、减少肿瘤血管生成、抑制肿瘤转移等。Wang X 等[17]研究发现,熊果酸可以激活凋亡途径,诱导胃癌细胞凋亡,抑制胃癌细胞增殖。Wang M 等[18]研究发现,熊果酸可以通过自噬途径抑制肺癌细胞的生长,促进其凋亡。李龙龙等[19]研究发现,熊果酸可以通过AMPK/STAT3/COX-2信号通路抑制乳腺癌细胞MCF-7的生长和增殖。侯东升等[20]研究发现,熊果酸可以下调PTC TPC-1细胞中存活素及血管内皮生长因子的表达从而达到抑制甲状腺癌TPC-1 细胞的发展进程。本研究提示,相对于熊果酸低浓度组(0 μmol/L),熊果酸中、高浓度组(4 μmol/L、8 μmol/L)可以抑制甲状腺癌BCPAP 细胞的增殖能力。且熊果酸浓度越高,甲状腺癌BCPAP 细胞的增殖能力受到的抑制越明显。同样,与B0组比较,熊果酸中、高浓度组(4 μmol/L、8 μmol/L)甲状腺癌BCPAP 细胞迁徙能力明显下降。侵袭实验也表明,熊果酸可以抑制甲状腺癌细胞BCPAP 的侵袭能力,且浓度越高,侵袭能力下降的越明显。
综上所述,熊果酸能抑制甲状腺癌BCPAP 细胞的增殖、迁徙与侵袭,可能与降低甲状腺癌BCPAP细胞中ERα的表达水平、提升了ERβ的表达水平有关。
