HER2低表达乳腺癌组织中p53基因突变与临床病理特征的关系
2024-05-17葛玲陈艳沈南秀
葛玲 陈艳 沈南秀
乳腺癌是由不孕及初次生育年龄晚、雌激素替代治疗、月经初潮年龄早等多种因素共同诱发的常见恶性肿瘤,早期多表现为乳头溢液、乳房无痛性肿块、乳腺橘皮征,随病情的发展部分患者可出现脑、肝、骨、胸膜转移等相关症状,最终对患者生命安全构成了威胁,故需早期诊治[1]。人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是一种可参与细胞生长、分化调节的重要信号转导通路,为乳腺癌的驱动基因,HER2低表达乳腺癌因肿瘤不易转移故预后较佳;目前,已知HER2低表达乳腺癌发生、发展与细胞、遗传、代谢等存在联系,随着检测技术进步及靶向药物的应用,HER2低表达乳腺癌检出率增加,其临床特点及分子表达逐渐成为学者研究重点,可为未来临床治疗提供借鉴[2]。近年来,癌症治疗因分子生物学研究的进展而逐渐深入,故探讨抗癌、促癌相关基因表达情况对乳腺癌临床诊治具有重要意义。p53为临床常见抑癌基因,其失活或突变为肿瘤发生、发展的重要机制,在多数恶性肿瘤中p53出现基因突变[2-3]。基于此,本研究分析了HER2低表达乳腺癌组织中p53基因突变与临床病理特征的相关性,现报道如下。
1 资料与方法
1.1 一般资料
选择2018年8月—2023年8月厦门市第三医院收治的112例HER2低表达乳腺癌患者为研究对象。所有患者均在厦门市第三医院进行手术切除癌组织,并留取乳腺癌癌组织。纳入标准:所有患者符合《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[4]中的诊断标准,均经病理学检查确诊,免疫组织化学(immunohistochemistry,IHC)1+或2+且荧光原位杂交技术(fluorescence in situ hybridization technique,FISH)检测阴性(免疫组织化学染色无染色或≤10%浸润癌细胞呈微弱、不完整的细胞膜染色为IHC0;>10%浸润癌细胞呈微弱、不完整的细胞膜染色为IHC1+;>10%浸润癌细胞呈中等强度、完整的细胞膜染色或≤10%的浸润癌细胞呈完整且强的细胞膜染色为IHC2+;>10%的浸润癌细胞呈完整且强的细胞膜染色为IHC3+)。排除标准:合并出血性相关病症者;合并传染性疾病者;术前接受过内分泌、放化疗治疗者;哺乳期女性;合并肝硬化者;合并精神障碍疾病者;乳腺组织存在皮肤性或炎症性疾病者;合并其他恶性肿瘤者;合并心、肝、肾功能障碍者。患者男性3例,女性109例;年龄36~75岁,平均(56.72±7.42)岁。患者对本研究内容均已知情并签署知情同意书。本研究经厦门市第三医院伦理委员会批准。
1.2 p53基因突变检测
通过银染聚合酶链反应-单链构象多肽性分析法(polymerase chain reaction single strand conformation polymorphism,PCR-SSCP)对乳腺癌病理组织标本p53基因突变情况进行检测,退火温度:65、67、62、68 ℃,采用包含100 ng DNA模板(癌组织、癌旁组织)、2.5 μL 10×PCR缓冲液、0.6 mmol/L引物浓度、200 mmol/L dNTP混合物、0.75 Uampli Taq Gold的PCR反应体积,94、70 ℃均为1 min,共40个循环,8%~12%扩增物,十二烷基硫酸钠聚丙烯酰胺凝胶电泳。250 V 12~15 h,银染后行SSCP分析,检测p53基因5,6,7,8外显子突变情况。
1.3 观察指标
(1)分析HER2低表达乳腺癌组织中p53基因突变情况。(2)分析p53基因突变与HER2低表达乳腺癌临床病理特征的相关性。(3)多元线性逐步回归分析p53基因突变与临床病理特征的关系。
1.4 统计学处理
采用SPSS 19.0统计学软件进行数据分析。计量资料以()表示,组间比较采用独立样本均数t检验;计数资料以n(%)表示,采用χ2检验。采用Pearson相关性分析p53基因突变与HER2低表达乳腺癌临床病理特征的相关性,采用多元线性逐步回归分析p53基因突变与临床病理特征的关系。检验水准α=0.05。
2 结果
2.1 HER2低表达乳腺癌组织中p53基因突变情况分析
HER2低表达乳腺癌组织中p53基因未突变82例,占比为73.21%;p53基因突变30例,占比为26.79%。
2.2 p53基因突变与HER2低表达乳腺癌临床病理特征的相关性
p53基因突变与HER2低表达乳腺癌肿瘤直径、淋巴结转移、脉管侵犯、临床分期呈正相关(P<0.05)。见表1。

表1 p53基因突变与HER2低表达乳腺癌临床病理特征的相关性[例(%)]
2.3 多元线性逐步回归分析p53基因突变与临床病理特征的关系
将年龄、BMI、Ki-67指数、ER指数等因素控制后p53基因突变与HER2低表达肿瘤直径、淋巴结转移、脉管侵犯、临床分期相关,差异有统计学意义(P<0.05)。见表2。
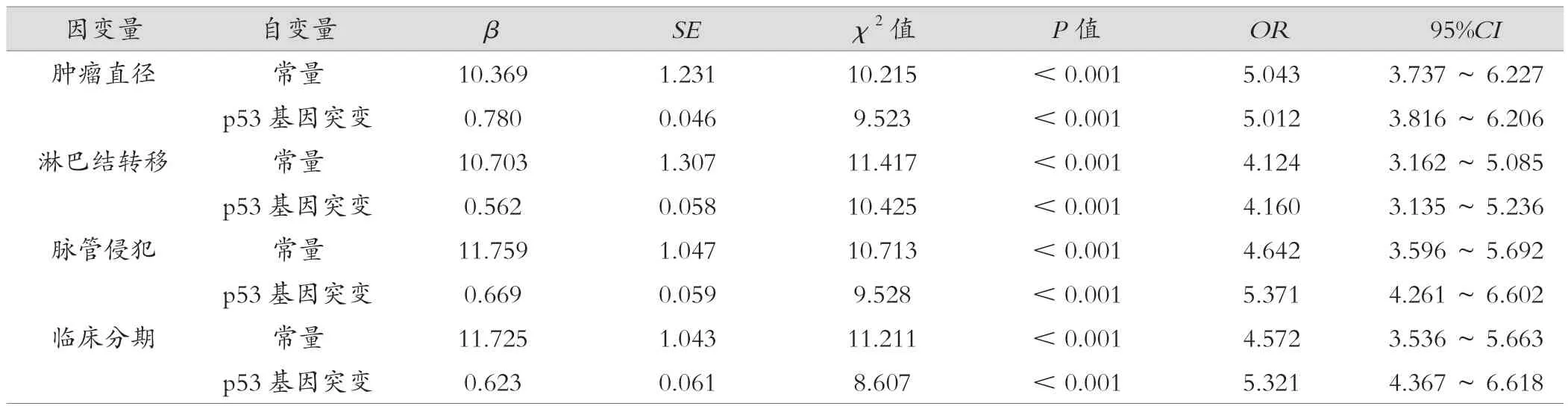
表2 多元线性逐步回归分析p53基因突变与临床病理特征的关系
3 讨论
乳腺癌患者以女性人群为主,其发病率呈上升趋势且趋于年轻化,虽然患者预后因治疗水平的提升及治疗手段的综合运用而有所提升,但患者5年生存率仍较低,故寻找乳腺癌的新型治疗手段具有关键意义[5-7]。乳腺癌发生、发展涉及多个步骤及基因,与肿瘤细胞自身生长优势、癌细胞对细胞外基质的降解及破坏、细胞间黏附能力降低、淋巴管生成等存在联系[8-10]。
HER2为乳腺癌发生、发展中重要的基因,HER2是与乳腺癌患者临床分期、生存期联系密切的人类表皮生长因子受体家族成员,属于原癌基因,HER2可通过异源或同源二聚体的形式发生耦联,使下游络氨酸酶被激活并发生磷酸化,以此对肿瘤细胞增殖起到调节作用[11-13]。临床多依照免疫组织化学对乳腺癌组织进行定分型,根据HER2不同表达情况可分为HER2零表达、低表达及过表达3种,其过表达提示乳腺癌患者预后差、易转移及复发、生存率低,而零表达、低表达均依照HER2阴性进行治疗,预后较佳,曲妥珠单抗对癌细胞生长、迁移、繁殖具有抑制作用,不仅治疗HER2高表达乳腺癌疗效显著,且对部分HER2低表达患者同样有较为理想的治疗效果,但因相关研究较少,其作用机制尚未完全明确[14-16]。现阶段癌症治疗因分子生物学的发展由原先的细胞水平进展至分子水平,对乳腺癌分子水平进行分析具有重要意义,故本研究对HER2低表达乳腺癌组织中p53基因突变低表达情况进行分析,以期为HER2低表达乳腺癌患者的临床治疗提供借鉴。
p53是一种与原癌基因共同在体内发挥调控癌基因表达的抑癌基因,p53对乳腺癌细胞的正常生长、分裂具有维持作用,DNA在细胞经受外来伤害时会发生分裂,p53基因在细胞进行自动修补时可使其终止在G1/S期,从而限制了细胞的无限增殖,若细胞无法自我修复则会出现程序性死亡,导致癌细胞无法持续增殖,最终发挥了抑癌作用[17-19]。正常情况下p53以细胞周期素依赖激酶、细胞周期素、增殖细胞核抗原的形式存在,在组织、细胞中半衰期较短,故表达水平较低,体内癌细胞活化后p53磷酸化并聚集以发挥其生物学作用,故表达水平上升,p53的体细胞突变在乳腺癌中较为常见,与患者转移、复发等联系密切[20]。本研究发现,HER2低表达乳腺癌组织中p53基因未突变82例,占比为73.21%;p53基因突变30例,占比为26.79%,提示HER2低表达乳腺癌患者p53基因突变率较低,且p53基因突变与HER2低表达乳腺癌肿瘤直径、淋巴结转移、脉管侵犯、临床分期均相关,表明p53基因突变与乳腺癌患者病情进展密切相关。分析其原因为:当p53基因突变后则无法发挥诱导癌细胞凋亡、调节细胞生长周期的作用,且对广泛使用的抗癌药物及电离辐射具有更强的抵抗力,从而造成乳腺癌患者肿瘤直径、临床分期增加,淋巴结转移、脉管侵犯发生风险增大[21]。
综上所述,本研究发现,HER2低表达乳腺癌组织p53基因突变率较低,且p53基因突变与肿瘤直径、淋巴结转移、脉管侵犯、临床分期相关。但因样本量过少,且未对其作用机制进行分析,因此还需后续进一步分析p53基因突变参与HER2低表达乳腺癌发生、发展的具体机制,造福于更多的HER2低表达乳腺癌患者。
