钯纳米催化剂上过氧化氢直接合成理论研究
2024-05-14张智淇杨永鹏
张智淇, 李 攀, 杨永鹏
(郑州大学 河南先进技术研究院 河南 郑州 450003)
0 引言
过氧化氢是一种无色透明液体强氧化剂,具有较高的活性氧含量,且在氧化反应后唯一产物是水,因此被认为是一种绿色氧化剂[1]。随着全球工业时代的发展,过氧化氢的需求量逐渐增加[2]。目前,过氧化氢的商业生产主要依赖于蒽醌法。蒽醌法是一种较为复杂的方法,在生产过程中往往产生资源浪费和环境污染,不符合可持续发展的要求。因此,如何持续、绿色、安全地生产过氧化氢成为人们热议的话题。
氢氧直接合成过氧化氢的方法引起了专家学者们的关注。该方法使用氢气和氧气作为反应原料,利用贵金属催化剂进行合成,并最终将过氧化氢分离出来。这种方法操作相对简单,产生的污染较少,而且可以生产出成本较低、任意浓度的过氧化氢。与同等规模的蒽醌法相比,直接合成方法所需的设备和运营成本更低,因此具有取代蒽醌法的巨大潜力[3]。然而,氢氧直接合成法在工业化大规模应用中仍存在一些技术问题尚未解决,如安全性问题、缺乏稳定高效的催化系统问题等[4]。
金属氧化物二氧化钛(TiO2)作为载体的催化剂,在科学实验中得到了广泛应用,这是因为它具有低成本、可还原性和良好的催化性能等优点。此外,当二氧化钛经过高温还原后,它与金属纳米颗粒之间会形成SMSI效应,从而提高催化剂的性能。因此,二氧化钛载体催化剂非常适用于氢化反应。
Tu等的研究[5]探讨了Pd-TiO2(B)/锐钛矿催化剂表面过氧化氢解吸对过氧化氢选择性的影响。该研究发现,在不影响反应活性的情况下,提高了过氧化氢的解吸速率,从而使过氧化氢的选择性得到改善。Naina等[6]通过实验研究了经酸处理后不同形状的Pd3Pb负载在二氧化钛表面后催化合成过氧化氢性能。结果发现,立方体纳米颗粒能更有效地促进过氧化氢的生成。Brehm等[7]制备了Au-Pd/TiO2催化剂用于过氧化氢合成反应,通过XPS分析,发现在经过热处理后Pd以Pd0和Pd2+的形式存在。除了实验应用,二氧化钛作为载体还被广泛用于催化剂第一性原理计算研究。Han等[8]利用第一性原理密度泛函理论研究了完整和缺陷的TiO2载体对PdmAgn双金属团簇结构稳定性和电子性能的影响。
本文旨在利用密度泛函理论研究TiO2负载的Pd催化剂中价态对直接合成过氧化氢催化性能的影响。利用全局搜索方法确定不同价态下纳米催化剂最稳定的结构,通过计算反应过程中吸附质的吸附性质以及反应机理来研究其反应性能,同时研究讨论了二氧化钛载体在过氧化氢直接合成中的作用。
1 计算方法
本文中所有的计算都基于密度泛函理论(DFT),采用CP2K软件包中的GPW进行计算[9-10]。选择Perdew-Burke-Ernzerhof(PBE泛函)作为交换相关能量泛函。针对计算涉及的各种种类,采用Goedecker-Tetter-Hutter(GTH)赝势[11]和DZVP-Molopt基组[12]的组合。平面波的截断能设定为350 Ry,自洽场收敛标准设为1.0×10-6Ha。考虑金属氧化物二氧化钛的强关联电子性质,采用了DFT+U方法进行计算,并将Ueff值设定为4.20 eV[13],以准确描述钛原子中的d轨道电子。二氧化钛载体的表面选择了稳定性较高的TiO2(110)[14]。表面模型的厚度采用了3个单元的层数,表面大小分别使用5×2和6×2。结构优化后的二氧化钛表面上的钛原子由于配位数的不同被分为五配位钛(Ti5c)、六配位钛(Ti6c)、二配位氧(O2c)和三配位氧(O3c)。考虑计算中的周期性问题,将包含Pd19团簇的结构负载在6×2单元格的表面上。同时真空层厚度我们设置为10 Å。
本文中,通过模拟退火方法得到了负载在TiO2上的Pd19和Pd19O10结构。具体而言,使用AIMD将结构从700 K经过11 ps模拟退火至0 K。而其他负载在载体上的团簇结构则是通过极小跳跃算法进行搜索的。我们使用了爬坡弹性带方法(CI-NEB)[15]来计算过渡态的结构和反应能垒,其收敛标准为最大受力小于2×10-3Ha/Bohr。活化能 (Ea) 的计算公式为Ea=E(TS)-E(IS),其中:E(TS)是过渡态(TS)的能量;E(IS) 是初始态(IS)的能量。反应能 (ΔE)的计算公式为ΔE=E(FS)-E(IS), 其中:E(FS)是最终态(FS)的能量;E(IS)是初始态的能量。
2 计算结果与讨论
2.1 TiO2负载钯纳米团簇全局最优结构
本文的主要研究内容是关于Pdn/TiO2和(PdO0.5)n/TiO2(n=4、12和19)的全局最优结构和性质。搜索结果如图1~5所示,纳米团簇与二氧化钛表面结合,纳米团簇变化明显。表1总结了钯纳米团簇和负载钯纳米团簇中Pd—Pd的平均键长、氧化团簇中Pd—O的平均键长以及氧的平均结合能。此外还对每个负载型团簇催化剂进行了Barder电荷和差分电荷密度分析。

图1 Pd4/TiO2俯视图及侧视图
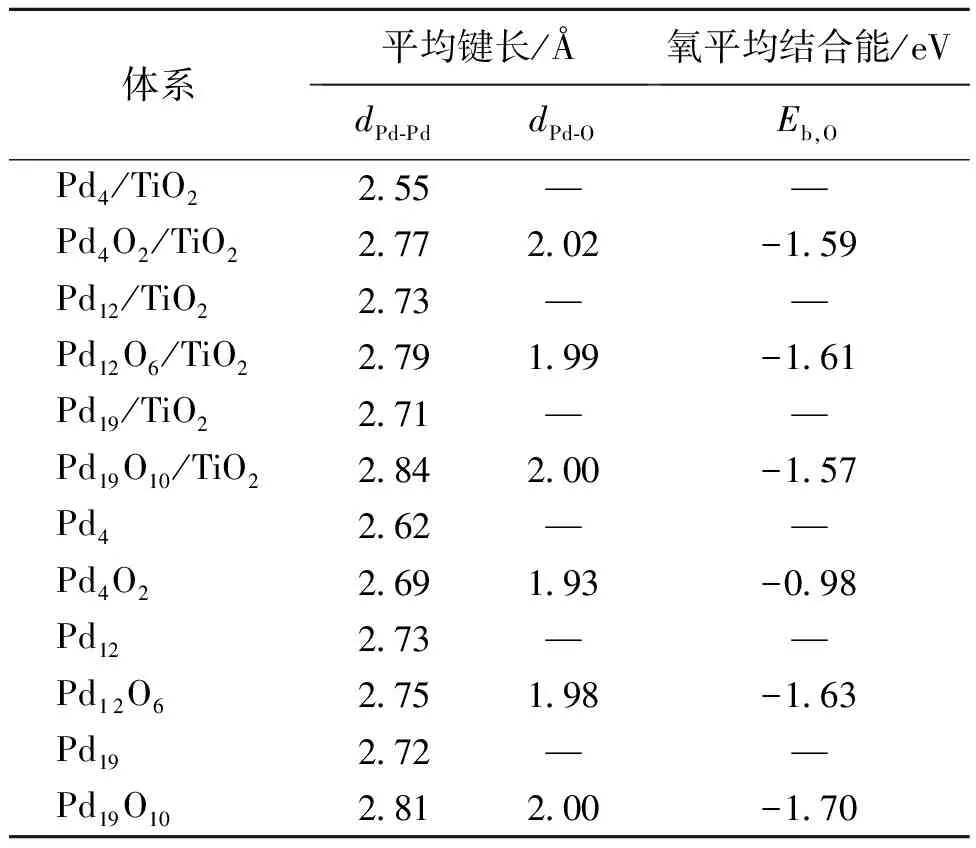
表1 钯纳米团簇及二氧化钛负载钯纳米团簇的均键长及氧的平均结合能
如图1所示,Pd4在TiO2表面全局最优结构为方形平面结构,与表面的Ti5c和O2c成键。Pd4/TiO2中的Pd—Pd平均键长为2.55 Å,比未负载的Pd4团簇的键长更短,这是因为团簇结构发生了显著变化。Pd4/TiO2中所有的Pd—Pd键的长度并不相同,从侧视图中可以看到两个Pd之间的键长较短。根据差分电子密度,Pd4负载于TiO2时,团簇中的钯失去了电子,而表面的Ti5c获得了电子。根据Bader电荷分析,载体得到了0.43个电子。
如图2所示,Pd4O2负载在TiO2表面时,其中三个Pd分别与O2c成键,Pd—O2c的平均键长为2.12 Å。在Pd4O2/TiO2团簇中,Pd—Pd键的长度为2.77 Å,比Pd4/TiO2有所增长。与Pd4O2团簇相比,负载型团簇催化剂中Pd—O键的长度更长,而氧的平均结合能增加,这是由于负载型团簇中的一个氧与Ti5c结合形成了Pd—O—Ti键,增强了团簇的稳定性。根据差分电子密度,Pd4O2负载于TiO2时,团簇中的钯失去了电子,而形成Pd—O—Ti键的氧获得了电子。同时,界面处的O2c和O3c获得了电子。根据Bader电荷分析,载体获得了0.22个电子,这个数值低于金属团簇负载催化剂。这证明团簇在氧化后的整体电子转移量降低,而团簇中的氧获得了部分电子,通过形成Pd—O—Ti键使团簇稳定地结合在载体表面上。
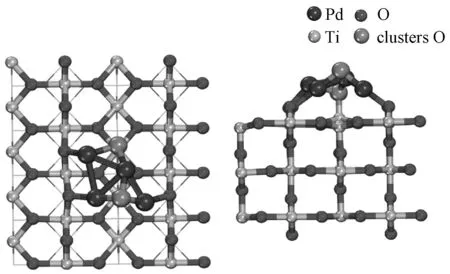
图2 Pd4O2/TiO2俯视图及侧视图
如图3所示,Pd12在TiO2上呈相对整齐的排列。团簇分为两层,下层8个钯与两列各4个O2c成键,其平均键长为2.23 Å,并且与中间列的Ti5c成键。上层包含4个Pd,其中3个与下层的Pd相连形成四棱锥结构,另1个位于左侧,形成四面体结构。突出的Pd最可能成为活性位点。对于Pd12/TiO2,Pd—Pd键的长度为2.73 Å,与未负载的Pd12团簇相同。根据差分电子密度,Pd12负载于TiO2时,电子向界面转移,电子密度较高的区域主要集中在下层Pd和界面Ti5c之间。界面处的Ti5c和O3c获得电子,TiO2载体获得了0.71个电子。
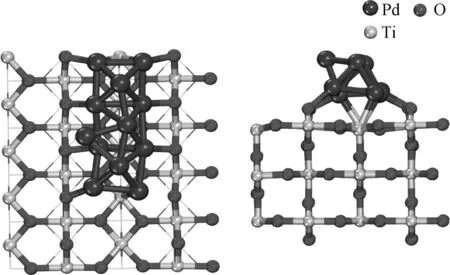
图3 Pd12/TiO2俯视图及侧视图
根据图4所示,二氧化钛负载的团簇Pd12O6仍然保持着稳定的核壳结构。团簇表面的6个钯与二配位的氧成键,平均键长为2.14 Å。团簇表面的氧中有4个处于中空位,另外2个与Pd和Ti5c形成Pd—O—Ti键,Ti—O键的平均键长为1.78 Å。与Pd12/TiO2相比Pd—Pd键长增加了0.06 Å。与未负载的Pd12O6相比,Pd—O键长增加了0.01 Å,且氧的平均结合能减小,这表明二氧化钛载体的加入使得Pd12团簇较难被氧化。与Pd4O2/TiO2相比,氧的平均结合能增强。根据差分电子密度,Pd12O6负载于TiO2时,界面处形成Pd—O—Ti键,电子开始向氧转移,氧得到了电子。通过Bader电荷分析可知,载体获得了0.23个电子,这表明氧化后的团簇向载体转移的电子减少,电子的分布主要集中在界面位置处的氧上。
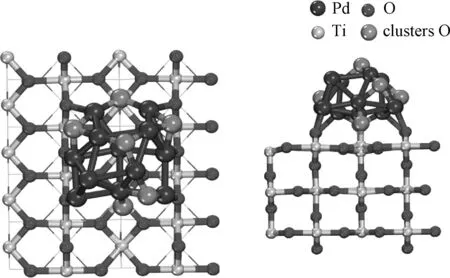
图4 Pd12O6/TiO2俯视图及侧视图
如图5所示,团簇Pd19在二氧化钛上的结构和Pd12类似,也分为上、下两层。下层由13个Pd分别与O2c和Ti5c形成键,其中有1个核心钯位于二氧化钛表面的中空位上方。上层由6个Pd组成,尽可能与下层形成规则的多面体结构。Pd19/TiO2的Pd—Pd平均键长为2.71 Å,略短于Pd19中的Pd—Pd平均键长。根据差分电子密度,Pd19负载于TiO2时,与Pd12/TiO2的电子密度分布类似。根据Bader电荷分析,TiO2载体获得了0.98个电子,随着团簇尺寸的增大,Pd与载体结合的数量增加,转移的电子数也随之增加。
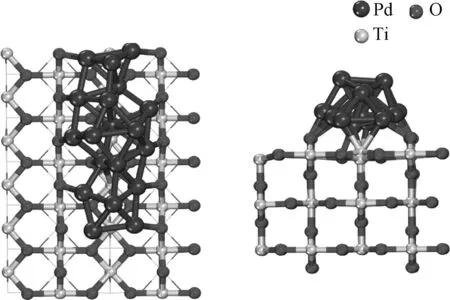
图5 Pd19/TiO2俯视图及侧视图
根据图6显示,Pd19O10团簇负载到TiO2表面后,核壳结构发生了改变,其中一个Pd暴露在表面上。与TiO2载体成键的有下层的8个Pd和2个O,而其余的8个O位于团簇表面。Pd和载体表面的O2c形成的键平均键长为0.97 Å。团簇中的O、Pd和表面的Ti5c在界面处形成Pd—O—Ti键,其中O—Ti键的平均键长为1.80 Å。在Pd19O10/TiO2中,Pd—Pd平均键长为2.84 Å,比未负载的Pd19O10更长。尽管Pd—O平均键长相同,Pd19O10/TiO2的氧平均结合能远低于Pd19O10,这表明负载到二氧化钛载体上的团簇较难被氧化。(PdO0.5)n/TiO2中,Pd19O10/TiO2的Pd—O键长最长,氧的平均结合能也最弱,这表明较大尺寸的负载型团簇更难被氧化。根据差分电子密度,Pd19O10团簇负载到TiO2表面时,界面处形成Pd—O—Ti键,电子开始向氧转移,同时载体表面的O也处于得电子状态。根据Bader电荷分析,TiO2载体的电子数为0.35,与Pd19O10/TiO2相比,载体得电子数少了0.63,这表明团簇的氧化导致界面处的O获得了更多的电子。
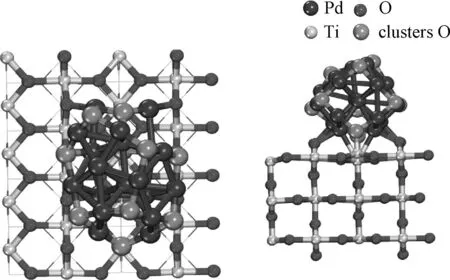
图6 Pd19O10/TiO2俯视图及侧视图
综上所述,负载在TiO2表面的Pdn团簇,在Pd—Pd平均键长方面与未负载团簇相比略有缩短或保持不变。通过比较负载前、后团簇的Pd—O平均键长和氧平均结合能,可以得出Pd12和Pd19在负载后更难被氧化的结论。界面处容易形成Pd—O—Ti键,从差分电荷密度图中观察到Pd—O—Ti键中的氧获得电子,这表明界面处的Pd更容易被氧化。负载TiO2载体的(PdO0.5)n纳米团簇尺寸增大时,Pd—Pd平均键长也相应增加。此外,Pd19O10/TiO2在(PdO0.5)n/TiO2中的Pd—O键长最长,氧平均结合能最弱,表明较大尺寸的负载型团簇更难被氧化。
2.2 反应物、中间体和产物的吸附
2.2.1H2、O2、OOH和H2O2的吸附 H2、O2、OOH和H2O2是形成过氧化氢的关键吸附质,它们的吸附性能直接影响过氧化氢的合成。表2为这些吸附质在钯纳米团簇和负载型钯纳米团簇的吸附能数据。
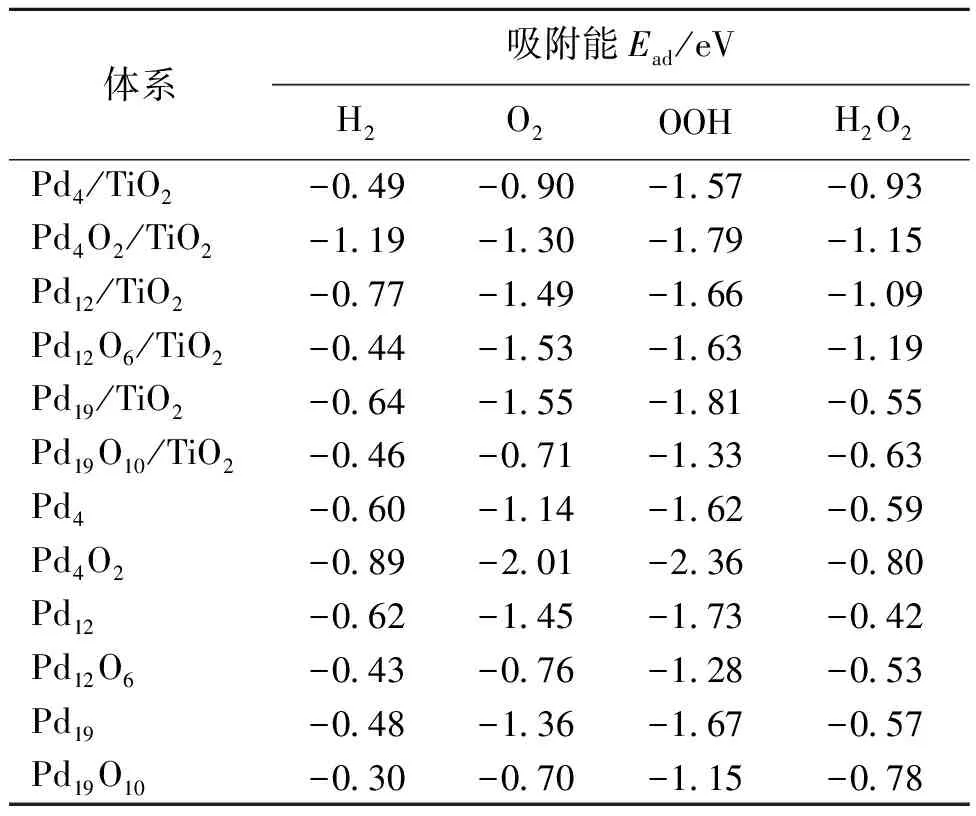
表2 钯纳米团簇及负载型钯纳米团簇上H2、O2、OOH和H2O2的吸附能
在Pdn/TiO2上,H2的吸附能从Pd4的-0.49 eV升高至Pd12的-0.77 eV,然而在Pd19/TiO2上减少至-0.64 eV。在(PdO0.5)n/TiO2上,H2在Pd4O2/TiO2上显示出最强的吸附能,为-1.19 eV。除了Pd4,其他团簇负载到TiO2上后对H2的吸附都有增强的趋势。O2吸附在负载型团簇上是以两个O各自吸附在Pd的顶点位构型。随着团簇尺寸的增大,负载型Pdn团簇中氧的吸附能增加,在Pd19上达-1.55 eV。负载型(PdO0.5)n团簇中,O2在Pd4O2/TiO2上的吸附能为-1.30 eV,随团簇尺寸增大到Pd12O6/TiO2,吸附能增加至-1.53 eV,但在Pd19O10/TiO2上吸附能降低至-0.71 eV。负载型Pd12和Pd19团簇氧化后,对H2的吸附能降低。当团簇较小时,部分氧化后对O2的吸附能力增强。除了Pd4团簇外,TiO2负载型团簇相比未负载团簇对O2的吸附能力更强。总体而言,在负载型钯纳米团簇上,O2的吸附能高于H2的吸附能,这与未负载纳米团簇上的吸附能变化规律一致。
在负载型团簇上,中间体OOH的吸附位置主要为O吸附在钯的顶点位,且H与载体表面的O2c形成氢键。OOH在团簇Pd12/TiO2上的吸附能相较于Pd4/TiO2高出0.19 eV。负载后的团簇对OOH的吸附能在Pd12O6、Pd19和Pd19O10上增强。这是因为OOH在Pd12O6/TiO2上与表面的O2c形成氢键。
在Pdn/TiO2上,H2O2的吸附构型为O吸附在Pd上,而H与载体表面的O2c形成氢键。在团簇Pd12/TiO2上,过氧化氢的吸附能达到最大值,为-1.09 eV。负载型团簇经氧化后,H2O2的吸附构型发生变化,H与团簇上的O形成氢键。在Pd12O6/TiO2上,H2O2的吸附能最高,这可能是因为两个H分别与载体表面的O2c和团簇上的O形成氢键。而随着团簇尺寸的增大,在Pd19O10/TiO2上,H2O2的吸附并未形成氢键,吸附能仅为-0.63 eV。当团簇较小时,TiO2负载后对H2O2的吸附增强。
2.2.2H、O、OH和H2O的吸附 表3是钯纳米团簇及负载型钯纳米团簇上H、O、OH和H2O的吸附能。H以桥位形式吸附在Pdn/TiO2上,其中Pd4团簇的吸附能为-1.15 eV。随着载体上团簇尺寸增大,H的吸附能逐渐减少。当团簇部分氧化后,H在顶点位吸附,吸附能呈下降趋势。在Pd4O2/TiO2上H的吸附能为-0.64 eV,Pd—H键的H倾向于中空位。在Pd12O6/TiO2上,相同吸附位点的吸附能为-0.66 eV。随着团簇增大到Pd19O10/TiO2,H的吸附能降低至-0.48 eV,吸附位置变为Pd—H键的H倾向于桥位,键长为1.63 Å。与未负载团簇相比,负载型团簇增强了对H的吸附能力。O在负载型团簇上主要吸附在桥位和中空位。在Pd4/TiO2上,O吸附在桥位,吸附能为-1.39 eV。随着团簇增大到Pd12/TiO2,O吸附在中空位上,吸附能升高至-1.84 eV。在(PdO0.5)n/TiO2上,O的吸附能有所降低。其中Pd12O6/TiO2上的吸附能最高。与未负载的团簇相比,当团簇尺寸较大时,TiO2负载使得团簇对O的吸附能力增强。研究结果表明,H和O的吸附能随负载型团簇尺寸的增大而减小。此外,在团簇部分氧化后,吸附能也降低。

表3 钯纳米团簇及负载型钯纳米团簇上H、O、OH和H2O的吸附能
OH在Pd4/TiO2上吸附在桥位,吸附能为-3.23 eV。在Pd12/TiO2上,OH吸附在Ti5c位置上的结合能最低。随着团簇尺寸增大,OH在Pd19/TiO2上的吸附能降低至-2.80 eV。团簇部分氧化后,在Pd4O2/TiO2上,OH吸附在Ti5c位置时的吸附能为-3.25 eV。在Pd12O6/TiO2和Pd19O10/TiO2上,OH吸附在团簇的桥位上,吸附能随团簇尺寸增大而降低。TiO2的负载显著增强了OH的吸附能力。
当H2O吸附在负载型团簇的Pd顶点时能量是最低的。在Pd4/TiO2上,H2O的吸附能为-0.44 eV,当团簇尺寸增大到Pd12/TiO2时,吸附能增加至-0.86 eV。在Pd4O2/TiO2上H2O的吸附能最大,为-1.07 eV,吸附在Pd上,并与载体表面上的O2c形成氢键。
2.3 过氧化氢直接合成反应机理
2.3.1Pd4/TiO2和Pd4O2/TiO2上过氧化氢直接合成反应机理 表4显示了过氧化氢的反应路径,其中:*表示吸附位点。可以看出在Pd4/TiO2上,氢气的分解能垒为0.07 eV。团簇部分氧化后,H2的解离能垒升高为0.14 eV,解离后的H稳定地吸附在桥位上。在Pd4/TiO2上,氧气与氢化反应的能垒为1.03 eV,H从桥位扩散到四重中空位,和吸附在顶点位的O进行结合,O—O键在反应时呈一定的倾斜角度,最终形成OOH。在Pd4O2/TiO2上,O2的加氢活化能垒降低为0.98 eV,H从桥位扩散到顶点位,并与O2结合生成OOH。
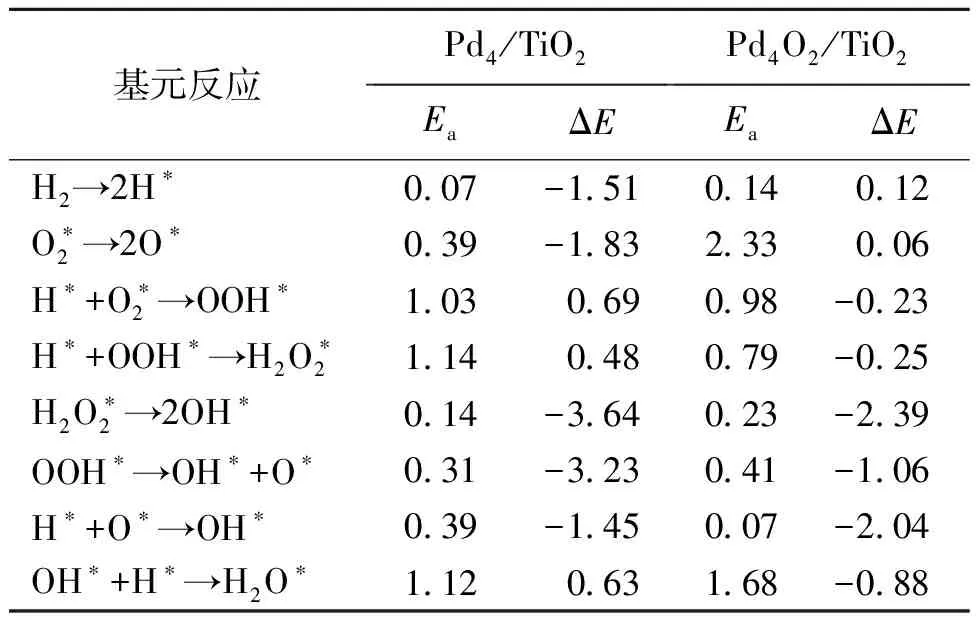
表4 Pd4/TiO2和Pd4O2/TiO2基元反应活化能垒Ea和反应能ΔE
在Pd4/TiO2上,OOH加氢生成过氧化氢的活化能垒为1.14 eV,是合成过氧化氢的决速步骤。然而,在Pd4O2/TiO2上,OOH形成能垒明显降低至0.79 eV。在这种情况下,过渡态H从初始的桥位扩散,并倾向于与OOH中的O成键。TiO2负载的Pd4团簇在氢气分解时能垒降低,但两次加氢反应的能垒升高,决速步骤变为OOH的加氢反应。然而,在TiO2负载的Pd4O2团簇上,OOH的加氢反应能垒下降,决速步骤由OOH的加氢反应变为O2的第一次加氢反应。
根据图7所示,Pd4/TiO2和Pd4O2/TiO2上过氧化氢的脱附能明显高于解离能垒。在Pd4/TiO2上,过氧化氢的解离能垒为0.14 eV,过渡态为O—O键拉伸,断裂后形成两个OH基团,分别稳定吸附在载体表面的Ti5c和团簇桥位上。而在Pd4O2/TiO2上,解离能垒升高至0.23 eV,过渡态中O—O键断裂,吸附在Pd顶点位上,表明该催化剂上过氧化氢的分解更为困难。Pd4/TiO2上过氧化氢的解离能垒显著增加。

图7 在Pd4/TiO2和Pd4O2/TiO2上H2O2形成和分解的势能面
根据图8所示的势能面,O2在Pd4/TiO2上的解离能仅为0.39 eV,相对于Pd4而言显著降低。在Pd4O2/TiO2上,O2的解离能垒为2.33 eV,过渡态的结构是O—O键的断裂,O吸附在Pd顶点位上。对于OOH的分解,氧化后团簇上的分解能垒比Pd4/TiO2上的更高。在Pd4/TiO2上,OOH中的O—O键断裂,终态时OH吸附在二氧化钛表面,O吸附在团簇的中空位,团簇的结构由平面方形变成菱形。在Pd4O2/TiO2上,氧与氢结合生成OH的活化能垒更低,仅为0.07 eV。初始态吸附在顶点位的H容易向桥位扩散并与O结合。H2O的形成能垒在Pd4/TiO2上为1.12 eV,在氧化后的团簇上该能垒升高。TiO2负载的团簇降低了OOH的分解能垒和OH的形成能垒,导致H2O的生成能垒升高。
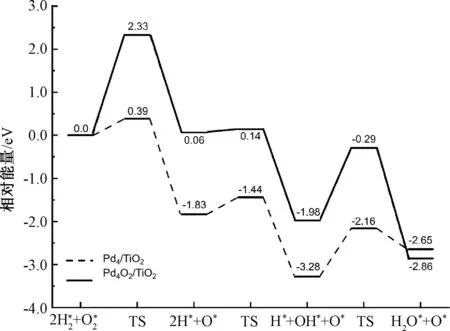
图8 Pd4/TiO2和Pd4O2/TiO2上H2O形成的势能面
Pd4O2/TiO2上的O2和中间体OOH比较不容易分解,加氢反应的能垒更低,而且形成过氧化氢不易分解。通过TiO2负载后,团簇的决速步骤发生了改变,由原来的OOH的加氢步骤变为O2的首次加氢步骤。
2.3.2Pd12/TiO2和Pd12O6/TiO2上过氧化氢直接合成反应机理 Pd12/TiO2和Pd12O6/TiO2上合成过氧化氢的路径如表5所示。在金属钯纳米团簇上,H2的解离能垒为0.43 eV,O2加氢的反应能垒为1.29 eV。H从桥位吸附处扩散到顶点位,与O2结合形成OOH,这一步骤是在Pd12/TiO2上生成过氧化氢的决速步骤。当OOH经过进一步的氢化,活化能垒为0.92 eV。过渡态结构中,位于中空位的H扩散到顶点位上,形成过氧化氢。团簇部分氧化后H2的分解能垒显著降低,第一次加氢反应的能垒为0.57 eV,比Pd12/TiO2减少了0.72 eV。这一步骤为Pd12O6/TiO2上形成H2O2的决速步骤。此时的过渡态是H由初始态的三重中空位扩散到桥位上与氧气结合。在Pd12O6/TiO2上,OOH加氢的活化能垒为0.44 eV,低于Pd12/TiO2。与未负载团簇Pd12相比,Pd12/TiO2的H2解离能垒增加,而O2和OOH的加氢反应能垒降低。负载TiO2后的Pd12O6团簇上,H2解离能垒和两次加氢反应的能垒均显著降低,且形成H2O2的决速步骤变为O2的加氢反应。
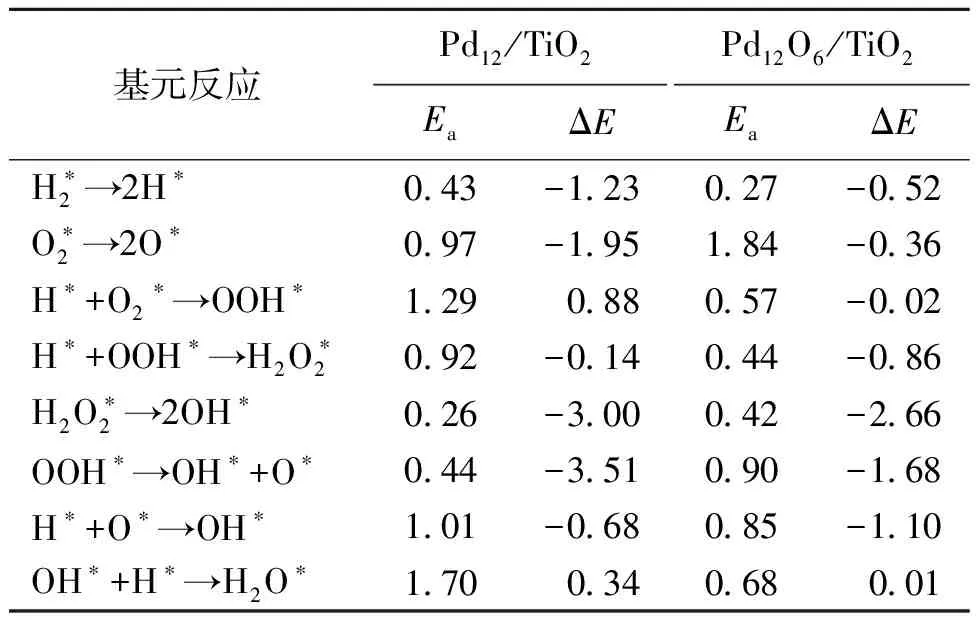
表5 Pd12/TiO2和Pd12O6/TiO2基元反应活化能垒Ea和反应能ΔE
从图9(a)中的过氧化氢分解势能曲线,可以看到过氧化氢的脱附能在两种团簇上均高于其分解能垒。在Pd12/TiO2上,过氧化氢的解离能垒为0.26 eV。经过O—O键断裂后,OH吸附在钯团簇的桥位上,另一个吸附在载体表面的Ti5c顶点位上。当团簇发生氧化后,分解能垒升高到0.42 eV。在分解过程中主要需要克服氢键作用力,形成的OH与Pd12/TiO2上的吸附位置相似。当TiO2作为载体添加时,会导致Pd12上H2O2分解能垒升高,而Pd12O6上的分解能垒降低。
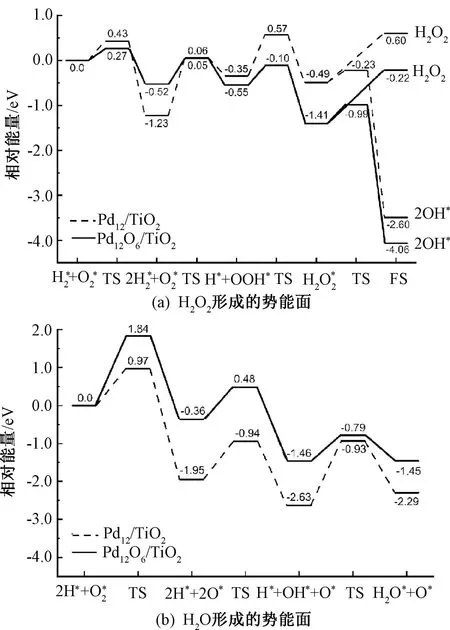
图9 Pd12/TiO2和Pd12O6/TiO2上的势能面
在负载催化剂上,O2的解离能垒如图9(b)所示。在Pd12/TiO2上,O2中的O—O键被拉伸,其中一个氧吸附到桥位上,终态下两个氧吸附在中空位上。在Pd12/TiO2上,OOH的分解能垒为0.44 eV。在Pd12/TiO2上,由H和O直接结合生成OH的反应能垒为1.01 eV,同时形成H2O的活化能垒也相对较高。而在Pd12O6/TiO2上,O2和OOH的解离能垒显著升高,分别为1.84 eV和0.90 eV。这两个过程的过渡态结构都是由O—O键拉伸到一定程度后发生断裂形成。值得注意的是,H和O形成OH的能垒以及OH氢化形成H2O的活化能垒都比Pd12/TiO2上的能垒更低。相比未负载的Pd12团簇,Pd12/TiO2上的O2解离能垒降低。与Pd12O6相比,Pd12O6/TiO2上的O2和OOH的分解能垒均升高。
在Pd12O6/TiO2负载催化剂上,过氧化氢形成过程中的两次加氢反应的活化能垒相比于Pd12/TiO2明显降低,同时,O2和OOH的解离能垒增加,有利于过氧化氢的生成。与未负载的Pd12O6团簇相比,TiO2负载导致了H2的解离能垒和两次加氢反应能垒的降低,以及O2和OOH的解离能垒的升高。
2.3.3Pd19/TiO2和Pd19O10/TiO2上过氧化氢直接合成反应机理 在Pd19/TiO2和Pd19O10/TiO2上,过氧化氢的合成路径如表6所示。在Pd19/TiO2上,氢气分解的能垒为0.27 eV,随着团簇的氧化,H2的解离能垒升高至0.34 eV,解离后的H吸附在桥位上。在Pd19/TiO2上,氧气加氢的活化能垒为0.90 eV,比Pd19O10/TiO2上的垒能高0.29 eV。OOH进一步氢化形成过氧化氢的能垒在Pd19/TiO2上为1.51 eV,这是过氧化氢合成的决速步骤。在Pd19O10/TiO2上能垒显著降低至0.90 eV。与未负载的Pd19相比,Pd19/TiO2上H2和O2解离的能垒升高,O2加氢的能垒降低,而OOH加氢的能垒增加,决速步骤发生改变。对于Pd19O10团簇,TiO2载体的负载使得过氧化氢形成过程中各个基元反应步骤的能垒都有所升高,但决速步骤未改变。

表6 Pd19/TiO2和Pd19O10/TiO2基元反应活化能垒Ea和反应能ΔE
在Pd19/TiO2上,过氧化氢的解离能为0.32 eV。H2O2的O—O键断裂,最终形成2个OH吸附在桥位上。在Pd19O10/TiO2上,过氧化氢的脱附能略高于其解离能垒,使得在该团簇上反应产生的过氧化氢脱附的可能性增加。
根据图10(a)所示,在Pd19O10/TiO2上氧气的解离能比Pd19/TiO2上的能垒高了0.11 eV,这意味着在Pd19O10/TiO2上更难发生解离反应。OOH的分解能垒在Pd19/TiO2上为0.24 eV,高于氧化团簇上的能垒。在反应过程中OOH经历了O—O键的断裂,OH和O吸附在顶点位上,终态时OH吸附在中空位而O吸附在桥位上。在Pd19O10/TiO2上,H从桥位扩散到中空位与O形成键,形成的OH稳定地吸附在桥位上,其活化能垒较低,为0.35 eV。与Pd19/TiO2上形成H2O的能垒相比,Pd19O10/TiO2上的能垒较低,为0.66 eV。负载型团簇上的氧气分解能垒增加,在Pd19/TiO2上形成H2O的各个基元反应的能垒增加,而Pd19O10/TiO2上的能垒降低。
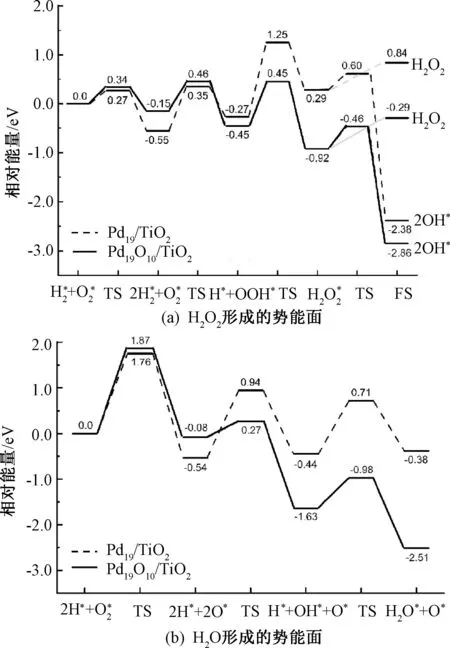
图10 Pd19/TiO2和Pd19O10/TiO2上的势能面
综上所述,与Pd19/TiO2相比,Pd19O10/TiO2在形成H2O2的加氢反应中具有更低的能垒。然而,与Pd19O10相比,将其负载在TiO2上导致了H2O2形成能垒的升高,同时使副反应产物H2O的形成能垒降低,这对过氧化氢的合成并不利。
3 总结
本文使用密度泛函理论计算Pdn/TiO2和(PdO0.5)n/TiO2的吸附性能以及负载型团簇上的反应路径,以研究二氧化钛载体对过氧化氢直接合成反应的影响机理。研究发现,与负载型纯金属团簇相比,负载型氧化团簇在吸附氧上的能力减弱,而经载体负载后的Pd12和Pd19较难被进一步氧化。在负载型钯纳米团簇上,O2的吸附能高于H2的吸附能。与Pdn/TiO2相比,(PdO0.5)n/TiO2对H2O2的吸附能更强。通过对比发现,负载团簇经TiO2负载后对H2和O2的吸附能增强,但对OOH的吸附能减弱,除了Pd12O6以外。在负载型团簇催化剂中,团簇部分氧化会影响基元反应的能垒。在(PdO0.5)n/TiO2上,O2和OOH的分解能垒升高,而O2和OOH的加氢反应的活化能垒降低,导致形成的H2O2较稳定,有利于过氧化氢的合成。与未负载的团簇相比,TiO2负载后的Pd12O6团簇降低了H2解离和两次加氢反应的能垒,同时提高了O2和OOH的分解能垒。然而,当团簇尺寸更大时,TiO2负载后的Pd19O10团簇导致H2O2形成的各基元反应能垒上升,同时H2O的形成能垒下降,不利于过氧化氢的合成。
