基于非粮糖蜜的聚羟基脂肪酸酯发酵培养基优化与中试放大
2024-05-14李舒婷周卫强杨小凡刘海军李方亮
李舒婷,袁 凯,李 华,周卫强,唐 堂,杨小凡,刘海军,李方亮,李 凡,李 义,彭 超*
(1.河南工业大学 粮油食品学院,河南 郑州 450001;2.中粮营养健康研究院有限公司,北京 100029;3.中粮生化能源(榆树)有限公司,吉林 长春 130400;4.吉林中粮生化有限公司,吉林 长春 130033)
全球每年85%的废弃塑料最终被填埋或倾倒到海洋中,塑料[1]、微塑料[2]及其所含有害物质会逐渐出现在食物[3]、饮用水和空气中[4]。聚羟基脂肪酸酯(polyhydroxyalkanoate,PHA)是一类在微生物体内合成的由羟基脂肪酸单体通过酯化聚合得到的生物塑料[5],可以作为生态友好型生物塑料替代石油优质材料[6]。研究者构建微生物细胞工厂,优化底盘菌株的工作效率[7],使PHA的合成效率得到大大提升[8]。目前筛选出耐高盐、高渗透压的嗜盐单胞菌,直接避免无菌操作,极大降低PHA发酵成本及复杂性[5],研究发现中度嗜盐单胞菌(Salinivibriosp.)TGB10发酵获得的PHA达27.36 g/L[9]。卤单胞菌(Halomonassp.)YLGW01菌株发酵合成的PHA高达细胞干质量的95.26%[10],是目前嗜盐单胞菌(Halomonassp.)产PHA最高的菌种。但菌株生产PHA效率低、制备成本高的问题限制着PHA的大规模生产和应用[11]。
PHA的广泛应用受限于其较高的生产成本,有研究表示生产PHA过程中碳源成本占30%~50%[11],而糖蜜是制糖工业的副产品,主要含有大量可发酵糖(主要是蔗糖),是很好的发酵原料,具有丰富的营养物质[12],在食品、医疗[13]、化工[14]和微生物发酵[15]行业具有广阔研究前景,已有研究人员从甘蔗中分离出甘蔗糖蜜和具有生产储存能力的阴沟肠杆菌(Enterobacter cloacae),分批发酵得到PHA最大产量为4.13~4.98 g/L[16]。
目前PHA生产过程中以蔗糖、淀粉、玉米油等生产PHA存在与人争粮的问题,故采用价格低廉的糖蜜为碳源物质制备PHA的研究十分必要。本研究以盐单胞菌(Halomonossp.)TD01为发酵菌株,基于非粮糖蜜原料发酵生产PHA,分析OD600nm值、细胞干质量、PHA含量,并以PHA产量为评价指标,通过单因素试验及响应面试验优化PHA发酵培养基,并在千吨级中试生产线验证,为促进非粮生物基材料生产,优化生产强度具有较强的现实意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种及原料
盐单胞菌(Halomonossp.)TD01:清华大学生命科学学院;糖蜜:中粮糖业辽宁有限公司;玉米浆粉(含氮量6.2%):山东振华生物科技有限公司。
1.1.2 试剂
酵母粉、蛋白胨(均为生化试剂):英国OXOID公司;氯化钠、硫酸镁、尿素、硫酸铵、浓硫酸、苯甲酸(均为分析纯):国药集团化学试剂有限公司;无水甲醇、三氯甲烷(均为色谱纯):美国Honeywell公司。
1.1.3 培养基[17]
LB琼脂培养基:酵母粉0.5 g,蛋白质1.0 g,氯化钠6.0 g,琼脂1.8 g,蒸馏水100 mL,pH调至8.0,在121 ℃灭菌15 min后倒平板。
LB种子摇瓶培养基:酵母粉5 g,蛋白胨10 g,氯化钠60 g,蒸馏水1 L,pH调至8.0;一级种子摇瓶为100 mL锥形瓶分装20 mL培养基;二级摇瓶为2 L锥形瓶分装300 mL培养基,在121 ℃灭菌15 min。
基础发酵培养基:玉米浆粉16.00 g/L,硫酸镁0.21 g/L,尿素2.00g/L,磷酸盐10.00g/L,糖蜜23.6g/L,氯化钠50.00 g/L,蒸馏水900 mL,pH调至8.5。
补料培养基①:硫酸镁0.03 g,尿素2.00 g,磷酸盐0.97 g,玉米浆粉8.33 g,糖蜜73.48 g,蒸馏水15 mL。
1 L发酵体系补料培养基②:尿素1.50 g,玉米浆粉1.94 g,糖蜜73.48 g。
1 L发酵体系补料培养基③:硫酸铵0.84 g,糖蜜104.98 g。1 L发酵体系补料培养基④:糖蜜156.86 g。
2 L和5 kL发酵培养基以及补料培养基按照装液量等比例放大即可。
酯化液:无水甲醇970.00 mL,浓硫酸30.00 mL,苯甲酸1.00 g。
1.2 仪器与设备
BIOSTAT B发酵罐:德国Sartorius公司;FD8-6型冻干机:瑞士METTLER TOLEDO公司;6B-56型智能消解仪:上海锐析仪器设备有限公司;7890B型气相色谱(gas chromatography,GC)检测仪、Agilent HP-5色谱柱(30 m×0.32 mm,0.25 μm):安捷伦科技(中国)有限公司;UV-1750 分光光度计:日本岛津公司。
1.3 方法
1.3.1 菌株的活化及种子液的制备
将保藏于-80℃甘油管的菌株TD01解冻,在LB琼脂培养基上进行划线并置于37 ℃恒温培养24 h,后取平板上单菌落至一级种子进行摇床培养12 h,培养条件为37 ℃、200 r/min。取3 mL一级种子液于二级种子摇瓶中,在37 ℃、200 r/min条件下培养12 h。
1.3.2 发酵罐培养及中试放大
1 L和2 L发酵罐的初始装液量为发酵罐体积的50%,接种量为初始装液量的10%。5 kL发酵罐的初始装液量为发酵体积的60%,接种量为初始装液量的10%。将基础发酵培养基置于发酵罐中,当发酵条件达到37 ℃、pH 8.5、转速达到500 r/min、通气量1 L3/min时开始接种。当溶氧低于20%时开始提高转速以保证溶氧能够维持在20%,直至最高转速1 000 r/min。于8 h开始补料①,调整补料流速为1.5 mL/min,当前一补料结束后接入下一次补料直至OD600nm值连续8 h下降,发酵时间控制在52 h内。
1.3.3 聚羟基脂肪酸酯的制备
将发酵结束后的发酵液以8 000 r/min离心15 min,倒出上清液,加水重悬洗涤10 min后,再次以8 000 r/min离心15 min,弃去上清并冷冻后置于真空冷冻干燥机中-80 ℃干燥48 h即可得到PHA粗品。
1.3.4 发酵培养基优化
(1)单因素试验
不同糖蜜添加量的确定:以菌株生长状况(OD600nm值)和PHA产量为评价指标,以基础发酵培养基为基质,分别设置糖蜜添加量为6 g/L、12 g/L、24 g/L、48 g/L、96 g/L,初始pH值为8.5,每组两个平行,在装液量为100 mL/500 mL基础发酵培养基中,37 ℃、200 r/min条件下摇瓶培养24 h后取样分析。
总氮添加量的确定:以基础发酵培养基中玉米浆粉为氮源,以菌株生长状况(OD600nm值)和PHA产量为评价指标,确定发酵培养基中总氮添加量。玉米浆粉添加量分别为8 g/L、16 g/L、24 g/L、32 g/L、40 g/L、48 g/L,初始pH值为8.5,每组两个平行,在装液量为100 mL/500 mL基础发酵培养基中,37 ℃、200 r/min摇床培养24 h后取样分析。
最佳氮源的确定:以基础发酵培养基为基质,按照总氮添加量一致原则,按总氮添加量为1.98 g/L,分别以玉米浆粉、酵母粉、玉米浆、尿素和硫酸铵作为氮源,以菌株生长状况(OD600nm值)和PHA产量为评价指标,初始pH值为8.5,每组两个平行,在装液量为100 mL/500 mL基础发酵培养基中,37 ℃、200 r/min摇床培养24 h后取样分析。
尿素和硫酸铵配比的确定:在总氮保持1.98 g/L不变情况下,分别考察尿素和硫酸铵的配比分别为3∶1、2∶1、1∶1、1∶2、1∶3对菌株生长状况(OD600nm值)和PHA产量的影响,对照组氮源为玉米浆粉。初始pH值为8.5,每组两个平行,在装液量为100 mL/500 mL基础发酵培养基中,37 ℃、200 r/min摇床培养24 h后取样分析。
(2)响应面试验
根据Box-Behnken的试验设计原理,由单因素试验结果选择糖蜜添加量(A)、尿素添加量(B)、硫酸铵添加量(C)为自变量,以PHA产量(Y)为响应值,设计3因素3水平响应面试验,Box-Behnken试验因素与水平见表1。
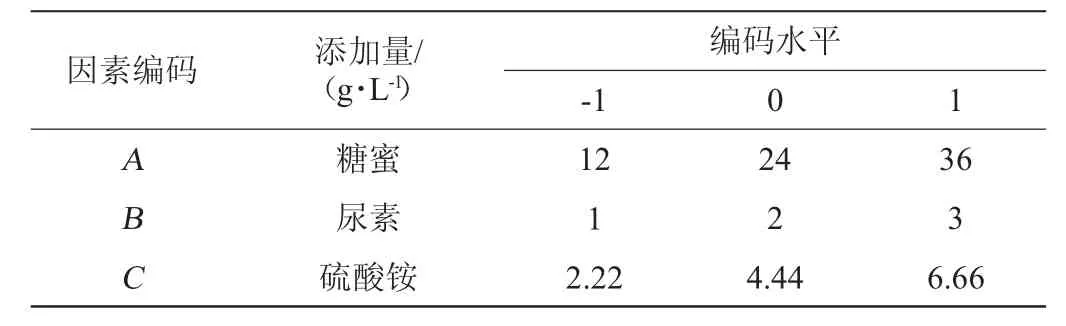
表1 发酵培养基配方优化Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken experiments for fermentation medium formula optimization
1.3.5 优化发酵罐发酵工艺与中试验证
将优化后发酵培养基结果等比例放大应用到1 L发酵罐中装液量为500 mL,接种量10%进行发酵,于8 h左右接补料,当前一补料结束后接入下一补料。根据发酵结果进行优化并将调整后发酵培养基应用于5 kL中试发酵罐进行验证。
1.3.6 分析检测
菌株生长状况(OD600nm值)的测定:取一定体积的发酵样品,在波长为600 nm条件下测定吸光度值,结果乘以稀释倍数即为样品OD600nm值。
菌体干质量的测定:从发酵8 h开始每4 h留取发酵样品35 mL,直至发酵结束,将样品以8 000 r/min离心15 min,倒出上清液,加水重悬洗涤10 min后,再次以8 000 r/min离心15 min,弃去上清并冷冻后置于真空冷冻干燥机中48 h,待样品完全干燥后称取干质量。菌体干质量计算公式如下:
式中:M为菌体干质量,g/L;m2为冻干后样品质量,g;m1,50 mL离心管质量,g;35为样品的体积,mL;1 000为换算系数。
PHA含量的测定采用气相色谱法[18]:将冻干样品碾碎后,称取35 mg于酯化管,每管加2 mL三氯甲烷溶液、2 mL酯化液于酯化管中后置于金属浴中100 ℃加热反应4 h,将酯化管取出降至常温,每管加入1 mL去离子水,振荡15 min后静置分层,取下层液过膜,进行气相色谱检测。气相色谱条件:Agilent HP-5色谱柱(30 m×0.32 mm,0.25 μm);压力69.22 kPa;载气为高纯氮气(N2);流动相流速2 mL/min;柱箱温度开启时80 ℃,维持时间3 min,空气流量400 mL/min;氢气流量30mL/min;柱箱温度350℃;尾吹气流量25mL/min;加热器温度250 ℃;总流量65 mL/min;分流比30∶1;分流流量60 mL/min。
定性定量方法:根据PHA标准品与PHA样品在相同色谱及分析条件下的色谱峰的保留时间进行定性。以PHA标准品的峰面积与内标的峰面积比值(y)作为纵坐标,PHA标准品质量浓度(x)为横坐标绘制PHA标准曲线,得到标准曲线回归方程为y=0.160 2x-0.357 3,按照回归方程计算样品中PHA含量。PHA产量=细胞干质量×PHA含量。
1.3.7 数据处理
采用Origin 2021软件对数据进行分析处理,响应面试验设计采用Design Expert 13.0软件。
2 结果与分析
2.1 发酵培养基优化单因素试验
2.1.1 不同糖蜜添加量对发酵的影响
由图1可知,当糖蜜添加量在6~24 g/L范围内增加,OD600nm值、PHA产量随糖蜜添加量升高而增加;当糖蜜添加量为24 g/L时,菌体OD600nm值、PHA产量达到最高,分别为32.2、2.25 g/L;当糖蜜添加量为24~96 g/L时,菌体OD600nm值、PHA产量有所下降。说明糖蜜的添加可以维持菌体正常生长的营养水平,但糖蜜添加量过多,会导致培养基体系渗透压增大,从而抑制菌体生长[19]。因此,最适糖蜜添加量为24 g/L。
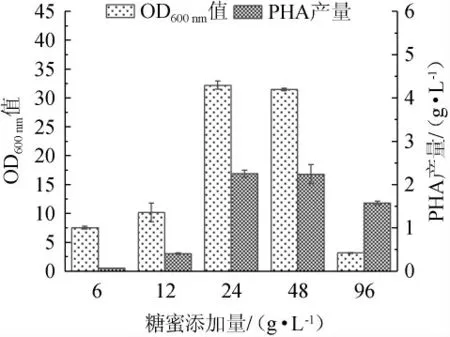
图1 不同糖蜜添加量对菌体生长和聚羟基脂肪酸酯产量的影响Fig. 1 Effects of different molasses addition on bacterial growth and polyhydroxyalkanoate yield
2.1.2 总氮添加量对发酵的影响
以基础发酵培养基中玉米浆粉为氮源,考察总氮添加量对菌株生长状况(OD600nm值)和PHA产量的影响,结果见图2。由图2可知,当玉米浆粉在8~32 g/L范围时,OD600nm值呈阶梯状递增是因为低碳氮比更有利于菌体生物量的提高[20],PHA产量随之增加;玉米浆粉添加量为16 g/L时OD600nm值为34,高于玉米浆粉添加量为8 g/L和24 g/L,说明此时培养基能够维持菌体量的高效生成,但不利于产物的积累,PHA产量较低为1.83 g/L。当玉米浆粉添加量为32 g/L时,PHA产量为2.27 g/L,且OD600nm值较高为33.45;当玉米浆粉添加量在32~48 g/L时,OD600nm值、PHA产量有所降低,原因是过高的碳氮比会因渗透压作用抑制菌体的生长代谢,同时导致PHA合成受阻[21],因此,最适玉米浆粉添加量为32 g/L,即最适总氮添加量为1.98 g/L。

图2 玉米浆粉添加量对菌体生长和聚羟基脂肪酸酯产量的影响Fig. 2 Effects of corn steep powder addition on bacterial growth and polyhydroxyalkanoate yield
2.1.3 不同氮源对发酵的影响
按等氮原则研究不同氮源(玉米浆粉、酵母粉、玉米浆、尿素和硫酸铵)对菌株生长状况(OD600nm值)和PHA产量的影响,其中总氮含量为1.98 g/L,结果见图3。
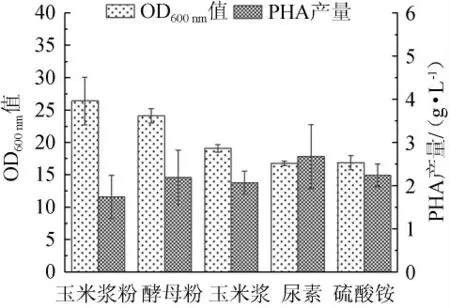
图3 不同氮源对菌体生长和聚羟基脂肪酸酯产量的影响Fig. 3 Effects of different nitrogen sources on bacterial growth and polyhydroxyalkanoate yield
由图3可知,酵母粉、玉米浆、尿素和硫酸铵的PHA产量较高,分别为2.19 g/L、2.07 g/L、2.67 g/L、2.23 g/L,比玉米浆粉组高出25.97%、19.07%、53.58%、28.27%,且酵母粉、玉米浆和尿素3种有机氮源作用下菌体生长较好,说明其更能促进菌体的生长。推测是因为无机氮源更能促进嗜盐单胞菌TD01合成PHA,可能是因为无机氮源可以被菌体直接利用[22],前期能够加速促进生物量的积累,后期氮源不足时,有足够时间将所吸收的碳源转变成聚酯产物[23],推测有机氮源和无机氮源结合更有利于发酵。综合PHA产量判断氮源效果:尿素>硫酸铵>酵母粉>玉米浆粉>玉米浆。因此,故选择尿素、硫酸铵为最适氮源。
2.1.4 不同尿素和硫酸铵配比对发酵的影响
按总氮含量为1.98 g/L研究不同尿素和硫酸铵配比对发酵的影响,结果见图4。由图4可知,当尿素和硫酸铵组合时,OD600nm值和PHA产量较对照组均得到有效提高,说明该组合能够有效促进菌体量积累的同时也能促进次级代谢产物合成,可能是无机氮源硫酸铵的引入提供了前期菌体生长时可直接利用氮源需求。随着硫酸铵比例的降低,OD600nm值和PHA产量均呈现先上升后下降的趋势,当尿素和硫酸铵氮原子添加量为1∶1时OD600nm值和PHA产量均达到最高,分别为34.15和2.48 g/L,比对照组高出29.36%和42.82%,说明有机氮源与无机氮源的等比例添加即尿素和硫酸铵添加量分别为2.00 g/L和4.44 g/L时更有利于PHA的产出。
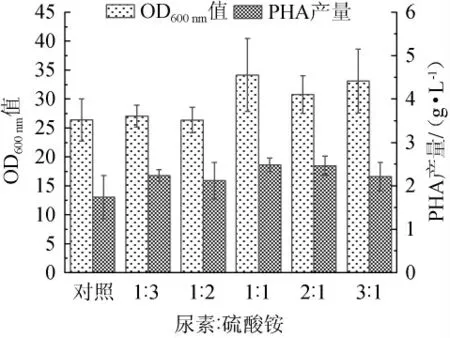
图4 不同尿素与硫酸铵配比对菌体生长和聚羟基脂肪酸酯产量的影响Fig. 4 Effect of different ratios of urea and ammonium sulfate on bacterial growth and polyhydroxyalkanoate yield
2.2 发酵培养基优化响应面试验
2.2.1 响应面试验设计结果及方差分析
根据单因素试验结果,以糖蜜添加量(A)、尿素添加量(B)、硫酸铵添加量(C)为自变量,PHA产量(Y)为响应值,进行Box-Benhken响应面优化发酵培养基,Box-Benhken试验设计及结果见表2,回归模型方差分析结果见表3。
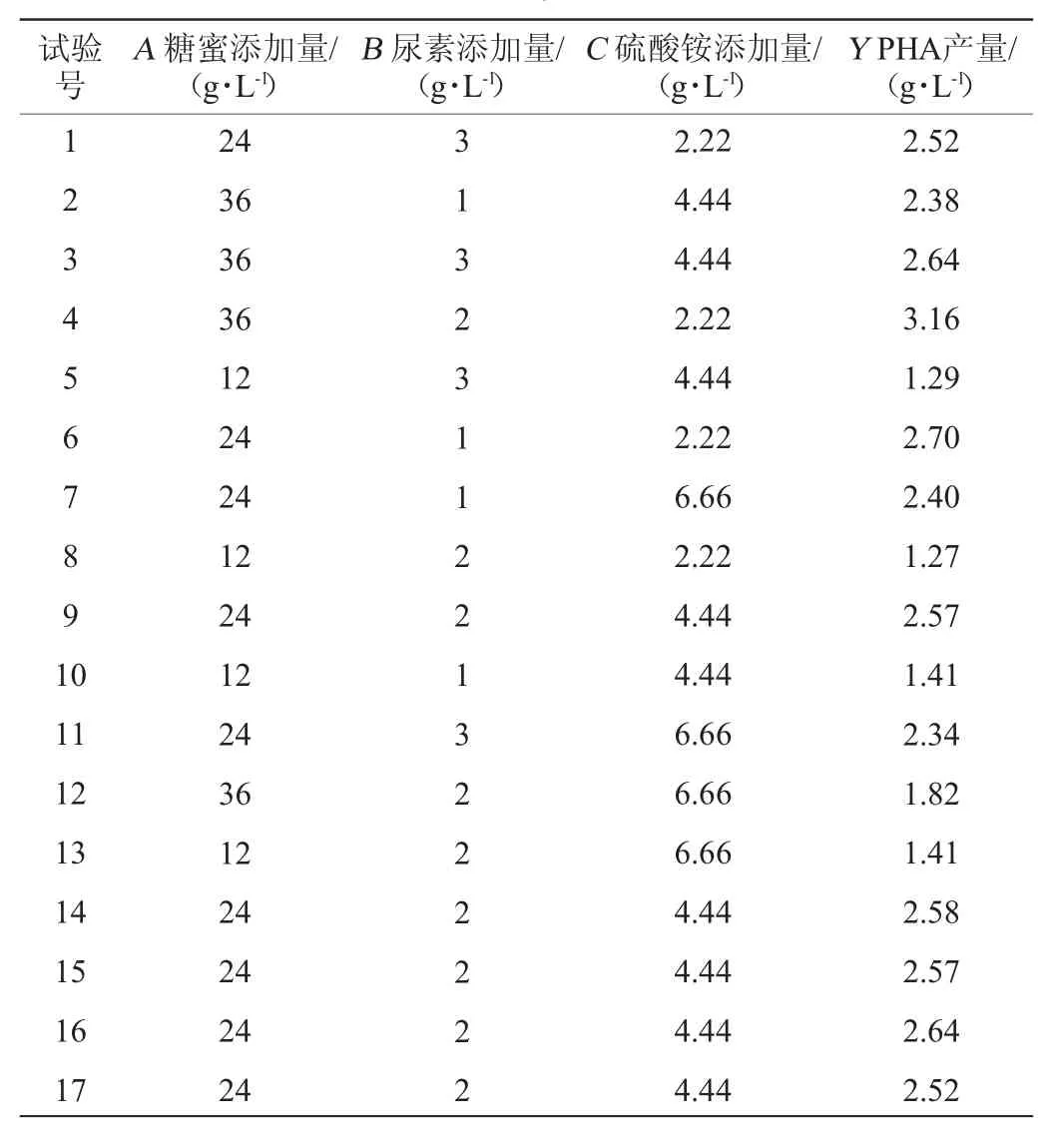
表2 发酵培养基优化Box-Benhken试验设计及结果Table 2 Design and results of Box-Benhken experiments for fermentation medium optimization
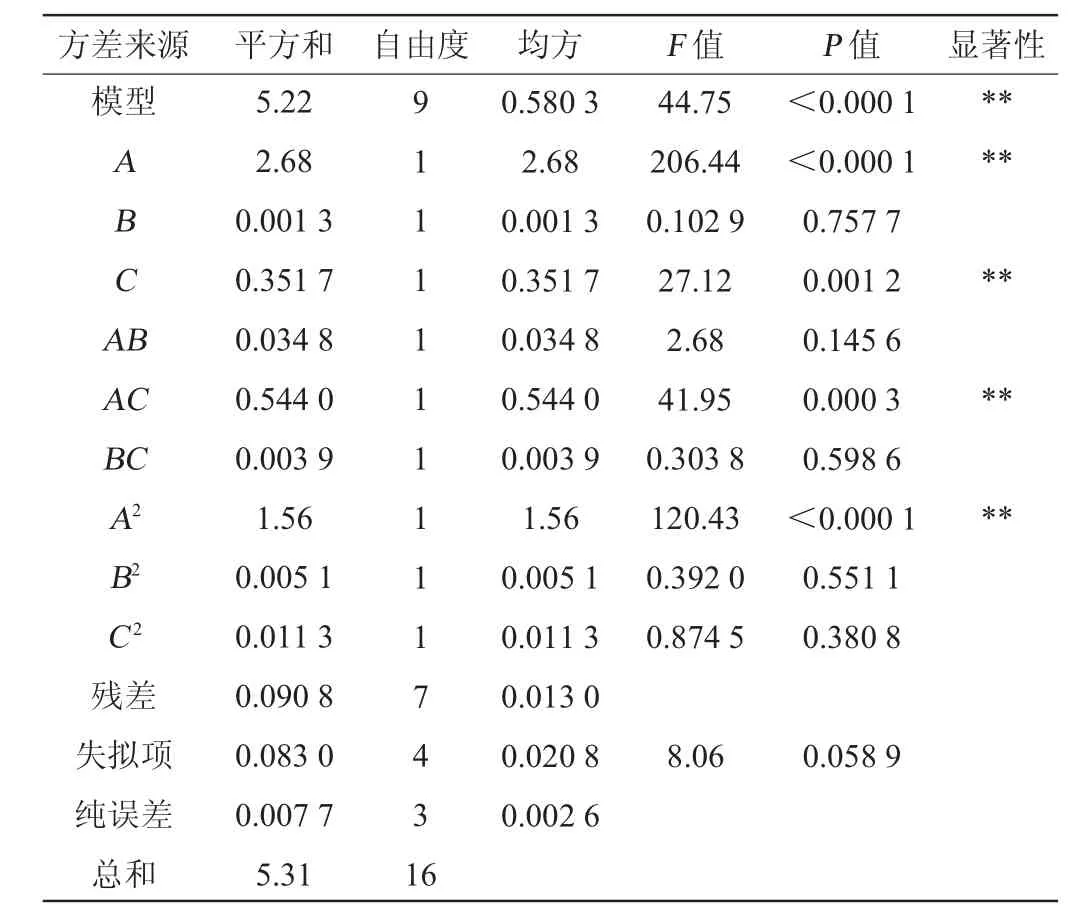
表3 回归模型方差分析Table 3 Variance analysis of regression model
采用Design-Expert 8.0.6软件对表2数据进行二次回归方程拟合,得到二次多项回归方程如下:
Y=2.57+0.578 4A-0.0129B-0.209 7C+0.093 2AB-0.368 8AC+0.031 4BC-0.609 0A2-0.034 7B2-0.051 9C2
由表3中的P值可知,该回归方程P<0.000 1,说明该模型极显著;失拟项P=0.058 9>0.05,说明失拟项不显著,方程回归模型拟合真实水平,选择合理。F值为44.75、决定系数R2=0.982 9、调整决定系数R2Adj=0.961 0,说明该回归模型拟合程度较好,能用于本试验预测分析。该模型的精密度为21.6920>4,进一步说明模型合理。由P值可知,一次项A、C与二次项A2以及交互项AC对PHA产量的影响极显著(P<0.01),一次项B、交互项AB、BC以及二次项B2、C2对PHA产量影响不显著(P>0.05)。由F值可知,影响PHA产量的因素顺序为A(糖蜜添加量)>C(硫酸铵添加量)>B(尿素添加量)。
2.2.2 响应面分析
应用Design-Expert 8.0.6软件对数据进行处理和分析,得到了各个影响因素的交互作用对PHA产量的响应面及等高线见图5。响应面坡度越陡,其等高线越接近椭圆,说明这两个因素交互作用对结果影响越显著,反之,若响应面坡度越小等高线越接近圆形,则表示两个因素交互作用对结果影响不显著。

图5 尿素添加量、糖蜜添加量、硫酸铵添加量交互作用对聚羟基脂肪酸酯产量影响的响应面及等高线Fig. 5 Response surface plots and contour lines of effects of interaction of urea addition,molasses addition and ammonium sulfate addition on polyhydroxyalkanoate yield
由图5(a)可知,PHA产量随糖蜜和尿素添加量增高而增大,二者交互作用对结果影响响应面坡度较缓,表明这两个因素对结果影响不显著。由图5(b)可知,PHA产量随硫酸铵和糖蜜添加量增高而增大,二者交互作用对结果影响响应面坡度较陡,等高线呈椭圆形,表明这两个因素对结果影响显著(P<0.05)。由图5(c)可知,PHA产量随硫酸铵和尿素添加量增高而增大,二者交互作用对结果影响响应面坡度平缓,表明这两个因素对结果影响不显著。这与表3方差分析结果一致。
2.3 响应面试验结果的验证试验
通过Design-Expert 8.0.6软件对试验数据进行优化预测,得到最佳发酵培养基配方为糖蜜添加量33.191 g/L、尿素添加量2.467 g/L、硫酸铵添加量2.22 g/L。在该优化条件下PHA产量的预测值为3.107 g/L。为了便于实际操作,将发酵培养基配方修正为糖蜜添加量33.2 g/L、尿素添加量2.5 g/L、硫酸铵添加量2.2 g/L。在此优化条件下进行3次摇瓶平行验证试验,得到PHA平均产量实际值为(3.12±1.19)g/L,与响应面预测值比较相对误差为0.418%,证明该模型合理可行。
2.4 培养基优化结果发酵罐发酵工艺与中试放大
因反应器的发酵混合传质和供氧能力,需进一步验证比较1 L发酵罐采用优化培养基的发酵效果。以基础发酵培养基为对照,将上述摇瓶发酵培养基优化结果应用于1 L发酵罐,发酵过程中菌体生长及聚羟基脂肪酸酯的变化情况见图6。

图6 优化前(a)、后(b)1L生物反应器下菌体生长及聚羟基脂肪酸酯产量的变化Fig. 6 Changes of microbial growth and polyhydroxyalkanoate yield in 1 L bioreactor before (a) and after (b) optimization
由图6a可知,发酵44 h时,其最高OD600nm值、细胞干质量、PHA含量、PHA产量分别为184、55.20 g/L、50.40%、27.82g/L。由图6b可知,发酵52h时,其最高细胞干质量82g/L、PHA含量68.79%,总产量56.41 g/L。较优化前PHA产量提高了90.32%。优化前后对比结果发现,发酵16 h前PHA含量几乎相同,细胞干质量于发酵16 h时相差16.4 g/L,可能是无机氮更易于被菌体吸收,有助于生物量的积累。优化后细胞干质量在24 h后几乎停滞增长,推测菌体代谢过快,补料不足以维持其正常代谢导致营养不均衡,菌体开始利用所吸收的碳源合成PHA[20]。
根据发酵20~32 h的发酵情况加倍糖氮添加量,得到补料优化后2 L生物反应器下发酵过程中菌体生长及聚羟基脂肪酸酯产量的变化情况见图7。通过2 L生物反应器放大反应,于发酵48 h得到菌体干质量92.5 g/L、PHA含量72.82%,总PHA产量达到67.36 g/L,较优化前PHA产量增长了142.13%。发酵20 h后,细胞干质量与PHA含量有明显增长,证明上述推测20 h因缺营养物质导致菌体生长停滞结论正确[24]。加倍糖氮补料后营养物质充足,有利于生物量的增长使菌体干质量持续上涨的同时不利于胞内PHA的积累致使PHA含量于37 h后保持平稳[25],但PHA含量仍然比未加倍糖氮补料时高出5.86%,PHA产量高出19.41%。可能是因为氮源充足有利于菌体的生长繁殖,当菌体大量积累时,即使氮添加量充足也会积累少量PHA[25-26]。证明过高或过低的糖氮添加量都会抑制发酵的进行[27-28],也许有机氮源被吸收慢能保持培养基中持续含氮更有利于生物量增长[29],无机氮源更有利于PHA含量的积累[30]。

图7 补料优化后2 L生物反应器下菌体生长及聚羟基脂肪酸酯产量的变化Fig. 7 Changes of microbial growth and polyhydroxyalkanoate yield in 2 L bioreactor after feeding optimization
为验证优化结果应用于工业化规模的可行性,进行盐单胞菌(Halomonossp.)TD01的5 kL中试验证实验,发酵过程监测曲线见图8,发酵过程中菌体生长及聚羟基脂肪酸酯的变化情况见图9。由图8和图9可知,在发酵温度和速度保持稳定状态下,发酵22 h加碱量保持平稳,发酵10~16.5 h时耗糖量不断增大,菌体正在进行大量积累。发酵22.5 h切换补料后pH和溶氧迅速上涨且从发酵22.5~28.0 h内OD600nm值保持平稳,28.0 h加大糖氮补料补充后pH和溶氧稳定到正常范围,且细胞干质量、PHA含量长势趋于平缓,证明氮源供应量不足以菌体消耗所致,发酵22.5~28 h营养缺乏在一定程度上抑制菌体活力,此时PHA含量生长较为平缓。发酵42.5 h开始OD600nm值保持平稳但仍在消耗糖和碱,推测是PHA仍在积累,并于50.5 h发酵结束,OD600nm值为250,细胞干质量为81.67 g/L,PHA含量为62.65%,总PHA产量为51.16 g/L。结果表明,5 kL中试发酵试验得到发酵50.5 h时总PHA产量为51.16 g/L,较起始发酵PHA产量高83.90%。
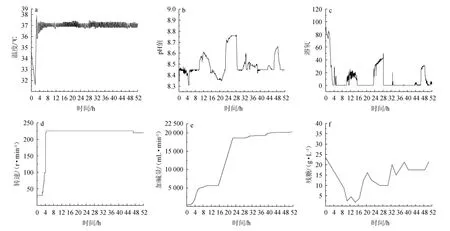
图8 中试放大发酵过程监测曲线Fig. 8 Monitoring curves of pilot scale-up fermentation process

图9 5 kL中试放大试验菌体生长及聚羟基脂肪酸酯产量的变化Fig. 9 Changes of microbial growth and polyhydroxyalkanoate yield in 5 kL bioreactor pilot test
3 结论
通过响应面优化试验,得到最佳发酵培养基配方为糖蜜添加量33.2 g/L、尿素添加量2.5 g/L、硫酸铵添加量2.2 g/L。在此优化条件下,PHA产量为3.12 g/L。采用2 L发酵罐进行发酵对补料培养基进行优化并控制补料后进行发酵试验得到总产量达到67.36 g/L,较优化前产量增长了142.13%。5 kL中试放大发酵试验得到发酵50.5 h总PHA产量为51.16 g/L,较起始发酵PHA产量高83.90%。结果表明,该工艺优化可以大幅度提升PHA产量,可直接应用到工业化生产。该工艺优化结果有效提升了PHA产量,优化生产强度,大幅降低单位产品的生产成本,为工业化生产提供了可靠条件。
