酿酒酵母发酵白芨产水溶性多糖工艺优化及抗氧化活性研究
2024-05-14高志贤张财顺
高 超,刘 姝*,高志贤,张 磊,张财顺
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
白芨(Bulbophyllum albicana)为兰科(Orchidaceae)白芨属(Bulbophyllum)植物,又名白给、及草[1],拥有1 000多年的药用历史[2-3],具有收敛止血、清除湿热、消肿生肌等药理作用[4]。多糖是中药白芨的主要活性成分,具有抗氧化[5]、抗肿瘤[6]、抗菌[7]、调节免疫力[8]、抗炎[9]、降血糖[10]、降血脂[11]等生理功能。广泛应用在保健食品、医药、化妆品等领域。当前,白芨多糖的提取方法较多主要包括物理法[12]与化学法[13],利用上述两种方法提取多糖会一定程度破坏多糖的生物活性,因此选择有效的提取方法提高活性产物的收率是开发利用白芨多糖的关键[14]。
近些年,随着生物学与生物工程学的发展,微生物发酵在中药生物转化研究领域有大量的应用,中药经过微生物发酵后,能够更好的发挥中药的药效[15]。酵母菌是常用的发酵剂,其生长过程中可以产生淀粉酶和蛋白酶等多种酶系,能够水解中药中的淀粉与蛋白质,从而为其生长提供氮源与碳源;同时酵母菌能够生成纤维素酶等代谢产物,破坏细胞壁,使有效成分得以溶出[16]。李暄[17]利用酿酒酵母菌和枯草芽孢杆菌复合发酵麸皮,其体外抗氧化活性显著增高。陈秉彦等[18]利用酿酒酵母菌与乳酸杆菌混合发酵龙须菜,其多糖的抗氧化能力显著增加。刘艳芳等[19]利用酿酒酵母发酵灵芝,发酵后的灵芝多糖分子质量显著降低,免疫活性显著提高。然而,酿酒酵母发酵白芨制备多糖目前尚鲜见报导,因此有必要对其进行研究。
本研究以耐高温酿酒酵母发酵白芨制备水溶性多糖。以多糖含量为评价标准,采用单因素试验与响应面优化试验,优化最佳的发酵工艺条件,并与水提法进行对比,考察发酵法提取的水溶性糖的抗氧化能力。旨在为未来以白芨为原料生产或开发功能性产品奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
耐高温酿酒酵母菌(Saccharomyces cerevisiae):安琪酵母股份有限公司;白芨(自然晾干,粉碎,过250目筛):市售。
1.1.2 试剂
无水乙醇(分析纯):天津富宇精细化工有限公司;浓硫酸(分析纯):沈阳化学试剂厂;乙酸乙酯(分析纯);江苏强盛功能化学股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析纯):福州飞净生物科技有限公司;蒽酮(分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
722S紫外可见光分光光度计:上海菁华科技仪器有限公司;ASCENDTM400型核磁共振波谱仪:德国Bruker(布鲁克)公司;LDZX-50KBS高压蒸汽灭菌器:上海申安医疗器械厂;JA5003N分析天平:上海精密仪器科技有限公司;HZQ-C空气浴振荡器:哈尔滨东明医疗仪器厂;Spectrum GX傅立叶红外光谱仪:美国Perkin-Elmer公司。
1.3 方法
1.3.1 白芨水溶性多糖的制备
耐高温酵母菌培养液的制备:称取5 g YEPD培养基粉末,加入100 mL超纯水溶解,加入0.4 g菌种(干种)耐高温酿酒酵母菌,在温度为35 ℃,摇床转速为120 r/min的条件下培养1 d,测得其活化菌种浓度为1.06×108CFU/mL,备用。
发酵组多糖的制备[16,20]:称取2 g白芨粉末,加入100 mL超纯水,接种10%的菌种培养液,设定温度为38 ℃,初始pH值为5.5,摇床转速为120 r/min的条件下,培养24 h。取50 mL白芨发酵液,3 000 r/min离心30 min,取发酵上清液40 mL,置于-20 ℃的冰箱中冷冻1 d,然后放入冷冻干燥机的干燥箱中,冷冻干燥4 d,得到发酵组水溶性多糖冻干粉末。
水提组多糖的制备[20]:称取2 g白芨粉末,加入100 mL超纯水,不接菌,设定温度为38 ℃,初始pH值为5.5,摇床转速为120 r/min的条件下,培养24 h,取50 mL水提液,3 000 r/min离心30 min,取水提上清液40 mL,置于-20 ℃的冰箱中冷冻1 d,然后放入冷冻干燥机的干燥箱中,冷冻干燥4 d,得到水提对照组水溶性多糖冻干粉末。
1.3.2 分析检测
(1)发酵液中的酵母菌细胞数测定
参照文献[21]的方法,取0.1 mL的发酵液稀释100倍,滴加在血球计数板上,用显微镜观察计数。
(2)白芨发酵液中水溶性多糖含量的测定
参照文献[22]的方法,配制0.2 mg/mL的葡萄糖标准溶液。分别准确移取0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL葡萄糖标准溶液,各试管加入纯净水补至2 mL。加入0.5 mL乙酸乙酯、0.01 g蒽酮、5.0 mL浓硫酸反应10 min,以2.0 mL的纯净水同等操作为空白对照,用紫外分光光度计,测定波长620 nm条件下的吸光度值。以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得到标准曲线回归方程:y=0.061x+0.042,相关性系数R2=0.996 3。取10.0 mL白芨发酵液,3 000 r/min离心30 min,取2 mL上清液,依据标准曲线回归方程,计算出白芨发酵产水溶性多糖含量。
(3)红外光谱分析
取1 mg发酵组水溶性多糖冻干粉末与100 mg溴化钾固体混合,然后将混合物进行充分研磨,压片。利用红外光谱仪在波数范围为400~4 000 cm-1,进行扫描[23]。
(4)水溶性多糖对DPPH自由基清除能力测定
参照文献[24]的方法,并稍作改进。量取DPPH粉末1 mg溶于20 mL体积分数95%的乙醇中,超声5 min,配制0.5 mmol/L的DPPH测试液。取DPPH溶液2.0 mL加入试管中,加入体积分数95%的乙醇2.0 mL。避光静置30 min后,在波长517 nm处测定吸光度值A0。发酵组和水提对照组冻干上清液后获得的水溶性多糖对DPPH自由基清除能力的测定:首先称取一定质量水溶性多糖冻干粉配制成0、1 mg/mL、2 mg/mL、3 mg/mL、4 mg/mL的样品液,然后向试管中加入1 mL不同质量浓度的水溶性多糖溶液,最后依次加入2.0 mL0.5 mmol/L的DPPH溶液与1.0 mL体积分数95%的乙醇,避光静置30 min后,在波长517 nm处测定吸光度值A。DPPH自由基清除率公式如下:
式中:A0为没加样品反应体系的吸光度值;A为加入待测样品反应体系的吸光度值。
(5)核磁共振碳谱分析
采用ASCENTM400核磁共振波谱仪,对多糖进行核磁共振碳谱分析(13C NMR分析),采用氘代二甲基亚砜(dimethyl sulfoxide,DMSO)为溶剂,化学位移相对于内标物DMSO化学位移值低场百万分数来确定。脉冲宽度为10 μs,采样时间3.27 s,采样次数64次,延迟时间10 s。
1.3.3 耐高温酵母菌发酵白芨工艺优化
(1)单因素试验
以料液比1∶50(g∶mL),接种量为10%,发酵时间24 h,发酵温度为30 ℃,摇床转速为120 r/min,初始pH值为5.5为基础,依次考察培养条件:接种量(5%、10%、15%、20%)、发酵时间(12 h、24 h、36 h、48 h、60 h)、发酵温度(30 ℃、32.5℃、35 ℃、37.5 ℃、40 ℃)、摇床转速(100 r/min、120 r/min、140 r/min、160 r/min、180 r/min)和初始pH值(4.0、4.5、5.0、5.5、6.0)对多糖含量和酵母菌细胞数的影响。
(2)响应面优化试验
在单因素试验的基础上,采用响应面法优化发酵工艺条件,应用Box-Behnken试验设计,以发酵温度(A)、摇床转速(B)、初始pH值(C)3个因素为自变量,多糖含量(Y)为响应值,进行3因素3水平的响应面优化试验。响应面试验因素与水平见表1。

表1 白芨发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for Bletilla striata fermentation conditions optimization
1.3.4 数据处理
每组试验进行3次平行试验,试验数据通过Microsoft Excel 2019、Design-Expert 13.0、采用Orgin2022进行作图。
2 结果与分析
2.1 单因素试验结果
2.1.1 接种量的确定
改变接种量,考察不同接种量对水溶性多糖含量和耐高温酵母菌细胞数的影响,结果见图1。

图1 接种量对多糖含量及酵母菌细胞数的影响Fig. 1 Effect of inoculum on the polysaccharides contents and number of yeast cells
由图1可知,多糖含量随着接种量的升高,呈现先上升后下降的趋势。当接种量为10%时,多糖含量达到最高值,为1.29 mg/mL。出现这种情况原因可能是:接种量在5%~10%之间时,细胞数增长适宜,有利于次级代谢产物多糖的产生。当接种量>10%时,细胞数目增长太快,会促进初级代谢产物的产生,抑制次级代谢产物多糖的产生,导致酵母菌细胞数目增多,多糖含量下降。因此,选择最佳接种量为10%。
2.1.2 发酵时间的确定
酵母菌的生长过程,主要包括延滞期、对数期、稳定期、衰亡期四个阶段[25]。不同发酵时间目标产物的产量会有所不同,因此改变发酵时间,考察不同发酵时间对水溶性多糖含量和耐高温酵母菌细胞数的影响,结果见图2。
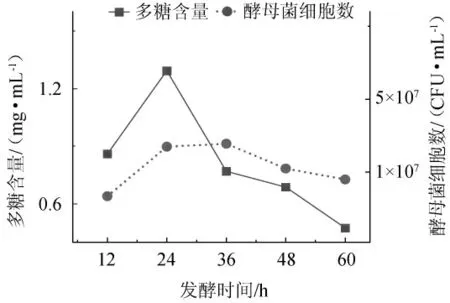
图2 发酵时间对多糖含量及酵母菌细胞数的影响Fig. 2 Effect of fermentation time on the polysaccharides contents and number of yeast cells
由图2可知,耐高温酵母菌发酵12~24 h为对数生长期,24~36 h为稳定期,36~60 h为衰亡期。对数生长期的末期即发酵时间为24 h,多糖产量最高,为1.29 mg/mL。24 h之后,多糖产量逐步降低。出现这种原因可能是发酵处于对数生长期阶段营养充足,利于产物的积累,所以多糖产量显著升高,随着发酵时间的延长,培养基内的营养物质消耗殆尽,多糖产量下降,菌种代谢活力下降。因此,选择最佳发酵时间为24 h。
2.1.3 发酵温度的确定
适宜的温度是保证菌种正常生理活动的前提,温度偏低,酶活性达不到最佳的催化效果[26]。温度偏高,酶活与酶量降低,导致目标产物产量降低。因此改变发酵温度,考察不同发酵温度对水溶性多糖含量和耐高温酵母菌细胞数的影响,结果见图3。
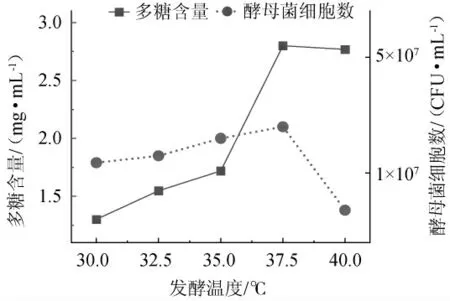
图3 发酵温度对多糖含量及酵母菌细胞数的影响Fig. 3 Effect of fermentation temperature on the polysaccharides contents and number of yeast cells
由图3可知,在30~37.5 ℃温度区间之内,酵母菌产酶活性与产酶量逐渐升高,当温度达到37.5 ℃时,此温度下的酶量与酶活都达到最高,目标产物多糖与酵母菌细胞数均达到最高值,分别是2.80 mg/mL和3.5×107CFU/mL。温度高于37.5 ℃时,酶活力均下降,导致多糖产量降低。因此,选择最佳发酵温度为37.5 ℃。
2.1.4 摇床转速的确定
改变摇床转速,考察不同摇床转速对水溶性多糖含量和耐高温酵母菌细胞数的影响,结果见图4。
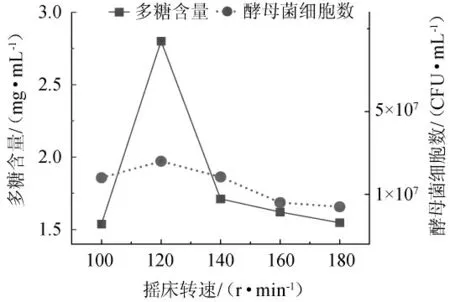
图4 摇床转速对多糖含量及酵母菌细胞数的影响Fig. 4 Effect of shaker speed on the polysaccharides contents and number of yeast cells
由图4可知,在摇床转速100~120 r/min范围内,多糖含量与酵母菌细胞数随着摇床转速升高而升高;当摇床转速达到120 r/min时,目标产物多糖与酵母菌细胞数均达到最高值,分别是2.80 mg/mL和3.5×107CFU/mL。当摇床转速超过120 r/min后,多糖含量与酵母菌细胞数明显降低,可能是由于摇床转速过高,导致剪切力过高,细胞破碎,产生泡沫,从而降低溶氧量,影响菌体生长。因此,选择最佳摇床转速为120 r/min。
2.1.5 初始pH的确定
pH不仅影响细胞膜的通透性,还会影响酶的活性以及菌种的正常生理代谢活动,是影响菌种的生长与产物合成的重要因素。因此改变基础培养基的初始pH值,考察初始pH值对水溶性多糖含量和耐高温酵母菌细胞数的影响,结果见图5。
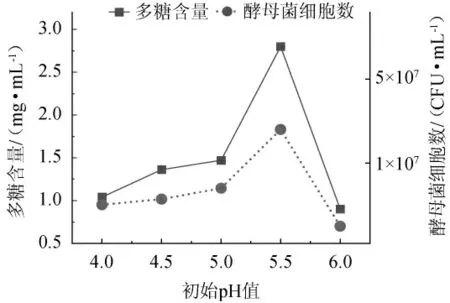
图5 初始pH值对多糖含量及酵母菌细胞数的影响Fig. 5 Effect of pH on the polysaccharide content and number of yeast cells
由图5可知,初始pH值在4.0~5.5之间,多糖含量与酵母菌细胞数随着pH值的升高而升高;当初始pH值为5.5时,多糖产量与酵母菌细胞数达到最大值,分别为2.80 mg/mL和3.5×107CFU/mL;初始pH值>5.5时多糖产量与酵母菌细胞数明显降低。出现这种情况的原因可能是耐高温酵母菌最适合的生长pH值为5.0~5.5,初始pH值超过5.5不适合酵母菌生长,酶活性与酶量均快速下降,导致多糖产量降低。因此,选择最佳初始pH值为5.5。
2.2 响应面试验结果
2.2.1 Box-Behnken试验设计以及结果
在单因素分析的基础上,应用SPSS 25.0软件进行多元线性回归分析,计算5个因素的标准化回归系数,即标准化回归系数越大,对多糖产量影响越大。标准化分析结果表明,发酵温度(A)、摇床转速(B)、初始pH值(C)对多糖产量影响程度较大,因此选择这3个因素为自变量,以水溶性多糖的含量(Y)为响应值进行试验。试验结果见表2,方差分析见表3。
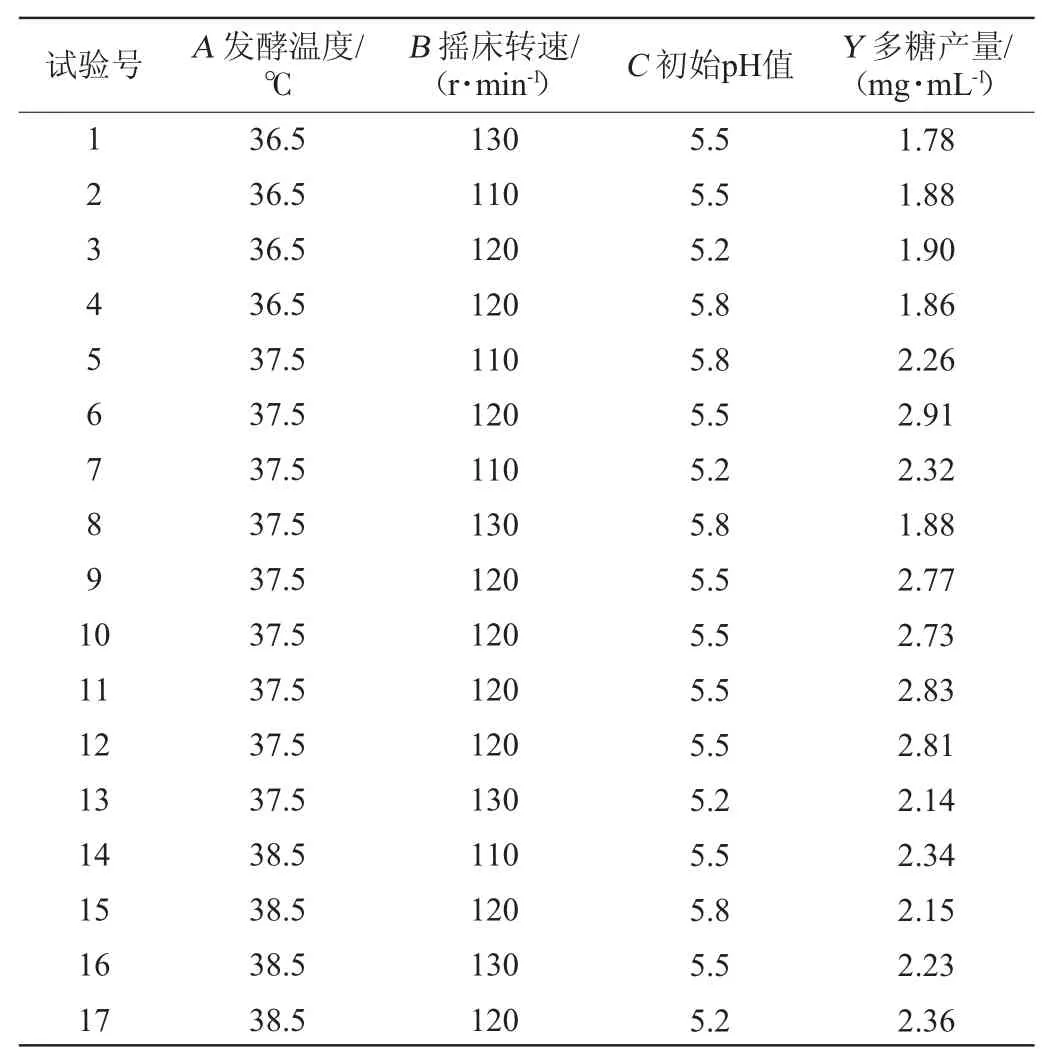
表2 白芨发酵条件优化Box-Behnken试验设计与结果Table 2 Design and results of Box-Behnken experiments for Bletilla striata fermentation conditions optimization
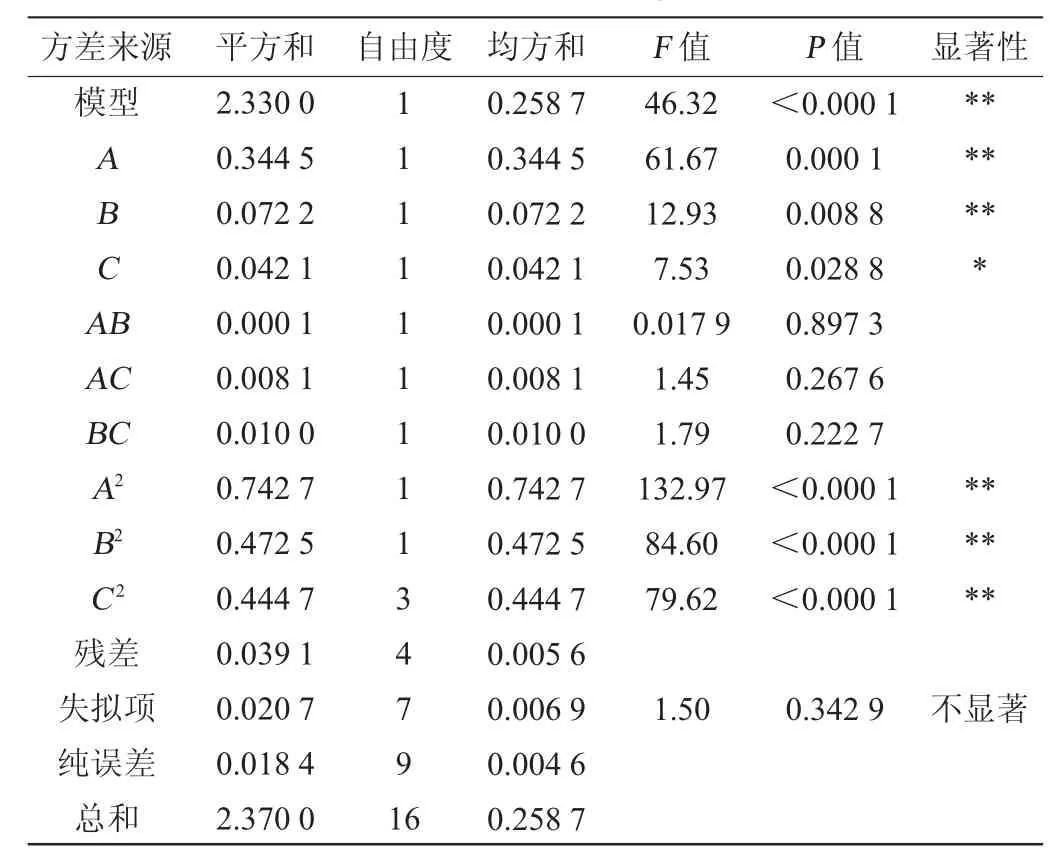
表3 回归模型方差分析Table 3 Variance analysis of regression model
将表2中的试验数据采用Design-Expert 13.0软件进行多元回归拟合分析,得到回归模型方程为:Y=0.281+0.207 5A-0.095 0B-0.072 5C-0.005 0AB-0.045 0AC-0.050 0BC-0.420 0A2-0.335 0B2-0.325 0C2。
由表3可知,该模型P<0.000 1,说明该模型极显著,失拟项P>0.05,不显著,说明该模型拟和程度好[27],能够充分解释多糖含量的变化。决定系数R2=0.983 5,说明98.35%的多糖含量变化可以用回归模型方程来解释。调整决定系数R2Adj>0.9,也表示了该回归模型相关性高,拟合程度好。变异系数(coefficient of variation,CV)描述试验的可信度以及精确度。CV系数越小,可信度越高、精确度越好,该试验的变异系数CV为3.18%(CV<10%表明实验具有弱变异性),说明实验结果真实可靠。综上所述,该模型可以很好的预测水溶性多糖产量。
由F值可知,发酵温度(A)、摇床转速(B)、初始pH值(C)三个因素对多糖产量影响程度由大到小次序为A>B>C。由P值可知,发酵温度(A)、摇床转速(B)对多糖产量影响极显著(P<0.01)。初始pH(C)对多糖产量影响显著(P<0.05)。交互项AB、AC、BC对多糖产量影响均不显著(P>0.05)。二次项A2、B2、C2对结果影响极显著(P<0.01)。
2.2.2 响应面分析
响应面坡面陡峭程度反应两个因素交互作用的强弱以及多糖含量的影响程度,响应面坡面越陡,两个因素交互作用越强。等高线反应各因素之间交互作用的强弱,等高线是椭圆,表示两因素之间交互作用强;等高线是圆形,表明两因素之间交互作用弱。各因素交互作用对多糖含量影响的曲面图以及等高线见图6。
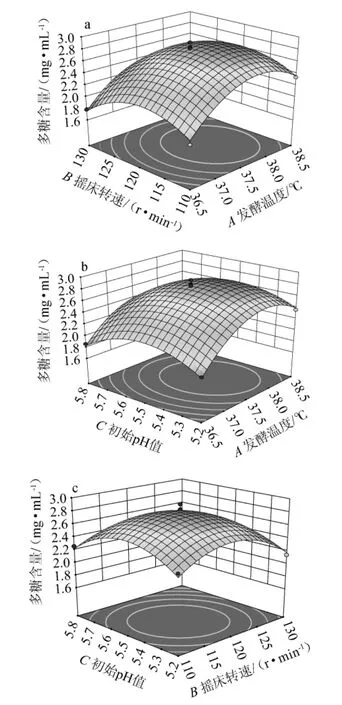
图6 各因素之间交互作用对多糖含量影响的响应曲面与等高线Fig. 6 Response surface plots and contour lines of effects of interaction between each factors on polysaccharide content
由图6可知,所有曲面呈凸面,开口向下,说明最大值覆盖在响应面范围之内。由图6a可知,发酵温度与摇床转速的曲面坡度较为平缓,等高线为圆形,说明发酵温度与摇床转速之间的交互作用弱,对多糖产量的影响程度低。由图6c可知,摇床转速与初始pH值的曲面坡度较为陡峭,说明交互项BC相较于交互项AB、AC交互作用强,对多糖产量影响程度较高。因此,交互作用强弱依次为:BC>AC>AB,但交互作用对结果影响均不显著,这与方差分析结果一致。
2.3 验证试验结果
根据回归模型得出最佳发酵工艺条件预测结果为:发酵温度37.8 ℃、转速119 r/min、初始pH值5.45,在此条件下多糖含量预测值为2.847 mg/mL。为方便试验实际操作,对发酵工艺参数进行了修正,白芨2 g,超纯水100 mL,接种量为10%,发酵时间为24 h,发酵温度为38 ℃、初始pH值为5.5、转速为120 r/min。重复试验3次,此条件下得到多糖的平均实际值为2.80 mg/mL。与预测值比较,相对误差为1.7%,证明该模型预测多糖产量的可靠性与准确性。
2.4 提取物红外光谱特征
对提取物进行红外光谱测定,结果见图7。由图7可知,在波数3 390 cm-1处出现强吸收峰,归属于-OH伸缩振动;在波数2 950 cm-1与1 450 cm-1处存在吸收峰,归属于-CH2伸缩振动峰;在波数1 650 cm-1处存在吸收峰,归属于羰基的伸缩振动峰。在1 512 cm-1处出现吸收峰,说明样品中存在蛋白质[28];波数在1 000~1 200 cm-1范围内存在吸收峰,说明了C-OH键的存在;波数在715 cm-1处存在吸收振动峰,说明分子中存在4个或者4个以上-CH2。本实验发酵组的提取物IR谱图特征与胡楠楠等[20,29]描述多糖的特征峰基本一致,说明发酵组提取物中存在多糖类物质。
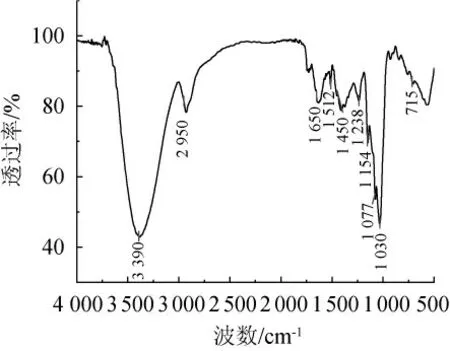
图7 多糖提取物红外光谱测定结果Fig. 7 Determination results of infrared spectrum of polysaccharides extracts
2.5 水溶性多糖抗氧化能力分析
将发酵组和水提对照组上层清液冻干后得到的水溶性多糖粉末,配制成不同质量浓度的多糖溶液,测定其DPPH自由基清除率,结果见图8。
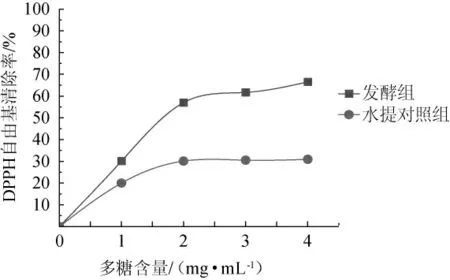
图8 水溶性多糖的DPPH自由基清除率测定结果Fig. 8 Determination results of DPPH free radical scavenging rates of water-soluble polysaccharides
由图8可知,水溶性多糖对DPPH自由基清除能力存在浓度依赖关系,在多糖含量1~2 mg/mL范围内,DPPH自由基清除率随质量浓度的增加而增大,在多糖含量3~4 mg/mL范围内,DPPH自由基清除率随着多糖质量浓度的升高基本保持不变。水提对照组最大DPPH自由基清除率为30.9%,发酵组的最大DPPH自由基清除率为66.5%,发酵组是对照组的2.15倍,说明发酵后抗氧化能力提高。通过核磁共振碳谱(13C NMR)分析发酵组与水提对照组的水溶性多糖对DPPH自由基清除率存在差异的原因,结果见图9。

图9 发酵组(A)及水提对照组(B)水溶性多糖13C NMR分析Fig. 9 13C NMR analysis of water-soluble polysaccharides in fermentation group (A) and water extraction group (B)
由图9A与图9B对比可知,发酵组A水溶性多糖的化学位移在150~210 ppm之间出现明显的吸收峰,而水提对照组B水溶性多糖未出现吸收峰,说明二组的水溶性多糖结构不同,进而导致对DPPH自由基清除率存在明显差异。
3 结论
本研究采用单因素试验与响应面优化试验,以多糖含量为评价指标,对耐高温酿酒酵母菌发酵白芨的工艺条件进行优化,最佳发酵工艺条件为:接种量10%、摇床转速120 r/min、发酵温度38 ℃、初始pH值为5.5、发酵时间24 h。该优化条件下,得到的水溶性多糖含量为2.80 mg/mL,与响应面预测值相近,说明该响应面模型能够很好的预测多糖产量。对提取物进行红外光谱分析,结果表明其红外光谱图具有糖类物质特征吸收峰。抗氧化能力分析结果表明,优化后发酵多糖对DPPH自由基清除率最高为66.5%,具有一定的抗氧化活性。后续研究可以对多糖进行纯化及单糖组分分析。
