铜蓝蛋白用于糖尿病视网膜病变诊断的临床价值
2024-05-14肇莉莉马为梅
肇莉莉,喻 磊,王 萍,马为梅
陕西省西安市人民医院/西安市第四医院眼科,陕西西安 710004
氧化损伤是糖尿病视网膜病变(DR)病因学中的一个关键因素[1]。高糖状态通过各种机制产生的活性氧(ROS)往往会破坏重要的生物分子,如DNA、蛋白质和脂膜,从而破坏细胞的正常生理状态[2]。值得注意的是,视网膜极易受到氧化应激的损害。增生性DR(PDR)和/或糖尿病性黄斑水肿的发展可导致DR患者的视力损害,目前已经开发出多种方法以量化氧化应激状态。在其他疾病中,铜蓝蛋白(CP)被认为是氧化应激的标志物之一,一方面可促进铁与转铁蛋白结合;另一方面可抑制超氧物诱导的脂质过氧化机制[3]。而糖尿病患者CP水平升高可能是对循环中未结合的Fe2+增加的一种保护性反应,这将成为自由基进一步诱导脂质过氧化的催化剂[4-5]。因此,本研究旨在分析CP水平与DR进展的关系,其可能作为诊断糖尿病或DR的标志物,从而有助于改善其管理和患者预后。现将结果报道如下。
1 资料与方法
1.1一般资料 对2016年1月至2020年12月在陕西省西安市人民医院眼科治疗的196例2型糖尿病(T2DM)患者进行了一项前瞻性、观察性、基于医院病例的对照研究,其中男57例、女139例,年龄40~89岁、平均(71.21±9.80)岁。另外按3∶1比例选择年龄和性别匹配的70例无糖尿病患者作为对照组,其中男17例、女53例,年龄41~87岁、平均(69.57±9.35)岁。纳入标准:T2DM患者符合《中国2型糖尿病防治指南(2013年版)》[6]和/或《糖尿病视网膜病变防治专家共识》[7]中T2DM的诊断标准;具有完整的病史记录。排除标准:存在可能影响血清CP水平的情况,如肾病、妊娠、口服避孕药、铜中毒、缺锌、类风湿性关节炎或任何急性或慢性炎症性疾病等;合并糖尿病肾病患者、其他系统性急性或慢性炎症性疾病患者;除DR之外的视网膜病变;近3个月内接受糖皮质激素类药物或玻璃体腔注射抗内皮生长因子药物治疗。所有研究对象均知晓本研究,并签署书面知情同意书。本研究经陕西省西安市人民医院医学伦理委员会批准。本研究方案均按照相关指南和规定进行操作。
1.2眼科检查 所有T2DM患者均接受了完整的眼科检查,包括裸眼视力(UCVA)、最佳矫正视力(BCVA)测量(经LogMAR转换后进行统计)、对角膜、前房、晶状体和前玻璃体采用裂隙灯生物显微镜检查。扩张眼底检查采用直接检眼镜、90 D透镜裂隙灯生物显微镜和间接检眼镜(如需要)。眼压(IOP)测量采用Goldman压平眼压计。所有DR患者均进行光学相干断层扫描(OCT)和荧光素眼底血管造影(FFA)。根据眼科检查结果,将T2DM患者分为单纯T2DM患者(DM组)和DR患者(DR组)。根据眼底镜检和血管造影及国际临床DR严重程度分级标准[8]进行视网膜病变严重程度分级,将DR患者分为轻度及中度非增生性DR(NPDR)86例和重度NPDR及PDR 32例,DR严重程度分级包括:(1)无视网膜病变(无异常);(2)NPDR。轻度NPDR(仅有微血管瘤)、中度NPDR(有微血管瘤,但严重程度较低)、重度NPDR(视网膜内4个象限各有20个以上出血、2个以上象限有明确的静脉串珠、1个以上象限出现严重微血管异常,出现以上任意一条即可判定);(3)PDR。新生血管、玻璃体/视网膜前出血,出现以上任意一条或多条即可判定。
1.3血清及房水标本检测 入组时收集所有参与者的血液标本,抽取静脉血,将标本置于冰上并在1h内离心(3 500×g,4 ℃条件下离心15 min),将上清液储存在—20 ℃环境中直至分析。所有DR患者房水标本采用角膜缘内1 mm前房穿刺,采集未稀释的房水标本0.15~0.20 mL,特别注意避免血液污染,标本立即冷却并储存在—70 ℃环境中。(1)房水及血清CP测定分别采用Somani法和Ambade法。0.5 mmol/L色原溶液(Reagent-1)制备:将159.65 mg诺氟沙星溶解于含0.2% Triton X-100的乙酸盐缓冲液(0.45 mol/L,pH值为5.4)中。2.04 mmol/L底物溶液(Reagent-2)制备:320.00 mg二硫苏糖醇(DTT)和800.00 mg硫酸亚铁铵依次溶解在1 000.00 mL蒸馏水中。Reagent-1和Reagent-2在4 ℃和室温下均能稳定6个月以上。6.0 mmol/L标准品制备:将2.896 g十二水合硫酸铁(Ⅲ)铵溶于1 000 mL(0.2 mmol/L)乙酸中。50 μL标本加入1 000 μL Reagent-1中混匀。间隔1 min后,加入150 μL Reagent-2。将混合液加入Shimadzu CL-750分光光度计,测定波长377 nm。空白校正:用蒸馏水代替房水及血清标本进行空白校正。(2)房水超氧化物歧化酶(SOD)、丙二醛(MDA)水平采用酶联免疫吸附试验(ELISA)进行测定。

2 结 果
2.13组受试者临床资料比较 经眼科检查,有78例患者纳入DM组,118例患者纳入DR组。3组受试者的年龄、体质量指数(BMI)、糖尿病病程、合并高血压患者例数、UCVA、LogMAR、眼轴长度、糖化血红蛋白、高密度脂蛋白胆固醇、尿素氮、肌酐、血清CP水平及他汀药物使用史患者比例比较,差异均有统计学意义(P<0.05),且DR组血清CP水平显著高于对照组和DM组(P<0.001)。见表1。

表1 3组受试者临床资料比较或n(%)或M(P25,P75)]
2.2DR患者血清CP与房水CP水平、MDA、SOD水平的相关性 Pearson相关性分析结果显示,DR患者血清CP水平与房水CP及MDA水平均呈正相关(r=0.620,P<0.001;r=0.198,P=0.001),与房水SOD水平呈负相关(r=—0.196,P=0.001)。见图1。

注:A为血清CP水平与房水CP水平的相关性;B为血清CP水平与房水MDA水平的相关性;C为血清CP水平与房水SOD水平的相关性。
2.3多因素Logistic回归分析影响T2DM发生DR的影响因素 将T2DM患者是否发生DR(T2DM=0,DR=1)或DR患者是否进展为重度NPDR/PDR(轻中度NPDR=0,重度NPDR/PDR=1)作为因变量进行赋值,经多因素Logistic回归分析,结果显示,血清CP水平为T2DM患者发生DR或者DR患者进展至重度NPDR/PDR的独立预测因子(P<0.05)。见表2、表3。
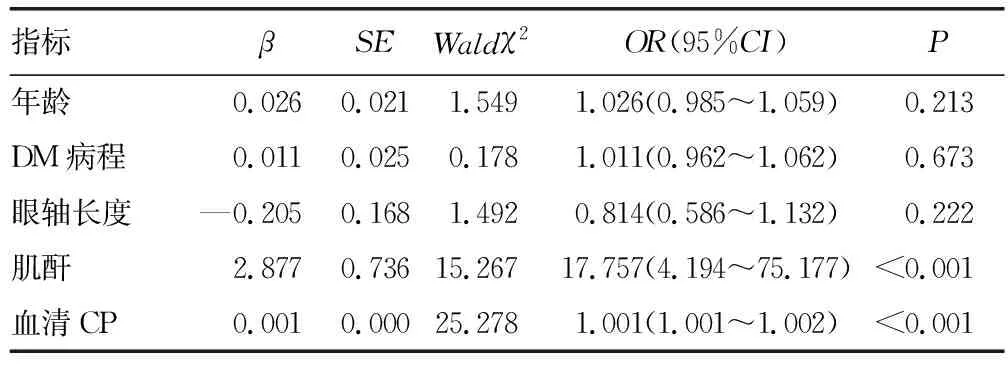
表2 多因素Logistic回归分析影响T2DM发生DR的临床因素
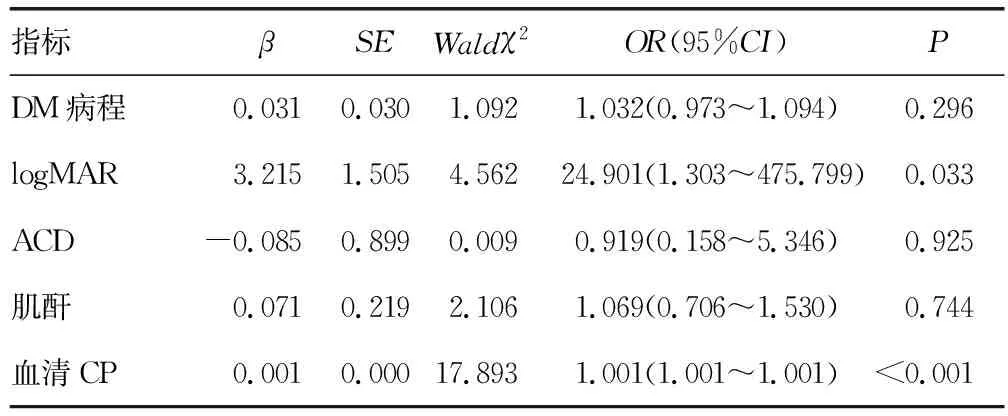
表3 多因素Logistic回归分析影响T2DM进展为重度NPDR/PDR的临床因素
2.4血清CP水平对DR的诊断效能分析 ROC曲线结果显示,血清CP诊断T2DM患者的曲线下面积(AUC)为0.672(95%CI:0.586~0.758),灵敏度和特异度分别为42.3%、87.1%,见图2A。血清CP水平诊断T2DM患者发生DR的AUC为0.833(95%CI:0.776~0.889),灵敏度和特异度分别为74.6%、82.1%,见图2B;血清CP诊断NPDR早期的AUC为0.777(95%CI:0.705~0.848),灵敏度及特异度分别为73.3%、75.6%,见图2C;血清CP诊断重度NPDR的AUC为0.890(95%CI:0.827~0.953),灵敏度和特异度分别为75.0%、89.5%,见图2D。
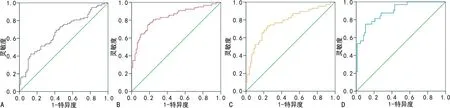
注:A为糖尿病患者的AUC;B为DR患者的AUC;C为轻中度NPDR患者的AUC;D为重度NPDR患者的AUC。
3 讨 论
DR的发病机制复杂,主要病理变化包括异常血管增殖引起的眼内环境变化,导致视网膜组织缺氧缺血性损伤[1]。本研究中对照组、DM组及DR组患者的血清CP水平依次升高,提示CP可能与DR疾病发生、发展相关。
糖尿病是一种氧化应激增加的状态,而氧化应激也是DR发病的关键环节。高血糖引起的局部缺血和某些血管活性化学物质(包括血管内皮生长因子)释放,这些化学物质会激发玻璃体腔后壁上的视网膜表面形成新生血管。但这些新生血管非常脆弱且极易破裂,当玻璃体开始收缩时,会导致视网膜剥离和视力下降。同时缺血状态下产生的ROS通过各种机制破坏DNA、蛋白质和脂质膜等重要生物分子,破坏细胞的正常生理功能,视网膜非常容易受到氧化应激的损害[9-11]。临床认为研究氧化应激标志物在血清、玻璃体、房水等中的动态变化和相关关系,对DR疾病控制、监测其进展有重要意义[12-14]。本研究结果显示房水CP、SOD及MDA与血清CP水平均存在相关性(P<0.05),SOD是主要的抗氧化酶,SOD催化超氧自由基歧化,生成分子氧或过氧化氢[10]。MDA则为研究最多的脂质氧化最终产物[13]。该结果提示血清CP水平可反映眼内氧化应激标志物的变化。
CP是一种含铜的α2球蛋白,其主要在肝脏中合成,然后分泌进入循环,到达其他组织和器官。CP作为一种铁氧化物酶,可以促进Fe2+/Cu1+向Fe3+/Cu2+的转化,其参与人体内许多重要的生理活动,在维持机体铜与铁等微量元素的平衡方面起着重要的作用。此外,CP也被认为是一种非特异性急性时相蛋白,在发生感染、炎症、糖尿病和创伤时表达增加[15-16]。CP已被发现在心血管疾病中存在差异表达,如顾伟等[17]发现血清CP水平可能参与高血压并射血分数保留的心力衰竭的发生、发展,并分析其原因可能与CP通过铜转运过程而发挥血管新生及抗氧化等作用有关。同时,有研究发现CP水平升高与糖尿病肾病的进展呈正相关,其在氧化应激增加的情况下发挥促氧化剂的作用,虽然CP由于其铁氧化酶活性而具有抗氧化特性,但ROS生成的增加破坏了CP与铜的结合,进而诱导ROS的形成和LDL氧化[18]。同样,在本研究中随着DR的进展,血清CP水平逐渐升高,与SATYANARAYANA等[8]的研究结论相符。此外,本研究还发现,血清CP水平诊断T2DM患者是否发生DR以及诊断轻度及中度NPDR与重度NPDR及PDR均有良好效能。
综上所述,血清CP水平在DR患者中呈异常高表达,且随着DR病变严重程度的增加而升高,表明CP作为促氧化剂,可参与调节机体的氧化应激反应,从而影响DR的发生/发展。此外血清CP高水平是T2DM患者发生DR或DR进展的独立预测因子,检测血清CP水平有助于DR的诊断或反映疾病进展程度。