问题情境教学法在高中化学课堂中的实践教学
——以“金属材料的腐蚀与防护”为例
2024-05-13田向农
文| 田向农
本文以高中化学“金属材料的腐蚀与防护”为例,阐述基于问题情境的高中化学教学设计与实践。
一、教学内容
“金属材料的腐蚀与防护”章节介绍了金属电化学腐蚀的相关内容,通过本章节的学习能够帮助学生加深对金属腐蚀现象的了解,并且学会运用化学知识来解决生活中的问题或解释生活中的现象。在学习本章节之前,学生已经了解了金属腐蚀的一些必要条件,以及原电池、电解池的形成原理和金属的还原性与活泼性等知识点。本章节教学利用贴近实际生活的情境引导学生从生活的角度分析问题,激发学生的学习兴趣,强化学生对概念知识的理解。
二、教学目标
1.了解常见的金属腐蚀及其危害性,掌握金属腐蚀现象的本质以及类型。
2.利用物质反应原理的学习过程解决实际问题,认识到金属腐蚀的类型、条件、原理等,并且学会电极反应式与总反应式的书面表达。
3.利用合作探究、问题讨论等方式,以辩证的角度认识金属腐蚀,并从科学技术与人类社会发展间的关系这一角度分析金属防护的重要意义,培养学生的环保意识。
三、教学实施
(一)问题情境的设计与导入
在学习本课前,学生对金属的腐蚀有一定了解,如生活中就见过金属腐蚀后的形态,根据初中化学的学习也掌握了铁腐蚀的化学方程式和原理。因此,在问题情境的设计上,选择贴近学生生活认知和既有知识展开:“从一开始的暖水袋,到如今的电暖宝,人们为了取暖生发了各种奇思妙想,这些物美价廉的产品为我们带来了很多生活上的便利。小莹也买了一个电暖宝。在使用一段时间后,细心的她发现了电暖宝在充电的时候会逐渐膨胀,就好像里面充了气一样。耐不住心里的疑惑,她打算将暖宝拆开看一看。这一看不要紧,里面都是脏脏的液体,着实把她吓了一大跳。于是小莹将电暖宝里面的脏水都倒了出来,重新换上了干净的自来水,这一幕刚巧被妈妈看到。她及时制止并告知小莹这样做十分危险。这让小莹很疑惑。你知道电暖宝的发热原理吗?里面倒出来的脏脏的液体究竟是什么?为什么换成干净的自来水不行而且会很危险?相信这些问题是不少学生曾经有过的。教师可为学生展示提前准备好的电暖宝包装,让学生观察包装并找到电暖宝的成分表,根据成分表来探究问题的答案。
(二)情境探究与讨论
上述问题情境提供了一个探究电暖宝成分以及发热原理的话题,其本质则是金属的腐蚀。之后让学生根据问题情境,以小组为单位设计一个化学实验方案,以此来探究问题。学生根据电暖宝包装中的说明书能够了解到,电暖宝的成分包含水、铁粉、活性炭、食盐、蛭石、吸水性树脂。其中,水和铁粉是导致液体脏的主要原因,同时也是电暖宝发热的基本原理,但其中也出现了一个陌生的材料——蛭石。教师需要为学生讲解蛭石是一种硅酸盐,一般用作保温材料。这也能了解到电暖宝的发热原理为,铁粉与水和氧气发生反应,化学方程式为2Fe+O2+2H2O===2Fe(OH)2。而且这是一个放热的过程,即在反应过程中逐渐释放出热量,并且反应过程中会形成原电池,加速放热反应。之后引导学生针对化学方程式2Fe+O2+2H2O=2Fe(OH)2进行发热原理的验证与总结。学生以小组为单位进行实验的设想。首先引导学生思考:电暖宝在充电和使用的时候,什么时候开始放热的?化学反应物可能是哪些物质?学生经过讨论可以得出,铁被氧气氧化,或被水中的氢离子氧化,二者都有可能。根据学生的猜想和实验设计方案可以了解到,电暖宝中的铁粉、水、盐等物质组成了一个原电池,可以在通电后快速加热。教师引导学生根据这一结论设计一个实验探究的方案,如图1 所示。
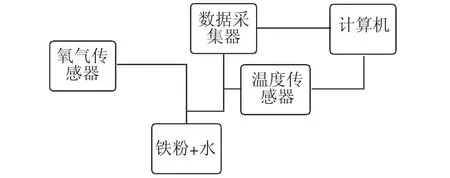
图1
之后可以提出问题,在电暖宝加热过程中,正极有氧气参与,那么正极的产物是什么?如何去验证呢?在实验设计中,Fe(OH)2是一种白色物质,但在与水、氧气等发生反应后则会生成红褐色的Fe(OH)3或Fe2O3。之后为学生解释,结合X 射线衍射法对腐蚀产物进行的分析发现,腐蚀产物也就是红褐色附着物为Fe2O3,而根据电暖宝使用时放热的过程来看,Fe(OH)3脱水后会形成Fe2O3·xH2O。学生在这一过程中就可以观察到有铁锈生成。
(三)认知模型构建
在了解电暖宝发热与金属腐蚀之间的联系后,还要建立探究物质反应原理的认知模型,分析原电池的反应过程,启发学生正确看待金属腐蚀过程中的得与失,引导学生从宏观想象到微观观察等多个角度分析问题。如提出主题:通过模型来解释钢铁在海水中的腐蚀原因。钢铁的主要成分是一种铁碳合金,而铁和碳在与海水接触时,会与海水中的氯化钠等元素构成原电池,从而导致铁的腐蚀分解。之后继续引导学生,如果在电解质溶液中加入酸或碱,此时的电极反应又如何?教师根据这一问题带领学生分析金属腐蚀的本质。在这一过程中,吸氧和析氢腐蚀是钢铁腐蚀的主要原理。一般情况下,这两种腐蚀情况会相伴而生,但大多是其中一种为主。自然环境具有一定的复杂性,这对于金属来说也常面临着不同类型的腐蚀,但金属腐蚀过程中是否就一定形成原电池,这也是需要重点探究的问题。根据这一问题引导学生从化学腐蚀的定义和电化学腐蚀两个角度展开类比分析。经过讨论,学生能了解到,化学腐蚀是金属与氧化物质直接接触而产生,电化学腐蚀则是不纯金属和电解质溶液、氧化剂接触时形成,前者不会产生电流,而后者则会产生微弱电流,反应速率也有所不同,化学腐蚀较小,电化学腐蚀速率更大。此外,化学腐蚀的结果只是金属被氧化,而电化学腐蚀的情况下,不纯金属中较活泼的金属会被氧化。需要强调,自然界中其实多数金属都是不纯的,因此,电化学腐蚀是金属腐蚀的主要形式,其本质与化学腐蚀相同,主要的区别便是反应速率不同。
(四)合作探究
根据上述的学习过程,学生基本掌握了电化学腐蚀和化学腐蚀的区别,也了解了金属腐蚀的原理与过程。之后,教师可以从概念认知过渡到实验探究,带领学生动手操作,以实践的方式检验新知。首先,引出实验的目的“根据刚刚的学习我们能了解到,钢铁的腐蚀是钢铁与空气中的氧气、水蒸气等发生化学反应而导致,那空气中的水和氧气是如何使钢铁生锈的呢?”借此带领学生进行金属电化学腐蚀的实验探究,创设问题情境:钢铁制品一般是含碳的铁合金,在干燥的环境下长时间都不会生锈,但如果在湿度较大的环境下存放则很容易生锈变红。那钢铁生锈的原因是什么呢?电化学腐蚀的原理又是什么呢?实验需要提前准备好铁粉、碳粉、水、稀盐酸、盐以及试管等材料和工具。先将铁粉中加入少量的碳粉,混合搅拌后撒入内壁用稀盐酸与氯化钠润湿过的两个试管中,并分别标记。学生根据金属电化学腐蚀的原理以及设计好的实验方案进行动手实践,在混合并加入铁粉和碳粉的导管加入几滴红墨水,观察试管中水柱的变化以及其他现象。学生思考:导管中水柱变化说明了什么现象?铁粉中加入碳粉有什么作用?学生通过观察能够得出结论:导管中水柱的液面升高表示试管中的气体被消耗,压强降低所导致,而液面降低则表示试管中有气体生成,压强增大,碳粉是正极,和铁粉形成原电池,可以加快金属的电化学腐蚀。最后可以让学生根据原电池原理以及实验过程,写出电极反应式以及电池反应的化学方程式。
(五)案例分析
教师借助案例设计真实问题情境,让学生在情境中探讨电化学腐蚀带来的危害以及腐蚀保护的必要性,从宏观的角度出发,探讨化学与生产和生活的关系,学会如何从客观的角度分析利害。如“全世界每年由于金属腐蚀造成的直接损失约占各国国内生产总值的2%~4%,因此,金属的防护至关重要,对此你有什么启发和建议吗?”学生在思考问题时,教师需要引导学生从辩证的角度出发,这也是认识问题、解决问题的基本思路。即教师需要引导学生从经济的角度出发,结合化学知识和金属腐蚀的原因试着思考如何防止或延缓金属的腐蚀过程。有的学生表示可以对金属表面喷漆,隔绝金属与氧气及氧化物的接触,就能避免金属腐蚀。还有的学生表示可以制作合金。也有的学生想到将金属作为原电池的副极或电解池的阴极,提出了一个新的思路。之后可以为学生科普阴极保护法。该方法是电化学保护法中的一种,可以细分为牺牲阳极保护法、外加电流保护法两种,通过外加直流电源等方式对金属进行保护。从腐蚀保护的角度来看,基本思路有四种,分别为覆盖保护层、改变组成结构、电化学防护、改善腐蚀环境等,其中覆盖保护层可以将被保护金属与腐蚀性介质进行技术性隔离,可以选择金属保护层或非金属保护层,如聚乙烯、聚氨酯等;改变组成结构就是加入合金元素,提高金属的耐腐蚀性,减缓金属的腐蚀速度,如可以在钢铁中加入镍,制作成不锈钢;电化学防护是上述的两种阴极保护法;改善腐蚀环境也能减少金属腐蚀的损失,如降低腐蚀介质的浓度、去除介质中的氧、控制环境温湿度等,也可以采用缓蚀剂来防止金属腐蚀。金属腐蚀的防护方法如图2 所示。

图2
(六)拓展练习
在掌握电化学腐蚀的原因与保护后,可以通过拓展习题帮助学生巩固知识点,实现知识学习的学以致用。
1.下列叙述不正确的是()
A.金属的电化学腐蚀相较于化学腐蚀更普遍
B.钢铁在干燥的环境下不容易被腐蚀
C.铝制铆钉铆接铁板的情况下,铁板更容易被腐蚀
D.通过牺牲锌块的方式能够对船只进行腐蚀保护
2.当钢铁出现吸氧腐蚀时,正极部分的电极反应式为()
A.Fe2++2e-===Fe
B.2H++2e-===H2↑
C.Fe3++e-===Fe2+
D.2H2O+O2+4e-===4OH-
3.将金属A 和金属B 分别放入稀硫酸中,同时生成了氢气,而将两个金属相连,再投入稀硫酸中,发现金属A 被腐蚀,金属B 未被腐蚀,关于这一现象叙述正确的是()
A.金属A 的活动性>金属B 的活动性
B.金属A 的还原性<金属B 的还原性
C.在第二次投入稀硫酸中时,金属A 产生了还原反应,金属B 则发生氧化反应
D.金属B 的表面产生气泡,金属A 表面无明显气泡产生
四、教学反思
本节课通过问题情境的设计带领学生分析生活中的金属腐蚀问题,并根据这一思路探究电化学腐蚀与化学腐蚀的区别,通过情境探究、合作讨论、动手实验、案例分析等方式培养学生的合作意识以及辩证思维,提高学生解决实际问题的能力,建立物质反应原理的思维模型。在教学实践中,教师应坚持知识教学与价值观引领并行的理念,在带领学生探索金属腐蚀的原理与化学知识时,也要从金属腐蚀保护的角度分析化学与人类生产和生活之间的关系,培养学生科学探究的精神以及环境保护的意识。
