基于经食管超声心动图及经胸右心声学造影的模型预测卵圆孔未闭相关脑卒中风险的临床价值
2024-05-11廖依依荣亚妮高云华徐亚丽
许 敏 廖依依 左 浩 李 春 荣亚妮 管 雪 余 璞 高云华 徐亚丽
卵圆孔未闭(patent foramen ovale,PFO)指位于房间隔前上部的原发隔与继发隔在出生后未粘连融合[1]。成人中约25%存在PFO[2]。PFO 所致右向左分流(right-to-left shunt,RLS)可成为反常栓塞的通路,进而引发脑卒中[3]。既往研究[4-5]表明PFO 与不明原因脑卒中存在相关性,尤其在55 岁以下的患者中,PFO 与缺血性脑卒中显著相关。反常性栓塞风险(risk of paradoxical embolism,RoPE)评分可以评估缺血性脑卒中与PFO 相关的可能性[6-7],RoPE 评分>6 分可定义为PFO 相关脑卒中[8-9]。经食管超声心动图(transesophageal echocardiography,TEE)能详尽地评估PFO 相关解剖,但在评估PFO 的潜在分流方面仍有局限[10];经胸右心声学造影(contrast transthoracic echocardiography,cTTE)能敏感地识别PFO 有无RLS并进行分级[1]。本研究应用TEE 和cTTE 全面规范化评估PFO 的解剖及分流特征,基于二者构建PFO 相关脑卒中风险预测模型并探讨其预测效能,旨在为临床决策提供可靠的影像学依据。
资料与方法
一、研究对象
选取2020 年12 月至2022 年8 月我院经TEE 联合cTTE确诊为PFO合并RLS的中青年患者105例,男50例,女55 例,年龄18~55 岁,中位年龄41(31,48)岁。根据是否合并缺血性脑卒中分为卒中组47 例(包含4 例腔隙性脑梗死)和非卒中组58 例。卒中组纳入标准:①临床经颅脑MRI 或CT 诊断为缺血性脑卒中;②本次缺血性脑卒中不能用其他原因解释;③RoPE评分>6 分。卒中组排除标准:①超声心动图、CT 或MRI检查发现主动脉及颈部大动脉出现高危粥样硬化斑块;②心电图、TTE 或TEE 提示心源性栓塞高风险,如心房颤动、冠心病、心内血栓、瓣膜赘生物等;③其他引起缺血性脑卒中的原因,如动脉夹层、血管炎、烟雾病等。非卒中组纳入标准:①临床经MRI或CT检查脑实质未见缺血性脑卒中改变;②未合并严重心、肺疾病及其他重大疾病。本研究经我院医学伦理委员会批准(批准号:2020-研第143-01),所有研究对象均签署知情同意书。
二、仪器与方法
1.TEE 检查:使用GE Vivid E95 彩色多普勒超声诊断仪,6VT-D 经食管探头,频率4~8 MHz。患者取左侧卧位,采用盐酸利多卡因胶浆对咽喉部进行局部麻醉,连接心电图,嘱患者口含牙垫,经牙垫将探头轻柔插至食管中段(深度30~40 cm),常规扫查大动脉短轴切面(50°~70°)、腔静脉双房切面(90°~120°),连续全面观察房间隔处有无PFO 及其解剖特征;CDFI观察PFO 的分流情况,并分别于静息状态及Valsalva动作下采集各切面动态图像并储存于仪器中。实施Valsalva 动作时,检查者按压患者腹部,同时嘱其吸气鼓腹对抗,维持10 s 后快速收腹吐气[11];若释放瞬间观察到原发隔向左房侧移动,表明Valsalva 动作实施有效[1]。通过回放图像,观察是否合并希阿里氏网(Chiari network,CN)或下腔静脉瓣(eustachian valve,EV)、房间隔瘤(atrial septal aneurysm,ASA),测量房间隔活动度、PFO 通道长度、PFO 与下腔静脉角度,以及Valsalva 动作下PFO 左房侧开口径、右房侧开口径[10,12]。见图1。ASA 定义为原发隔从房间隔平面向左或右房偏移>10 mm,或左右偏移之和>15 mm[11]。以上操作均由2 名具有5 年以上TEE 操作经验的心脏超声医师共同完成,所有图像均严格按照相关指南及共识规范采集,所有参数均重复测量3次取平均值。

图1 TEE评估PFO解剖特征
2.cTTE 检查:使用GE Vivid E95 彩色多普勒超声诊断仪,M5Sc 经胸探头,频率1.7~3.3 MHz。检查前取1 支5 ml 注射器抽取50%高渗葡萄糖溶液4.5 ml 和0.5 ml空气,通过三通管与另1支5 ml注射器连通并快速来回抽吸注射器30次,制备成微泡混悬液。患者取左侧卧位,连接心电图,取心尖四腔心或胸骨旁四腔心切面,于患者左肘前静脉团注微泡混悬液,分别于静息状态和Valsalva 动作下观察有无RLS、RLS出现时间,并依据静止的单帧图像上左心腔内最大微泡数量进行RLS 分级。具体为:0 级,左心腔内未见微泡,无RLS;Ⅰ级,左心腔内单帧图像可见1~9个微泡;Ⅱ级,左心腔内单帧图像可见10~30 个微泡;Ⅲ级,左心腔内单帧图像可见>30 个微泡,或左心腔几乎充满微泡,心腔浑浊[1]。见图2。两次注射至少间隔5 min以保证心腔内上一次注射后的微泡完全消失。于静息状态估算臂心循环时间,以保证Valsalva 动作的释放时间与右房微泡初始显影时间一致。Valsalva 动作时采用改良压力表装置,嘱患者深大吸气后向压力表内吹气,使压力表读数>40 mmHg(1 mmHg=0.133 kPa)并保持10 s 后释放。以上操作均由2 名具有5 年以上工作经验的心脏超声医师和1 名具有5年以上工作经验的护理人员配合完成,图像分析由心脏超声医师完成,意见不一致时复查cTTE,并计数微泡3次取平均值作为分级依据。
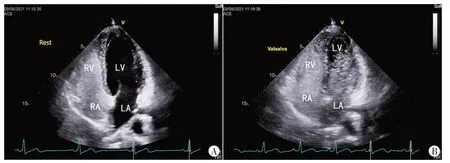
图2 cTTE检查静息状态及Valsalva动作下RLS变化
3.TEE 测值重复性检验:采用随机数字表法于两组中各随机抽取10例患者的TEE 动态图像资料,由经验丰富的心脏超声医师A 和B(具有5 年、15 年以上工作经验)分别测量PFO 左房侧开口径、右房侧开口径,间隔2 周后由超声医师A 重复进行测量,评价TEE 测值在观察者内及观察者间的一致性。
4.临床资料收集:通过查阅病历或询问病史,记录患者性别、年龄、高血压史、糖尿病史、吸烟史,以及心电图、MRI 或CT 检查结果,对卒中组患者进行RoPE评分[6]。
三、统计学处理
应用SPSS 26.0 统计软件,计量资料均行Shapiro-Wilk 检验其正态性,符合正态分布的计量资料以x±s表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验。计数资料以例或率表示,组间比较采用χ2检验或Fisher 确切概率法;等级资料以例或率表示,组间比较采用秩和检验。TEE 测值在观察者内及观察者间的一致性评价采用组内相关系数(intraclass correlation coefficient,ICC)。采用二元Logistic 回归分析预测中青年PFO 相关脑卒中发生的独立影响因素,并建立风险预测模型;采用Hosmer-Lemeshow 检验评价该模型的拟合度;绘制受试者工作特征(ROC)曲线并根据其曲线下面积(AUC)评价该模型的区分度。P<0.05为差异有统计学意义。
结果
一、两组临床资料比较
卒中组年龄大于非卒中组,男性占比高于非卒中组,差异均有统计学意义(均P<0.05);两组高血压、糖尿病、吸烟史占比比较,差异均无统计学意义。见表1。
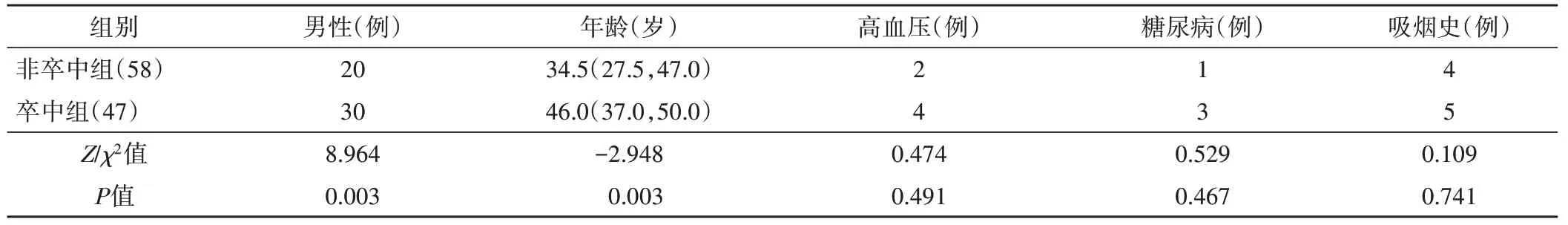
表1 两组临床资料比较
二、两组TEE检查结果比较
卒中组合并ASA 者5 例,非卒中组未发现合并ASA,差异有统计学意义(P<0.05);卒中组PFO 左房侧开口径、右房侧开口径均大于非卒中组,差异均有统计学意义(均P<0.05);两组合并CN 或EV 占比、房间隔活动度、PFO 通道长度、PFO 与下腔静脉角度比较,差异均无统计学意义。见表2。
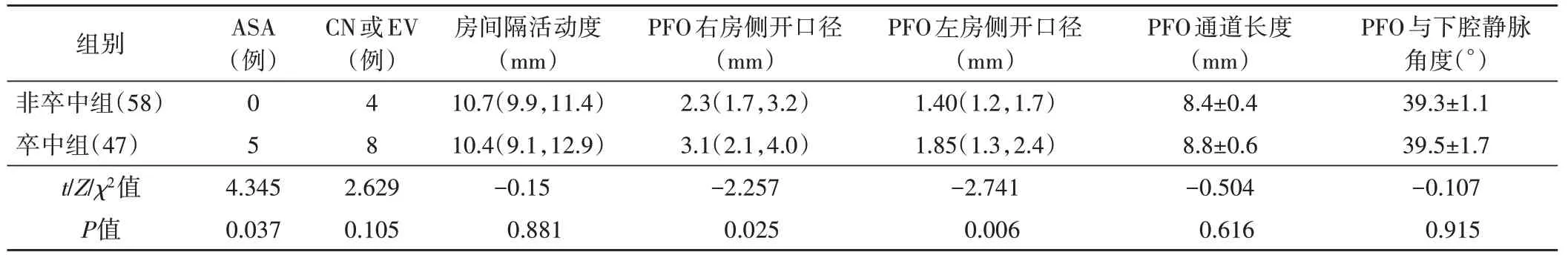
表2 两组TEE检查结果比较
三、两组cTTE检查结果比较
非卒中组与卒中组静息状态和Valsalva 动作下RLS 分级、中大量分流(RLS Ⅱ、Ⅲ级)占比(12.1% vs.25.5%,93.1%vs.87.2%),以及静息状态下存在RLS占比(27.6% vs.40.4%)比较,差异均无统计学意义。见表3。

表3 两组cTTE检查结果比较 例
四、TEE测值的重复性检验结果
重复性检验显示,PFO左房侧开口径、右房侧开口径在观察者间和观察者内的一致性均高(均ICC>0.75),具有很好的可重复性。见表4。

表4 TEE测值的重复性检验
五、二元Logistic回归分析及风险预测模型的构建和验证
以是否合并缺血性脑卒中为因变量,将上述组间比较中P<0.2的变量纳入自变量。参照RoPE评分中年龄分级将年龄这一连续变量分为4段,即18~30岁、≥30~40 岁、≥40~50 岁、≥50~55 岁;按照四分位数间距将PFO 右房侧开口径、左房侧开口径这两个连续变量分为4 个等级,分别为右房侧开口径Q1 级(≤1.9 mm)、Q2 级(1.9~2.6 mm)、Q3 级(≥2.6~3.9 mm)、Q4 级(≥3.9 mm),左房侧开口径Q1 级(≤1.3 mm)、Q2 级(1.3~1.6 mm)、Q3级(≥1.6~2.3 mm)、Q4级(≥2.3 mm)。将上述转换后的自变量逐个与因变量进行单因素Logistic 回归分析,并将P<0.2 的自变量排除多重共线性后纳入多因素Logistic 回归分析,结果显示性别、PFO 左房侧开口径均为预测中青年PFO 相关脑卒中发生的独立影响因素(均P<0.05)。见表5。由此构建预测中青年PFO 相关脑卒中发生的风险预测模型,Omnibus 检验证实该模型有统计学意义(χ2=18.046,P=0.001);Hosmer-Lemeshow 检验显示该模型拟合度好(χ2=1.295,P=0.972);ROC 曲线分析显示该模型具有较高的区分度(AUC=0.728,P<0.001)。见图3。应用该模型能够正确分类66.0%的研究对象,其预测中青年PFO 相关脑卒中发生的灵敏度、特异度、阳性预测值、阴性预测值分别为43.5%、84.2%、69.0%、64.9%。

表5 影响中青年PFO相关脑卒中发生的二元Logistic回归分析

图3 风险预测模型预测中青年PFO相关脑卒中发生的ROC曲线图
讨 论
近年来PFO 相关脑卒中越来越受临床重视,介入封堵PFO 受到广泛关注,但并非所有脑卒中合并PFO患者均能通过闭合PFO获益。PFO的不同解剖特征对脑卒中发生的影响不同。研究[13]表明PFO 的解剖特征是隐源性脑卒中患者通过经皮封堵PFO 获益的重要决定因素。目前临床主要应用超声心动图评估PFO的解剖特征,其中常规经胸超声心动图因受多种因素(如肥胖、肺气干扰等)影响,对PFO 的检出率较低,难以准确测量PFO 大小;TEE 分辨力高,不受胸壁、肋骨等遮挡,可以获得PFO 相关的全部解剖细节,但其对PFO 所致RLS 的诊断不敏感,部分患者PFO 分流不明显或Valsalva 动作配合欠佳时存在一定的假阴性;而cTTE对RLS的检出率高达95%左右[1,14]。本研究应用TEE联合cTTE全面评估PFO的解剖及分流特征,基于二者构建中青年PFO相关脑卒中风险预测模型并探讨其预测效能,旨在为临床决策提供可靠的影像学依据。
目前PFO 相关脑卒中的诊断标准尚未明确,本质上仍是一种排他性诊断。Kent 等[6]研究认为RoPE 评分越高,PFO 与脑卒中相关的可能性越大,当RoPE 评分为0~3 分时,几乎不考虑PFO 为其病因;PFO 合并缺血性卒中时PFO 的归因率在RoPE 评分5 分时为34%(95%可信区间:21%~45%)、6 分时为62%(95%可信区间:54%~68%),而在9~10分时则为88%(95%可信区间:83%~91%)。故本研究中卒中组的纳入标准要求RoPE 评分>6 分,保证了卒中组患者脑卒中与PFO的高度相关性,使研究结果更可靠。
既往研究[14-15]认为PFO的高危特征主要包括大量分流、大口径PFO、静息状态下存在RLS、合并ASA、长通道PFO、合并EV 或CN 等。有效Valsalva 动作下所测最大PFO开放直径接近其真实大小[1]。反常栓塞的通路之一为PFO 所致RLS,较大口径PFO 常与较严重的分流有关[15-16]。本研究中卒中组Valsalva 动作下PFO 左房侧开口径、右房侧开口径及合并ASA 占比均大于非卒中组,差异均有统计学意义(均P<0.05),表明较大口径PFO 或合并ASA 的患者更易发生PFO 相关脑卒中,与既往研究[13,17-18]结果一致。存在ASA 时房间隔较软且活动度大,常导致PFO开口较大,特别是在Valsalva 动作下,右房压力瞬时超过左房后,合并ASA 的房间隔将更容易被推向左房侧,使PFO 开口径更大,继而更大程度地增加经PFO 通道的RLS 量;另外,ASA的存在会干扰局部血流动力学,增加局部血栓形成风险,这些均可能进一步提高PFO 相关反常栓塞的发生率[11],从而增加PFO相关脑卒中的发生风险。
本研究二元Logistic 回归分析显示,PFO 男性患者较女性患者发生PFO 相关脑卒中的风险更高[OR=3.134(95%可信区间:1.325~7.412),P=0.009]。分析原因可能为男性吸烟、饮酒等不良生活习惯发生率常较女性高,致使其发生血管性疾病的风险更大,提示PFO 相关脑卒中并非由PFO 本身单独作用所致,还有其他危险因素参与。本研究中PFO 左房侧开口径Q2级发生PFO 相关脑卒中的风险与Q1 级比较差异无统计学意义(P=0.887),Q3 级、Q4 级发生PFO 相关脑卒中的风险较Q1 级均增加[OR分别为3.178(95%可信区间:1.021~9.891)、3.569(95%可信区间:1.109~11.479),均P<0.05]。提示排除性别因素后,PFO 左房侧开口径为预测PFO 相关脑卒中发生的独立危险因素,当其达到高危阈值(≥1.6 mm),PFO 相关脑卒中的发生风险将显著增加,与既往研究[4,19]结果基本一致。理论上更大口径的PFO 常使更大的栓子有机会通过PFO,致使脑血管堵塞并引发脑缺血,引发脑卒中的栓子通常需要达到一定大的体积,一些细微栓子并不会引发脑卒中甚至可能在流动过程中被主动脉的高速血流冲刷而溶解,故PFO 口径需达到一定阈值后才会显著增加脑卒中发生风险。
虽然本研究中卒中组合并ASA占比与非卒中组比较差异有统计学意义(P<0.05),但在单因素Logistic 回归分析时发现合并ASA占比这一自变量并无统计学意义(OR值异常,P=0.999)。分析其原因为本研究ASA发生率较低,在非卒中组中合并ASA的频数为0所致,故未将其纳入风险预测模型,有待后续扩大样本量,进一步探讨合并ASA与PFO相关脑卒中的关系。本研究中PFO 右房侧开口径在单因素Logistic 回归分析中差异有统计学意义,但未被纳入多因素Logistic 回归方程,分析原因可能为:①更大的右房侧开口径易导致更大的左房侧开口径,二者一定程度上呈正相关,根据因果有向无环图原理,Logistic 回归分析时PFO 左房侧开口径作为中介变量阻断了右房侧开口径的效应;②PFO右房侧开口径受原发隔移动影响较大,且不同患者完成Valsalva动作的有效程度不同,导致右房瞬时增压程度不同,进而引起原发隔向左房面的移动度不同,故PFO右房侧开口径测值的稳定性低于PFO左房侧开口径;③PFO左房侧开口径作为反常栓塞通路的出口,更能反映反常栓塞的栓子大小及概率。
本研究结果显示,虽然两组合并CN 或EV 占比、静息状态及Valsalva 动作下RLS 分级比较差异均无统计学意义;但与非卒中组比较,卒中组合并CN 或EV占比(17.0%vs.6.9%)、静息状态下存在RLS 分级占比(40.4% vs.27.6%)、静息状态下中大量分流占比(25.5%vs.12.1%)均更大,且单因素Logistic 回归分析显示静息状态下RLS 分级越高,OR值越大,由此推测PFO 静息状态下存在RLS 可能与脑卒中的发生相关,即静息状态下RLS 分级越高则PFO 相关脑卒中发生风险越大。两组Valsalva 动作下RLS 分级比较差异无统计学意义的原因可能为卒中组患者完成Valsalva 动作时所需肌肉肌力下降或神经支配欠灵活,导致部分患者完成Valsalva 动作的有效程度较非卒中组低,其潜在的大量分流可能未被充分激发。
本研究构建了中青年PFO相关脑卒中发生的风险预测模型,ROC 曲线分析显示该模型的AUC 为0.728,提示该模型具有较高的区分度,能够较为准确地区分研究对象是否发生PFO 相关脑卒中。Hosmer-Lemeshow检验显示该模型的拟合度较好,能够较为真实地预测PFO相关脑卒中的发生风险。应用该模型能够正确分类66.0%的研究对象,其预测中青年PFO 相关脑卒中发生的灵敏度、特异度、阳性预测值、阴性预测值分别为43.5%、84.2%、69.0%、64.9%。cTTE 和TEE 检查具有相对简便、安全、实时、可动态成像等优势,临床普及度较高,基于二者构建的风险预测模型在预测中青年PFO 相关脑卒中发生方面具有潜在的临床适用价值,有助于临床针对不同患者进行个性化决策分析,为减少非必要封堵提供参考依据,在一定程度上可避免PFO 的过度治疗。但本研究样本量较小,有部分影响PFO 相关脑卒中发生的因素未能被纳入该模型,导致其灵敏度较低。有待今后扩大样本量,对模型进行深入优化及验证,并将改进后的模型应用于前瞻性随机对照试验以进一步证实其可信度和有效性。
此外,根据二元Logistic 回归分析结果,可依据PFO 左房侧开口径对PFO 进行初步危险分层,即PFO左房侧开口径≥1.6 mm 为高危PFO。但本研究中因考虑PFO 左、右房侧开口径为数值变量,以mm 为单位,又精确到小数点后一位,包含的信息丰富,不便于对因变量进行预测和解释,故构建模型时未直接将其以原始数值变量形式纳入,而是依据四分位数间距将其转换为等级变量后再纳入回归分析,以适度放大这两个数值变量及其对应的OR值,使结果具有更大的实际意义。但这在一定程度上导致该数值变量信息的部分丢失,故上述危险分层方法是否能精确适用于临床超声诊断工作中,需要更大样本量的研究进一步证实。且本研究为单中心、回顾性研究,仅纳入年龄≤55岁的PFO 合并RLS患者,研究结果是否适用于55岁以上患者仍未明确,有待今后扩大样本量,进行多中心、前瞻性研究进一步探讨。
综上所述,对于年龄≤55 岁的PFO 合并RLS 患者,在排除性别因素后,Valsalva动作下所测PFO左房侧开口径在预测PFO相关脑卒中的发生风险中有一定的临床价值;应用TEE联合cTTE可识别PFO的解剖及分流特征,并对PFO进行初步危险分层,有助于临床更加精准地筛选出能通过PFO封堵术最大化获益的患者。
