磁共振多参数成像对局部进展期直肠癌新辅助放化疗效果的评估价值
2024-05-11赵晓丽王妍妍贾志仙
赵晓丽,王妍妍,贾志仙
(安阳市中医院 影像科,河南 安阳 455000)
局部进展期直肠癌是指肿瘤已侵犯直肠周围组织,但尚未发生远处转移[1-2]。新辅助放化疗是局部进展期直肠癌的标准治疗方法之一,旨在缩小肿瘤体积,降低手术难度和风险[3]。不同患者对新辅助放化疗的响应是不同的,这可能给治疗效果及预后带来一定影响。磁共振(magnetic resonance imaging,MRI)多参数成像可以通过多种图像参数评估肿瘤的形态学特征、细胞密度、血管通透性等,这些参数可以直接或间接反映肿瘤的生物学特性[4]。有研究表明,通过分析肿瘤MRI多参数成像参数,可以评估患者治疗情况,这提示或可将MRI多参数成像应用于局部进展期直肠癌新辅助放化疗效果的评估中[5]。本研究观察MRI影像中分析频率较高的表观弥散系数(apparent diffusion coefficient,ADC)与灌注参数,探讨其与局部进展期直肠癌新辅助放化疗效果的联系。
1 资料与方法
1.1 一般资料
选取2021年6月至2023年6月安阳市中医院收治的98例局部进展期直肠癌患者临床资料开展回顾性分析。(1)纳入标准:①手术病理证实为局部进展期直肠中分化腺癌;②年龄20~70岁;③患者及家属知情同意;④患者在新辅助放化疗前、后(6~8周)接受过MRI检查;⑤临床资料完整。(2)排除标准:①重要器官功能不全;②经影像学检查存在远处转移;③MRI图像不清或无法测量病灶;④既往存在盆腔放化疗治疗史;⑤存在认知障碍、精神疾病等不能配合研究;⑥合并免疫功能疾病;⑦合并其他恶性肿瘤。根据患者新辅助放化疗效果分为完全缓解(complete remission,CR)组(35例)与未完全缓解(no complete remission,nCR)组(63例)。本研究方案经医院医学伦理委员会审查批准。
1.2 检查及评估方法
所有患者均于新辅助放化疗前1周及后1周接受盆腔MRI检查。通过3.0 T MRI扫描仪(德国西门子公司,MAGNETOM Verio)、相控阵18通道线圈,实施盆腔矢状位、冠状位及轴位(T2WI、T1WI序列)平扫,同时进行弥散张量成像(diffusion weighted imaging,DWI)及磁共振动态对比增强(dynamic contrast enhanced-MRI,DCE-MRI)轴位序列扫描。共采集35个周期,单个周期为8 s,于第3周期后肘静脉注射对比剂后继续扫描。图像评估:扫描结束后对图像进行判读,对肿瘤进行TNM分期与病情评估,依据常规T2WI图像,于肿瘤实质位置,选DCE-MRI肿瘤强化度最高的部位及DWI(b=1 000 s·mm-2)肿瘤明显高信号区域为感兴趣区,面积约为30 mm2,注意避开肿瘤液化坏死区域及周围血管组织,于DCE-MRI伪彩图上测DCE-MRI定量灌注参数,包括血浆交换率、组织灌注量、转置常数。于ADC图像上测ADC值。
1.3 治疗方法及疗效评估
新辅助放化疗方法:选择小剂量长程放疗方案,放疗总剂量为50 Gy,每次2 Gy,每周放疗5次,共放疗25次,放疗开始静脉滴注氟尿嘧啶400 mg·m-2至结束,于新辅助放化疗结束后6~14周进行直肠全系膜切除术。疗效评估方法[6]:术后实施病理镜检,根据镜下肿瘤细胞、纤维化情况分为5个等级,1级为无肿瘤细胞残余,可见大量纤维化;2级为极少肿瘤细胞散落于纤维化中;3级为有较多肿瘤细胞,但占比小于纤维化;4级为肿瘤细胞占比大于纤维化;5级为难见纤维化且存在大量肿瘤细胞。将1至2级定义为CR,3至5级定义为nCR。
1.4 统计学方法

2 结果
2.1 一般资料及MRI参数
两组性别、年龄、糖尿病病史、高血压病史、治疗后血浆交换率、治疗后组织灌注量值相比,差异无统计学意义(P>0.05)。CR组治疗前ADC、治疗后转置常数低于nCR组,治疗后ADC、ADC差值、治疗前血浆交换率、血浆交换率差值、治疗前转置常数、转置常数差值、治疗前组织灌注量、组织灌注量差值高于nCR组(P<0.05)。见表1。
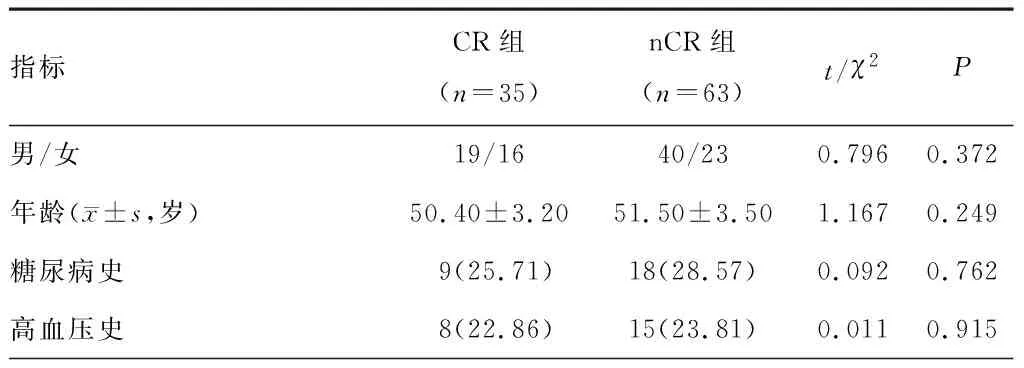
表1 两组一般资料及MRI参数比较
2.2 MRI多参数与局部进展期直肠癌新辅助放化疗效果的关系
以疗效为因变量(赋值:CR=0,非CR=1),以MRI多参数差值为自变量,进行logistic回归分析,结果显示,ADC差值、血浆交换率差值、转置常数差值、组织灌注量差值均是疗效的影响因素(P<0.05)。见表2。
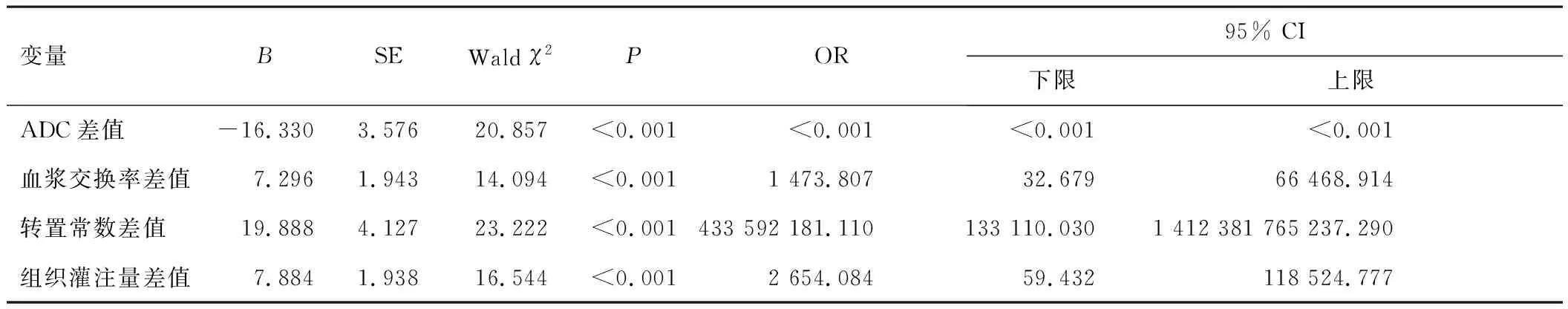
表2 疗效影响因素的logistic回归分析
2.3 MRI多参数评估局部进展期直肠癌新辅助放化疗效果的价值效能
ROC曲线分析显示,ADC差值、血浆交换率差值、转置常数差值、组织灌注量差值评估局部进展期直肠癌新辅助放化疗效果的曲线下面积(area under the curve,AUC)分别为0.941、0.742、0.953、0.774,敏感度、特异度分别为88.6%/87.3%、88.6%/50.8%、97.1%/82.5%、77.1%/68.3%。
将ADC差值、血浆交换率差值、转置常数差值、组织灌注量差值纳入logistic回归模型,通过回归系数统计分析得出联合数据。联合数据评估局部进展期直肠癌新辅助放化疗效果的AUC为0.993,敏感度、特异度为91.4%、100.0%。见表3。
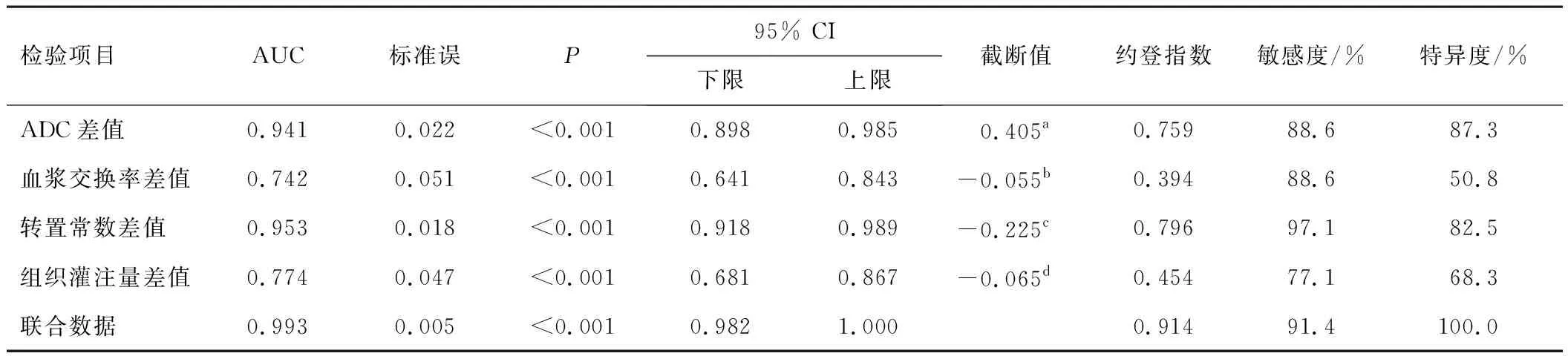
表3 MRI多参数评估局部进展期直肠癌新辅助放化疗效果的价值效能
3 讨论
局部进展期直肠癌是指原发肿瘤已经侵入肠壁肌层,但还未出现远处转移情况[7-8]。新辅助放化疗是局部进展期直肠癌的常用治疗方式,然而,由于肿瘤的异质性和个体差异,患者治疗效果评估一直是临床实践中的难点[9]。近年来,随着医学影像技术的不断发展,MRI多参数成像技术在肿瘤诊断、治疗评估及预后评估方面展现出了巨大的潜力。MRI多参数成像是一种能够提供丰富组织生理信息的成像技术,包括T1、T2、DWI等,这些参数可以反映肿瘤的细胞密度、组织结构、细胞膜通透性等多种生物学特性[10-11]。本研究旨在探讨MRI多参数成像在局部进展期直肠癌新辅助放化疗效果评估中的价值,为优化治疗方案提供参考依据。
本研究结果显示,两组治疗前后ADC、转置常数及差值比较差异有统计学意义,两组治疗前血浆交换率、组织灌注量及差值比较差异有统计学意义。这与肖兰[12]研究类似,分析原因在于,局部进展期直肠癌的生物学特性可能存在差异,治疗前CR组患者肿瘤可能具有更高的细胞密度、更紧密的细胞间连接和更少的细胞外间隙,这可能导致水分子的扩散受到更大限制,ADC值更低。同时,CR组患者肿瘤血管可能更为丰富,血管通透性和灌注情况异常更为明显,导致血浆交换率、转置常数和组织灌注量更高。经过新辅助放化疗,CR组肿瘤细胞可能发生了更大的变化,包括细胞结构的破坏和重塑,这可能导致ADC值、血浆交换率、转置常数和组织灌注量发生更大的变化[13]。这说明,CR组可能对放化疗更为敏感,治疗效果更好,导致肿瘤细胞结构和生理特征发生更大变化。
本研究结果显示,ADC差值、血浆交换率差值、转置常数差值、组织灌注量差值均是局部进展期直肠癌新辅助放化疗效果的相关影响因素。分析原因可知,ADC差值反映的是治疗前后肿瘤细胞水分子扩散程度的变化。当ADC差值升高时,说明肿瘤细胞的水分子扩散程度增加,这通常意味着肿瘤细胞的死亡和细胞结构的破坏。血浆交换率差值反映的是治疗前后血管外细胞外间隙容积的变化。当血浆交换率差值升高时,说明血管外细胞外间隙容积增加,这可能是由于肿瘤血管的破坏和细胞外基质的重塑[14]。因此,血浆交换率差值越高,局部进展期直肠癌新辅助放化疗的效果越好。转置常数差值反映的是治疗前后血管通透性的变化。当转置常数差值升高时,说明血管通透性增加,这可能是由于肿瘤血管的破坏和血管通透性的改变,而血管通透性的改变又与疗效密切相关,组织灌注量差值反映的是治疗前后组织灌注的变化[15]。当组织灌注量差值升高时,说明组织灌注增加,这可能是由于肿瘤血管的重建和血流得到改善,组织灌注量差值越高,往往说明局部进展期直肠癌新辅助放化疗的效果越好。此外,本研究发现,联合评估局部进展期直肠癌新辅助放化疗效果的AUC为0.993,敏感度、特异度为91.4%、100.0%。说明其评估效果较好,这是因为ADC差值、血浆交换率差值、转置常数差值、组织灌注量差值可以反映肿瘤细胞的死亡和细胞结构的破坏、肿瘤血管的破坏和细胞外基质的重塑、肿瘤血管的破坏和血管通透性的改变以及肿瘤血管的重建和血流的改善,这些变化有助于评估患者治疗效果[16]。
4 结论
MRI多参数(ADC、血浆交换率、组织灌注量、转置常数)差值评估局部进展期直肠癌新辅助放化疗效果均具有一定价值,且联合评估价值更高。
