微米花状NiFe-LDH的制备及其析氧性能研究
2024-05-10焦宇鸿葛金龙秦英月
焦宇鸿,吴 方,葛金龙,秦英月
(1.蚌埠学院材料与化学工程学院,安徽 蚌埠 233030; 2.安徽省硅基新材料工程实验室,安徽 蚌埠 233030)
目前,非再生化石能源(如石油和天然气)是当今世界上最重要的能源之一,然而化石能源的大规模利用带来了严重的环境问题以及越来越严峻的能源危机。氢能是一种新型的、清洁的二次能源。在各种制氢的方法中,电解水制取氢气是目前最有前景的一种方法。电解水制氢分为阳极析氧反应(OER)和阴极析氢反应(HER)。然而OER反应涉及复杂的四电子转移过程,存在动力学迟缓问题,其所需过电位较高,严重降低了电解水制氢的效率[1-3]。探寻开发高活性的析氧催化剂成为推动电解水规模应用的关键。析氧催化剂分为贵重金属催化剂和非贵重金属催化剂两大类。贵金属催化剂包括单质Ru、单质Ir及其合金、氧化物等[4-6],然而它们价格昂贵、储量稀少。目前,已报道的非贵重金属催化剂包括过渡金属硒化物[7-8]、硫化物[9-11]、氮化物[12-13]、磷化物[14-15]、氢氧化物等[16-18]。
氢氧化物由于其具有特殊的层状结构、制备简单、析氧活性可调等优点,受到广泛关注。然而LDH的导电性差,严重影响析氧过程中的电子转移,常将其与导电基底或导电材料结合,提高其电荷转移能力,从而增强析氧活性[16-18]。此外,鉴于镍铁双金属耦合作用,使得NiFe-LDH的析氧活性优于单一的氢氧化物,可调节双金属镍铁比例,进而改变优化其电子结构,进而增强其析氧活性。
基于上述,本研究以泡沫镍为导电基底,采用简单的水热方法,通过调节双金属镍铁的比例,制备出系列二元NiFe-LDH催化剂,并优选出具有最佳析氧活性的催化剂。这为构筑LDH催化剂提供了实验依据。
1 实验部分
1.1 仪器与试剂
KQ-100B型超声波清洗器,DHG-9140A型电热恒温鼓风干燥箱,上海越平FA1004C型电子分析天平,CHI760E型上海辰华电化学工作站。
尿素,乙醇,六水合硝酸镍,九水合硝酸铁。所有试剂均来自上海阿拉丁试剂有限公司。所有试剂均直接使用,没有经过其他处理。实验所用超纯水均由实验室纯水系统Eco-S15(上海和泰仪器有限公司)制备。泡沫镍来自深圳科晶智达科技有限公司。
1.2 泡沫镍的清洗
剪取泡沫镍(NF, 3 cm×1 cm),为去除NF表面的杂质和油污,将其先后置于3 mol·L-1HCl、丙酮和乙醇中,超声清洗15 min,随后置于真空烘箱中,干燥备用。
1.3 Ni(OH)2的制备
将5.0 mmol尿素,3.2 mmol Ni(NO3)2·6H2O溶于30 mL超纯水。用磁力搅拌器搅拌均匀,随后将混合液转移至50 mL的高压反应釜内胆中,将清洗后的泡沫镍放入反应釜内胆。将反应釜内胆放到高压反应釜中,密封,120 ℃下反应12 h。反应结束后,自然冷却至室温。将负载于反应产物的泡沫镍取出,并用无水乙醇和去离子水清洗数次,并置于烘箱中干燥,将产物标记为Ni(OH)2。
1.4 不同镍铁比例的NiFe-LDH的制备
将5.0 mmol尿素,1.6 mmol Fe(NO3)2·9H2O,1.6 mmol Ni(NO3)2·6H2O溶于30 mL超纯水。用磁力搅拌器搅拌均匀,随后将混合液转移至50 mL的高压反应釜内胆中,将清洗后的泡沫镍放入反应釜内胆。将反应釜内胆放到高压反应釜中,密封,120 ℃下反应12 h。反应结束后,自然冷却至室温。将负载于反应产物的泡沫镍取出,并用无水乙醇和去离子水清洗数次,并置于烘箱中干燥,将产物标记为NiFe-LDH-1。重复这一实验步骤,不同的是改变硝酸铁和硝酸镍的物质的量之比,使比例分别为1∶3、1∶10,产物分别命名为NiFe-LDH-2,NiFe-LDH-3。
1.5 催化剂的表征
利用X射线粉末衍射仪(日本理学Smart Lab型)表征催化剂的晶体结构。利用扫描电子显微镜(SEM,FEI Quanta 400 FEG型)表征催化剂的微观形貌。采用拉曼光谱分析仪(iHR550型)来表征催化剂表面组分。
1.6 电催化析氧活性测试
利用辰华CHI760E型电化学工作站搭建三电极体系测试系列催化剂的析氧活性。以Hg/HgO电极(内参比溶液为1 mol·L-1KOH)为参比电极,石墨棒作为对电极,负载有催化剂的泡沫镍为工作电极。利用能斯特方程E(RHE)=E(Hg/HgO)+0.921 V,将测试所得的电极电位转换为标准氢电极电势。电解液为1 mol·L-1KOH。利用线性扫描伏安法(LSV)测试极化曲线,扫描速率为1 mV·s-1。利用电化学阻抗谱(EIS)测试溶液电阻和电荷传输电阻,测试频率范围0.01 Hz~100 kHz,振幅5 mV。在非法拉第区间,利用双电层电容(Cdl)评估催化剂的电化学活性面积(ECSA)。用循环伏安法(CV)以40、60、80、100、120和140 mV·s-1的扫速测试,获取催化剂的双电层电容。采用计时电位法在10 mA·cm-2的电流密度下测试催化剂的稳定性。
2 结果与讨论
2.1 XRD衍射图谱
图1是所制备的系列催化剂的XRD图。
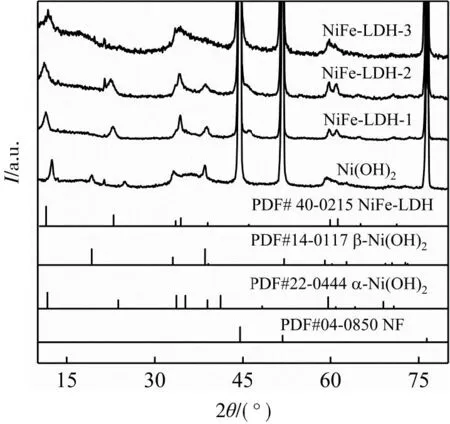
图1 Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2和NiFe-LDH-3的XRD图
由图1可以看出,所有催化剂的基底泡沫镍的衍射峰出峰位置与NF标准卡片(PDF#04-0850)相对应。所制备的Ni(OH)2的衍射峰与α-Ni(OH)2标准卡片(PDF#22-0444)和β-Ni(OH)2标准卡片(PDF#14-0117)相匹配。NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3的衍射峰与NiFe-LDH标准卡片(PDF#40-0215)相匹配,说明成功制备出NiFe-LDH催化剂。单一的镍盐可以水热制备Ni(OH)2,而添加铁盐之后水热合成NiFe-LDH,说明改变原料中镍铁比例,可以调控催化剂的晶体类型。
2.2 SEM图
为了表征Ni(OH)2和NiFe-LDH-1的微观尺寸和形貌,对其进行SEM测试。由图2(a)可以看出,Ni(OH)2是由纳米线构成的海胆状结构,其中海胆状结构的直径约2 μm。这种独特的海胆状结构可提供更大的比表面积,增加活性位点的数目;有助于气体产物的释放。NiFe-LDH-1呈现出微米花状三维分级结构,且该分级结构是由纳米片构筑而成。这种由纳米片构筑的三维分级结构显著增大了催化剂的活性面积,有利于暴露更多的活性位点,利于气体溢出,从而提高析氧活性。对比Ni(OH)2和NiFe-LDH-1的微观形貌可以得出,保持金属盐的总量不变,改变镍铁盐的比例,可以调控氢氧化物的形貌。

图2 Ni(OH)2和NiFe-LDH-1 SEM图
2.3 拉曼图谱
为进一步表征NiFe-LDH-1的结构,对其进行拉曼光谱分析,如图3所示。在拉曼位移为528 cm-1和682 cm-1分别归属于镍氧振动和铁氧振动[18],这与文献报道的NiFe-LDH的相关数据相一致,表明生成了NiFe-LDH。
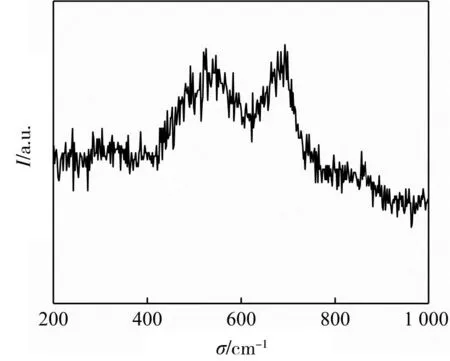
图3 NiFe-LDH-1的拉曼光谱图
3 电催化析氧性能
图4为NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3、Ni(OH)2、NF在1.0 mol·L-1KOH溶液中的LSV测试曲线。10 mA·cm-2的电流密度,NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3、Ni(OH)2和NF所需要的过电势分别为218、219、245、297和536 mV。达到100 mA·cm-2的电流密度,NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3和Ni(OH)2,所需的过电势分别为264、277、294和410 mV。由此可以看出相比于单一的Ni(OH)2,优化制备的NiFe-LDH-1具有最优秀的OER性能;其析氧活性要显著优于已报道的某些贵金属催化剂[19]和非贵金属基催化剂[7,13]。相比于Ni(OH)2,双元NiFe-LDH的析氧活性要显著增强,这可能归结于Ni/Fe双金属效应,优化了氢氧化物的电子结构,增强了其本征催化活性。
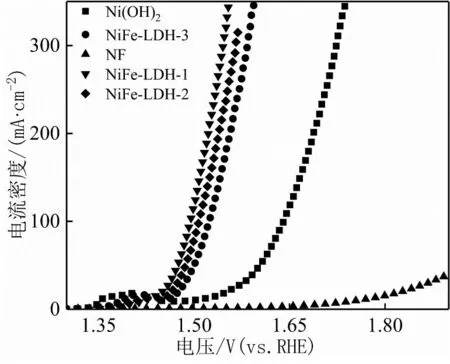
图4 Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3和NF的LSV曲线
为了研究系列催化剂的析氧动力学特性,对不同催化剂进行塔菲尔斜率分析,如图5所示。从图中可以看出NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3、Ni(OH)2、NF的塔菲尔斜率分别为36.3、32.2、35.2、86.8、183.7 mV·dec-1。可以看出系列NiFe-LDH催化剂与Ni(OH)2、NF相比,拥有更小的塔菲尔斜率,表明其具有较快的反应动力学特性。NiFe-LDH催化剂的塔菲尔斜率相差并不大,其中NiFe-LDH-2的塔菲尔斜率最小。
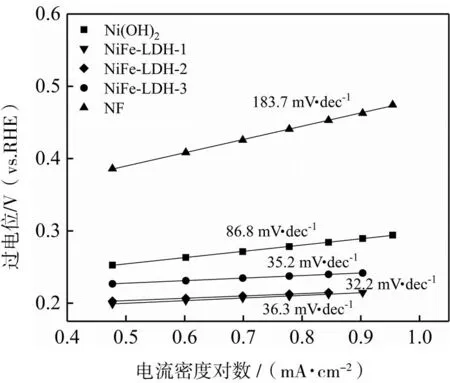
图5 Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3和NF的Tafel曲线图
图6为NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3、Ni(OH)2和NF的阻抗图谱。从图中可以看出NF具有最大的曲线半径,说明其电荷转移电阻最大。相比于Ni(OH)2,系列NiFe-LDH催化剂拥有更小的曲线半径,其中NiFe-LDH-1拥有最小的曲线半径,说明NiFe-LDH-1具有最小的液接电阻,表明其具有优异的电子传输能力,这与其较好的OER活性相对应。
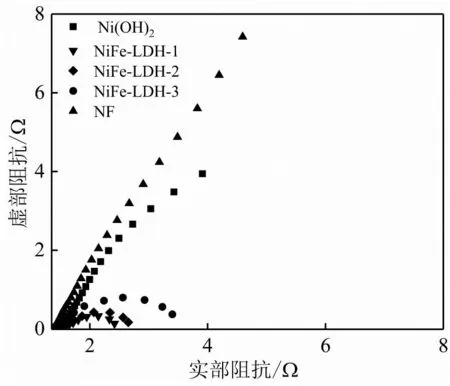
图6 Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3和NF的电化学阻抗图谱
为了进一步探究NiFe-LDH-1具有优异催化活性的原因,对系列催化剂进行了电化学活性面积测试,并利用双电层电容来表征ECSA的大小。由图7(e)可以看出Ni(OH)2的Cdl为1.07 mF·cm-2,NiFe-LDH-1的Cdl为0.80 mF·cm-2,NiFe-LDH-2的Cdl为0.96 mF·cm-2,NiFe-LDH-3的Cdl为0.73 mF·cm-2。虽然Ni(OH)2的Cdl要大于系列NiFe-LDH的Cdl,然而其析氧活性较差,说明电化学活性位点的数目并不是导致其具有较高析氧活性的原因。NiFe-LDH-1具有优异的OER活性,这可能与其具有较高的本征析氧活性有关[20]。
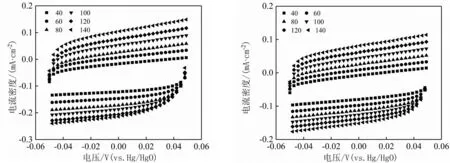
(a)Ni(OH)2 (b)NiFe-LDH-1

(e)系列催化剂的Cdl
催化稳定性是评估催化剂性能的重要指标之一。本研究采用计时电位分析法测试NiFe-LDH-1的催化稳定性。由图8所示,在1 mol·L-1KOH电解液中,在10 mA·cm-2的电流密度下,NiFe-LDH-1催化剂持续进行14 h的恒电流稳定性测试,其电势基本没有变化,进一步证明该催化剂的稳定性良好。
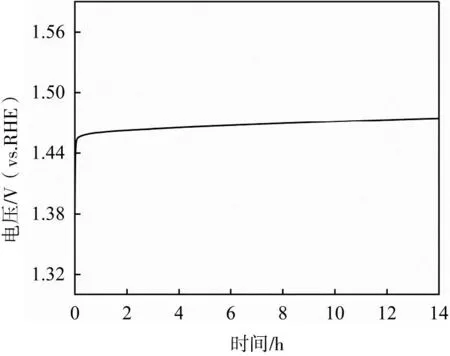
图8 NiFe-LDH-1的计时电位曲线
4 结语
本研究以泡沫镍为基底,采用简单的水热方法,通过改变镍盐铁盐比例合成系列Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2和NiFe-LDH-3催化剂。相比于单一的Ni(OH)2,系列NiFe-LDH催化剂具有较好的OER活性,其中NiFe-LDH-1具有最佳的OER活性。获得10 mA·cm-2和100 mA·cm-2的电流密度NiFe-LDH-1所需的过电势分别为218 mV和264 mV,塔菲尔曲线斜率是36.3 mV·dec-1,此外该催化剂具有较好的催化稳定性。该催化剂具有优异析氧活性的原因是:(1)以泡沫镍为基底,有助于提高催化剂的导电能力。(2)这种在泡沫镍上原位生长NiFe-LDH,避免了Nafion试剂的使用,使泡沫镍与催化剂之间的接触更为紧密,有利于提高其催化稳定性。(3)Ni/Fe双金属效应有效地优化了催化剂的电子结构,提供更多的活性位点,增强了其本征析氧活性。
