华蟾素调控PI3K/AKT通路逆转卵巢癌A2780/DDP细胞顺铂耐药的作用机制
2024-05-10舒美玲叶映泉张爽爽
舒美玲,吴 悦,叶映泉,张爽爽,张 梅
卵巢癌是女性生殖系统三大恶性肿瘤之一,致死率位居其中首位[1]。手术和以铂或紫杉醇为基础的化疗是卵巢癌的初始治疗[2]。但多数患者会发生化疗耐药出现肿瘤复发转移且后续治疗效果不佳,这是导致卵巢癌病死率较高的主要原因之一。华蟾素(cinobufagin,CBG)是从中华大蟾蜍或黑眶蟾蜍的干燥表皮和腺体分泌物中通过水提醇沉法提取出来的生物活性成分,目前广泛应用于抗恶性肿瘤治疗,在肝癌、肺癌、胃癌等多种恶性肿瘤中均表现出显著的抑癌效果[3]。已有研究[4]显示CBG能抑制卵巢癌细胞的增殖和侵袭促进其凋亡。但对于CBG能否逆转卵巢癌细胞对顺铂(cisplatin,DDP )的耐药性以及其机制研究的报道较少。现利用CBG处理A2780/DDP细胞探讨CBG对卵巢癌铂耐药的逆转机制,以期为CBG治疗卵巢癌提供新的理论依据。
1 材料与方法
1.1 实验材料人卵巢癌细胞株A2780和人卵巢癌细胞株顺铂耐药株A2780/DDP购自中国科学院上海细胞生物所;顺铂注射液(货号:H2001074)购自江苏豪森药业集团有限公司;CBG注射液(货号:国药准字Z34020273)由安徽华润金蟾药业股份有限公司提供;PI3K/AKT-IN-2抑制剂(货号:2684412-41-5)购自美国MCE公司;RIPA1640培养基(货号:C11875500BT)和胎牛血清(货号:A5670701)购自美国Gibco公司;ABW 基质胶(货号:0827045)购自上海诺娃医药科技有限公司;EdU试剂盒(货号:C0071S)和Hoechst试剂盒(货号:C0003)均购自碧云天生物技术有限公司;磷酸肌醇3-激酶(phosphatidylinositide 3-kinase, PI3K)(货号:R27768)、丝氨酸/苏氨酸激酶(AKT) 又名蛋白激酶B (protein kinase B, PKB)(货号:R23412)、E钙黏蛋白(货 号:340341)、 N钙黏蛋白(货号:380671)抗体购自成都正能生物技术责任有限公司;逆转录试剂盒 (货号:Q111-02)和RT-qPCR 试剂盒(货号:R222-01)购自南京诺唯赞生物科技股份有限公司。
1.2 方法
1.2.1人卵巢癌细胞株的培养 A2780和A2780/DDP细胞贴壁培养于含10%胎牛血清、1%青-链霉素和0.1%支原体清除剂的RIPA1640培养基中,置于含5% CO2的37 ℃恒温培养箱中。细胞密度达80%时进行传代。此外,A2780/DDP细胞在传代贴壁后另给予1 μg/ml顺铂以维持耐药性。
1.2.2CCK-8法检测细胞增殖能力 分别取对数生长期A2780和A2780/DDP细胞,按照8×103个/孔的密度接种于96孔板,细胞贴壁后按实验设计分别给药: DDP(2.5、5、10、20、40、80、100、160 μmol/L),CBG(200、100、50、25、12.5、6.25、3.125 mg/ml)于24、36、48 h后每孔加入CCK-8溶液10 μl,避光孵育1.5 h后读取562 nm处光密度(optical density,OD)值。计算DDP对A2780和A2780/DDP细胞或CBG对A2780/DDP细胞的半数抑制浓度(median inhibitory concetration,IC50),并计算出A2780/DDP的耐药指数(resistance index,RI)=IC50(A2780/DDP)/IC50(A2780) 。CBG(0、2、4、6 mg/ml)处理24 h后再加入梯度浓度DDP(2.5、5、10、20、40、80、100、160 μmol/L),24 h后加入CCK-8溶液10 μl,避光孵育1.5 h后读取562 nm处OD值,计算CBG的逆转指数(reversal fold,RF)=IC50(0 mg/ml )/IC50(2、4、6 mg/ml)CBG[5]。实验独立重复 3 次,设3个复孔。
1.2.3实验分组 根据CBG的IC50值和逆转耐药指数设计实验分组:对照组(12.5 μmol/L DDP)、低剂量组(12.5 μmol/L DDP+2 mg/ml CBG)、中剂量组(12.5 μmol/L DDP+4 mg/ml CBG)、高剂量组(12.5 μmol/L DDP+6 mg/ml CBG)、抑制剂组(12.5 μmol/L DDP+6 mg/ml CBG+6 μmol/L PI3K/AKT抑制剂)。
1.2.4平板克隆实验评估细胞的克隆增殖能力 将A2780/DDP细胞按500个/孔的密度接种于6孔板中,待细胞贴壁生长后按分组更换含药培养基。持续培养2周,期间每隔4 d换液。培养结束后,弃废液,用PBS洗净,每孔加入800 μl 4%多聚甲醛溶液固定细胞。40 min后吸弃多聚甲醛溶液,再每孔加入1 ml结晶紫染色,20 min后用PBS轻缓冲洗至6孔板无染料残留,晾干后拍照。使用ImageJ软件分析计算克隆形成率。每组设3个复孔,实验重复 3 次。
1.2.5EdU和Hoechst法评估细胞的增殖和凋亡情况 将A2780/DDP细胞按1×104/孔接种于铺有14 mm爬片的24孔板中,每孔含有500 μl完全培养基。待细胞贴壁生长后,按分组配制工作液进行换液。48 h后按照EdU试剂盒进行细胞的固定和标记。Hoechst实验前期铺板同EdU实验,48 h后按照Hoechst试剂盒进行细胞的固定和标记。染色后在荧光显微镜下拍照。并采用ImageJ软件统计增殖或凋亡细胞数量。每组设3 个复孔,实验重复3 次。
1.2.6细胞划痕实验评估细胞水平迁移能力 将A2780/DDP细胞按6×105个/孔接种于6孔板,培养24 h后,用200 μl枪头在细胞上划“一”字划痕,PBS洗涤3次,用无血清培养基配制各组培养液,进行换液。在0、24、48 h的时间点分别拍照,ImageJ软件分析24 h和48 h的划痕宽度比,细胞迁移率=(初始划痕面积-t时刻划痕面积)/初始划痕面积×100%。每组设3 个复孔,实验重复3 次。
1.2.7Transwell法检测细胞迁移和侵袭能力 将A2780/DDP细胞悬浮于含2%血清的完全培养基中,按4×105个/孔接种于含100 μl不同工作液的Transwell小室。细胞贴壁后下室加入含10%血清培养液600 μl,继续培养24 h后取出小室,用甲醛固定30 min,结晶紫染色30 min,PBS洗2次,用棉签轻轻擦拭小室内部未穿膜过的细胞,室温晾干。侵袭实验前用基质胶将Transwell小室湿化(不含血清的培养液以1 ∶8比例稀释基质胶,加80 μl/孔稀释好的基质胶在小室中,放培养箱中静置32 h),其余步骤同前法。最后将小室底部用显微镜拍照,采用ImageJ软件统计迁移细胞数量。每组设3 个复孔,实验重复3 次。
1.2.8Western blot检测PI3K/AKT信号通路和EMT相关蛋白的表达 在1.2.3项实验分组基础上增加A2780细胞组(12.5 μmol/L DDP),药物处理48 h后收集各组细胞的总蛋白,加入上样缓冲液,100 ℃、5 min煮沸变性后室温冷却,-20 ℃保存待用。根据所测蛋白分子量配制相应浓度分离胶,加样,电压65 V 30 min后,转150 V 60 min进行电泳,恒压200 mA 120 min转印至NC膜上,5%脱脂牛奶封闭60 min后与一抗(母液 ∶一抗稀释液=1 ∶1 000)孵育过夜,TBST洗膜3次,与二抗(母液 ∶二抗稀释液=1 ∶10 000)室温孵育60 min后,TBST洗膜3次,使用的增强型化学发光试剂显影并拍照。ImageJ软件分析相对蛋白含量,用各条带灰度值/内参条带的灰度值表示,每组实验重复3 次。
1.2.9RT-qPCR法检测PI3K/AKT信号通路和EMT相关mRNA 的表达 使用总RNA提取试剂盒提取总RNA,采用cDNA逆转录试剂盒合成cDNA,参照SYBR-Green PCR试剂盒说明书进行RT-qPCR实验。引物序列见表1,GAPDH作为内参,采用2-△△CT法分析目的基因在不同组别之间的表达差异,每组实验重复3次。

表1 引物序列
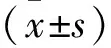
2 结果
2.1 A2780/DDP细胞耐药性的鉴定及CBG对A2780/DDP细胞耐药性的影响如图1A-1C所示,DDP作用于细胞24、36、48 h后,A2780/DDP的IC50值分别为68.89±0.269、62.743±1.071、52.433±0.176,A2780的IC50值为12.233±0.059、10.7±0.625、9.206±0.193,在DDP的各浓度作用下,A2780/DDP细胞的细胞活力明显高于A2780细胞,差异有统计学意义(F=16,P<0.05 ),RI值分别为5.636、5.864、5.695。如图1D显示:CBG作用于细胞24、36、48 h后,对A2780/DDP的IC50分别为32.337±1.374、22.48±0.501、9.681±0.101,根据CBG作用A2780/DDP细胞48 h的IC50值与24 h 或36 h的IC50值相比显著降低(F=540.4,P<0.05),选择48 h为后续实验工作时间,并将CBG对A2780/DDP细胞作用48 h后的20%(2 mg/ml)、40%(4 mg/ml)、60%(6 mg/ml)的抑制浓度作为逆转耐药实验的低、中、高剂量。图1E显示:处理48 h后,低、中、高剂量的CBG对A2780/DDP耐药的逆转倍数分别为1.617、2.570、3.461。

图1 A2780/DDP对DDP的耐药性分析以及CBG对其耐药性的逆转作用(n=3)
2.2 CBG对A2780/DDP克隆形成能力的影响
A-C:DDP处理24、36、48 h后A2780和A2780/DDP细胞的活力曲线;D:CBG处理后不同时间点A2780/DDP细胞生长活力曲线;E:0、2、4、6 mg/ml CBG处理A2780/DDP细胞后DDP对细胞生长的活力曲线图2显示:与对照组的细胞克隆数目相比,CBG低剂量、中剂量、高剂量组的细胞克隆数目随CBG药物剂量增加而减少,其中抑制剂组的细胞克隆数目最少,差异有统计学意义(F=310.2,P<0.05)。
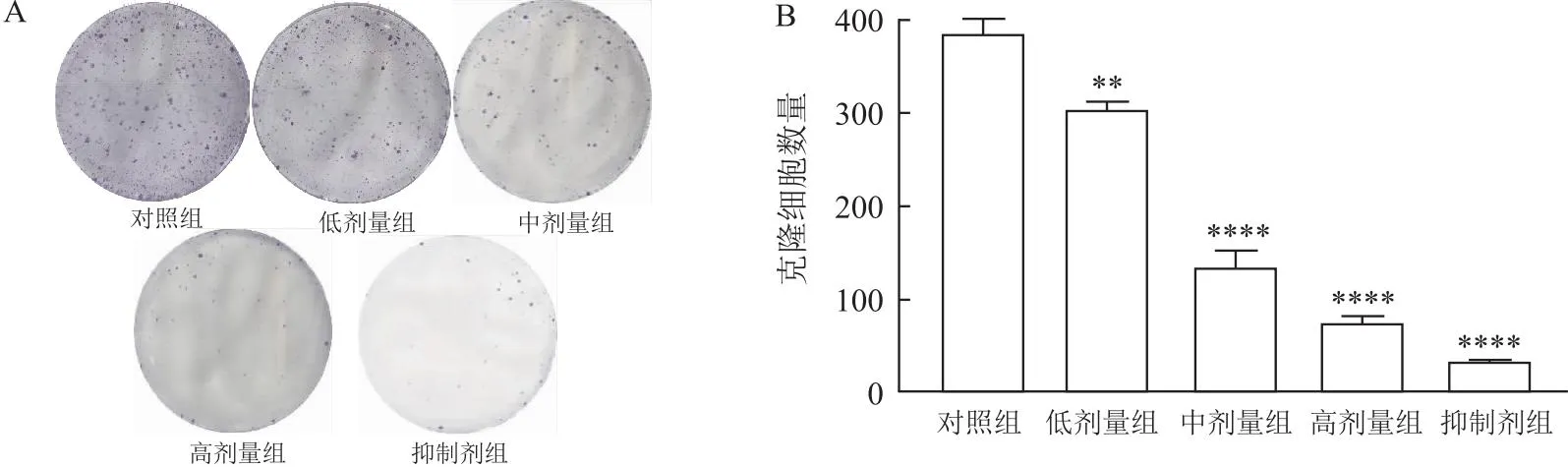
图2 CBG抑制A2780/DDP细胞克隆形成能力(n=3)
2.3 CBG对A2780/DDP细胞迁移和侵袭能力的影响划痕实验显示(图3A) :CBG处理24 h或48 h后,与对照组相比,低、中、高剂量组的CBG呈时间和浓度依赖性地抑制了细胞划痕愈合率,其中抑制剂组的细胞划痕愈合率最低,差异有统计学意义(24 h:F=105.9,P<0.01,48 h:F=59.2,P<0.01)。Transwell实验显示(图3B):与对照组相比,各组细胞处理24 h后,迁移和侵袭细胞数目呈现浓度依赖性的减少,其中抑制剂组细胞的迁移和侵袭能力显著降低,细胞数目最少,差异有统计学意义(P<0.000 1)。
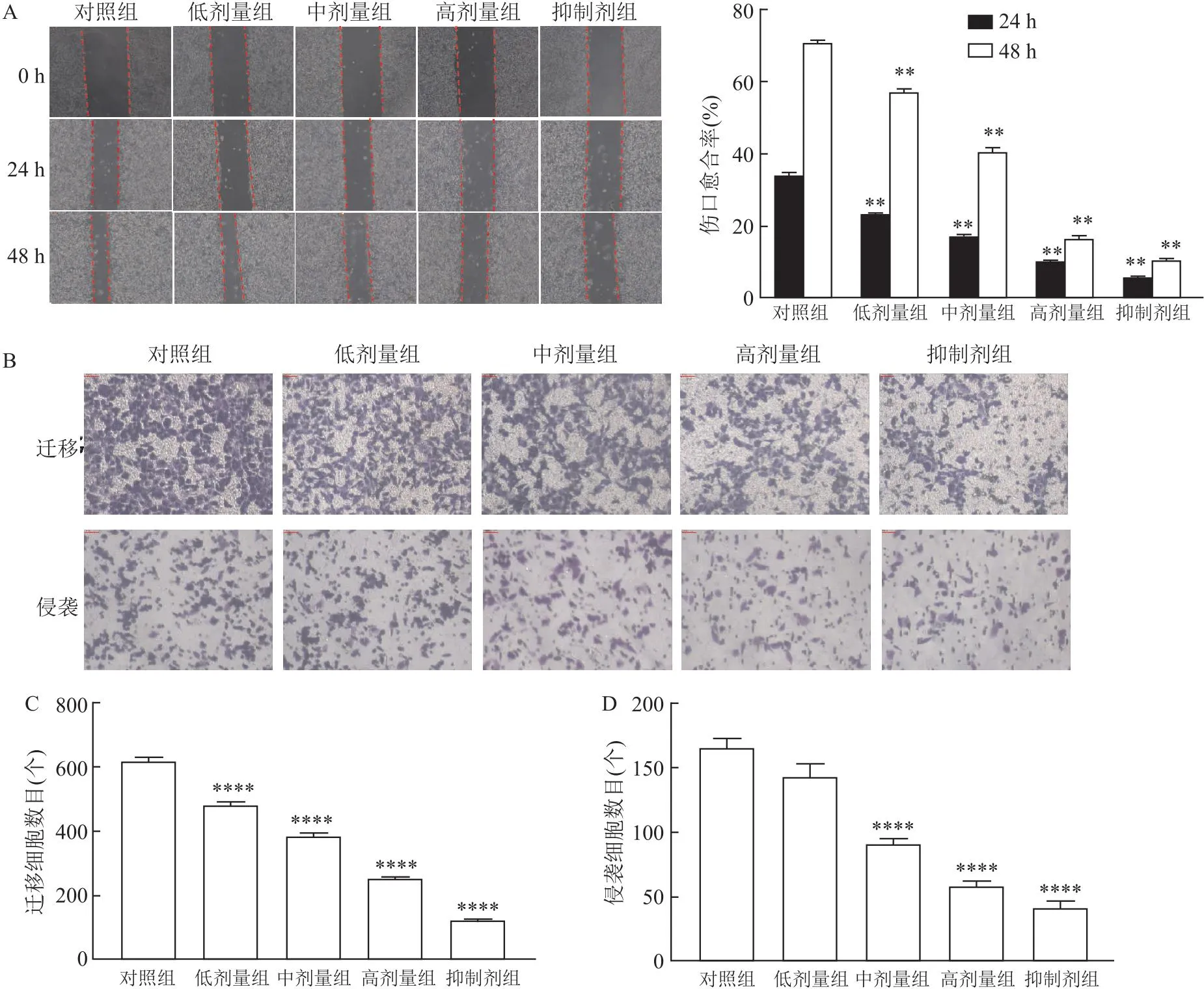
图3 CBG抑制A2780/DDP的迁移和侵袭能力(n=3)
2.4 CBG对A2780/DDP细胞的凋亡和增殖能力影响EdU染色实验结果显示:与对照组相比,随着CBG浓度升高,耐药细胞的增殖率随之降低,其中抑制剂组的细胞增殖率最低,差异有统计学意义(F=190.4,P<0.01)。Hoechst染色实验结果显示:与对照组相比,耐药细胞的凋亡率随着CBG浓度增加而上升,其中抑制剂组的细胞凋亡率最高,差异有统计学意义(F=389.6,P<0.01),见图4。
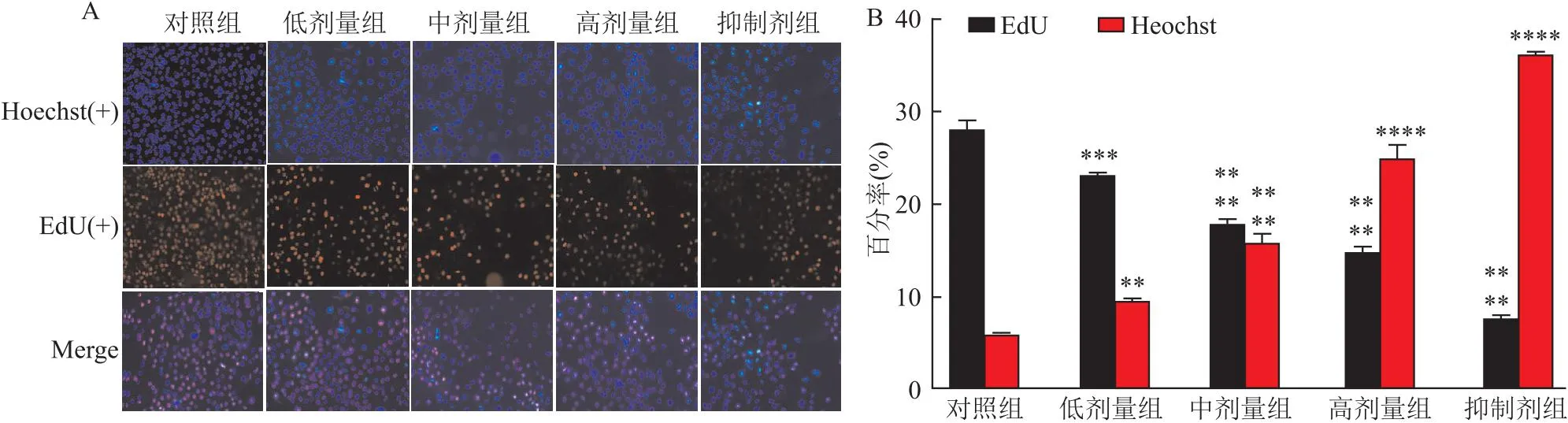
图4 CBG抑制A2780/DDP细胞增殖促进其凋亡(n=3)
2.5 CBG对A2780/DDP细胞PI3K/AKT信号通路以及EMT相关蛋白表达的影响Western blot结果显示(图5):与 A2780细胞相比,对照组(A2780/DDP)细胞的P-PI3K/PI3K(t=8.115,P<0.01)和P-AKT/AKT(t=17.62,P<0.01)的蛋白水平相对比值更高,而E-cadherin(t=4.620,P<0.01)的蛋白表达水平更低,同时N-cadherin(t=6.126,P<0.01)、Vimentin(t=4.001,P<0.01)、Snail(t=17.333,P<0.01)的蛋白表达水平更高。此外,CBG呈浓度依赖性地抑制PI3K、AKT的蛋白磷酸化,与对照组相比,P-PI3K(F=268.5,P<0.01)、P-AKT(F=190.5,P<0.01)、N-cadherin(F=24.02,P<0.000 1)、Vimentin(F=57.65,P<0.01)、Snail(F=87.24,P<0.01)的蛋白表达量减少,其中抑制剂组上述蛋白的表达量最少。但在各浓度组CBG处理后A2780/DDP细胞中的E-cadherin 蛋白表达水平明显升高,在抑制剂组中表达量最多(F=135.8,P<0.000 1)。

图5 卵巢癌A2780/DDP细胞中PI3K/AKT信号通路蛋白和EMT相关蛋白的表达水平的影响(n=3)
2.6 CBG对A2780/DDP细胞PI3K/AKT信号通路以及EMT相关mRNA表达的影响RT-qPCR实验结果显示(图6):CBG呈浓度依赖性地降低PI3K(F=101.1,P<0.01)、AKT(F=558.3,P<0.01)、N-cadherin(F=86.97,P<0.01)、Vimentin(F=105.9,P<0.01)、Snail(F=85.71,P<0.01),增加E-cadherin(F=80.96,P<0.01)的mRNA表达,其中抑制剂组的PI3K、AKT、N-cadherin、Vimentin、Snail的mRNA表达量最少,E-cadherin的表达水平最高,差异有统计学意义。
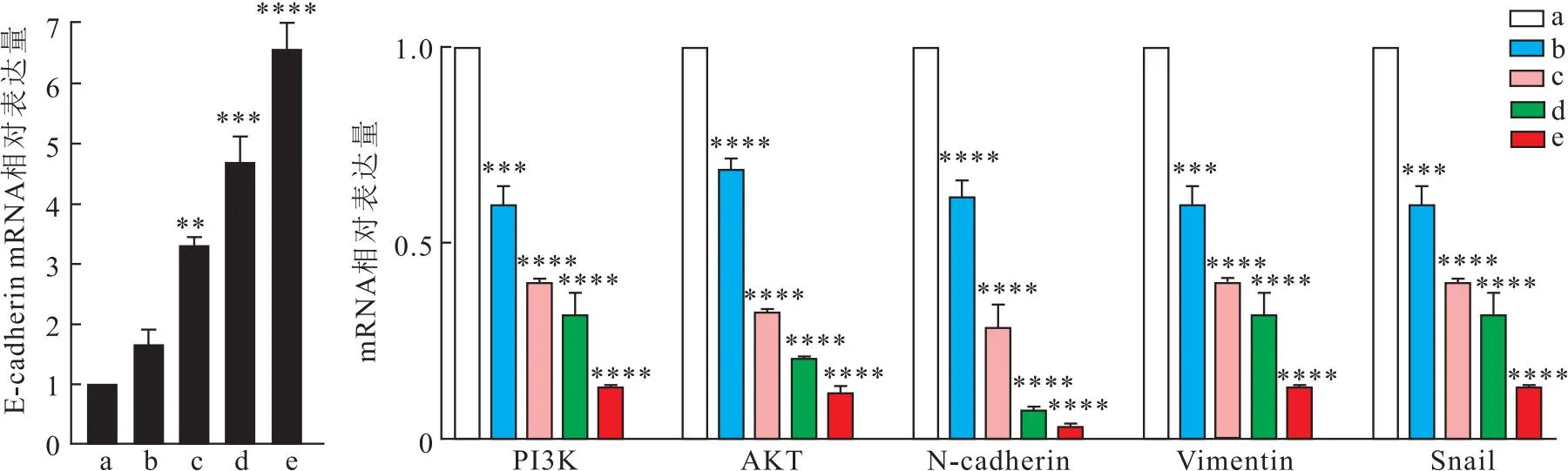
图6 A2780/DDP细胞中PI3K/AKT信号通路和EMT相关mRNA的表达水平的影响(n=3)
3 讨论
CBG能抑制PI3K/AKT通路或EMT发挥抗肿瘤作用,Li et al[6]的研究表明CBG可显著上调HepG2、SMMC-7721和SNU-368细胞中的E-cadherin并下调N-cadherin、Snail、slug和ZEB1的表达水平,从而抑制HepG2荷瘤小鼠的肺转移。CBG不仅具有直接抗肿瘤增殖侵袭的作用,还能逆转肿瘤耐药性,在联合放疗、化疗治疗过程中发挥增敏作用[7]。Liu et al[8]报道了 CBG能抑制鼻咽癌中的 MYH9/GSK3β/β-连环蛋白及下游的肿瘤干细胞特性和 EMT信号,从而显著抑制 EBV-miR-BART22 诱导的DDP耐药性。Su et al[9]研究了CBG的有效成分蟾毒灵对卵巢癌耐药的作用,结果显示蟾毒灵能下调卵巢癌耐药细胞中EMT相关蛋白表达,在体内抑制卵巢癌细胞的生长、迁移和侵袭,从而提高卵巢癌患者对DDP敏感性。此外,临床基础研究证实,CBG进入人体代谢活动,活化后对人体内存在的癌细胞具有很强的直接杀伤能力,目前CBG广泛应用于多种肿瘤疾病的辅助或联合用药治疗,并取得较好的临床治疗效果。林梅英 等[10]的meta分析结果显示CBG注射液联合疗法能提高中晚期非小细胞肺癌患者近期疗效和生存率、改善生活质量、缓解疼痛、降低不良反应。另一项来自袁福建 等[11]的研究显示CBG能够提高肝癌介入治疗效果,改善患者的免疫功能、肝功能储备和生存情况。
PI3K/AKT信号的过度激活与化疗耐药性和癌症转移密切相关,抑制PI3K/AKT信号可恢复卵巢癌细胞对化疗药物的敏感性[12-13],故抑制PI3K/AKT通路的药物可能成为卵巢癌耐药的逆转剂。通过PI3K/AKT信号通路能调控下游EMT,而EMT的发生在卵巢癌耐药过程中起到了重要的作用。Zhao et al[14]研究发现成纤维细胞生长因子受体3可促进表皮生长因子受体磷酸化并激活PI3K/AKT信号转导,从而减少细胞凋亡并促进EMT过程,进而导致卵巢癌细胞对顺铂产生耐药性。
本研究显示CBG处理后能恢复A2780/DDP细胞的顺铂敏感性,降低RI,呈浓度依赖性地抑制耐药细胞增殖、迁移和侵袭能力,促进其凋亡。平板克隆、Transwell、EdU实验结果显示CBG联合PI3K/AKT抑制剂对耐药细胞的抑制作用明显优于单独使用CBG组(P<0.05)。Western blot和RT-qPCR实验结果表明相比于亲本株,A2780/DDP细胞中的PI3K/AKT信号通路和EMT相关蛋白以及mRNA的表达水平更高(P<0.05),提示A2780/DDP细胞中存在PI3K/AKT信号的过度激活和EMT的发生,通过抑制PI3K/AKT信号可降低A2780/DDP细胞的抗药性。此外,与对照组相比,不同浓度 CBG处理组细胞中的P-PI3K/PI3K及P-AKT/AKT的蛋白表达比值、N-cadherin、Vimentin、Snail蛋白和mRNA表达水平呈现随着药物浓度升高而下降的趋势,相反E-cadherin表达量随CBG浓度升高而增加(P<0.05),表明CBG能下调PI3K/AKT信号通路和抑制EMT过程。抑制EMT和PI3K/AKT信号通路的激活是逆转卵巢癌顺铂耐药的两个重要作用靶点,而CBG能抑制EMT和PI3K/AKT信号通路,有望成为卵巢癌铂耐药的有效逆转剂。
综上所述,CBG能诱导人卵巢癌A2780/DDP耐药细胞的凋亡,减弱其增殖、迁移和侵袭能力,其潜在的机制可能与调控PI3K/AKT信号通路和抑制 EMT过程有关。本研究有助于阐明CBG作为卵巢癌铂耐药逆转药物的可行性,同时为CBG逆转卵巢癌铂耐药提供理论依据,以期为卵巢癌临床治疗方案提供新的思路。
