基于Wnt/β-catenin信号通路探讨子宫内膜来源间充质干细胞抑制子宫内膜纤维化的机制
2024-05-10颜望碧
靳 涛,颜望碧,殷 琦
子宫内粘连(intrauterine adhesion,IUA)是阻碍生育的几大难题之一,其由子宫内膜纤维化引起并导致功能性子宫内膜部分或全部丧失[1]。目前认为,子宫内膜修复障碍可能是IUA形成的主要机制[2]。因此,探索恢复子宫内膜的正常组织结构和功能的有效治疗方法,对于改善IUA患者的子宫生育功能具有重要意义。近年来研究[3]强调了干细胞移植作为IUA治疗的替代选择策略。研究[4-5]表明,少量间充质干细胞和子宫内膜干/祖细胞持续存在于子宫内膜中,可促进月经脱落后的子宫内膜再生。因此,自体或同种异体干细胞移植可用于治疗IUA[6]。子宫内膜来源间充质干细胞(endometrial mesenchymal stem cells,eMSCs)位于人类子宫内膜的基底层和功能层,并参与组织重塑,其是维持子宫内膜再生能力所必需的[7]。有研究[8]显示,当eMSCs异种移植到小鼠肾被膜下时,可重建子宫内膜间质,表明其再生潜力。该研究在IUA大鼠模型中评估eMSCs促进子宫内膜再生的能力,并探讨其潜在机制。
1 材料与方法
1.1 主要试剂及仪器DMEM培养基(美国Thermo Fisher Scientific公司),4%多聚甲醛、脂多糖(lipopolysaccharide,LPS)、PKH26亲脂性红色荧光连接染料(美国Sigma公司),抗p-Keratin、抗CK7、Vimentin、N-cadherin、CyclinE、C-myc、Axin2、β-连环蛋白(β-catenin)、抗Ⅰ型胶原、Vimentin和抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(美国Abcam公司),RIPA裂解缓冲液(北京Solarbio公司),BCA蛋白检测试剂盒(美国Thermo Scientific公司),PVDF膜(美国Millipore公司),抗抗ZEB1、E-cadherin (美国CST公司)。FACS Canto Ⅱ流式细胞仪和FACSCount Ⅱ软件(美国BD Biosciences公司),直立显微镜、荧光显微镜(日本Olympus公司),生物成像系统(美国BIO-RAD公司)。
1.2 细胞培养人eMSCs购自杭州易文赛生物技术有限公司。细胞维持在补充有10%胎牛血清的DMEM培养基。每3 d更换一次培养基。在细胞培养物达到汇合后,用EDTA/胰蛋白酶溶液对细胞进行传代培养。第3~5代的eMSCs用于研究其特性[9]。
1.3 流式细胞术使用FACS Canto Ⅱ流式细胞仪表征eMSCs的表面标记。将1×106个细胞用一组抗体染色1 h:异硫氰酸荧光素(FITC)-CD45、藻红蛋白(PE)-CD34、别藻蓝蛋白-CD90、PE-CD74、PE-CD44、PE-CD106和同种型匹配的对照。用PBS洗涤细胞2次。使用FACSCount Ⅱ软件对表面标记表达进行定量。
1.4 PKH26荧光染料标记的骨髓基质细胞为了追踪移植后eMSCs的分布,收集细胞并用PKH26标记。PKH26亲脂性红色荧光连接染料。当eMSCs达到80%汇合时,加入含有1 ml稀释剂C和4 μl PKH26试剂的培养基。然后,将混合物在离心管中混合,并在室温下孵育5 min。随后,加入2 ml胎牛血清以停止染色。弃去上清液,将细胞重新悬浮在新鲜培养基中。在荧光显微镜下检测PKH26标记的eMSCs。在将细胞移植到大鼠的子宫腔中之前,将细胞维持在生长培养基中。
1.5 实验动物雌性Sprague-Dawley(SD)大鼠购自上海SLAC实验动物有限公司,体质量220~250 g,年龄8~12周。环境温度保持在22~24 ℃,相对湿度为70%~85%,自由进食和饮水。每天08:00-10:00取大鼠阴道涂片观察发情周期。选择发情周期正常的大鼠进行实验。所有大鼠在发情期进行手术,手术前12 h禁食。
1.6 IUA大鼠模型的建立参照文献[10]方法,通过制造由机械损伤和LPS外科缝合组成的双重损伤,建立了IUA大鼠模型。将18只雌性SD大鼠随机分为假手术(Sham)组、Model组和eMSCs组,每组6只。Sham组大鼠在剖腹手术后不接受任何形式的子宫介入手术。在Model组和eMSCs组中,每只大鼠的左侧子宫在剖腹后用机械性子宫内膜损伤和LPS溶液的组合进行处理;右侧子宫未进行任何治疗。将大鼠麻醉,以仰卧位固定在手术台上。在子宫的远端做一个小的纵向切口(长约0.3 cm)。然后用16 G的针刮去子宫内膜。接下来,将0.3~0.5 ml LPS溶液(10 mg/L)缓慢注入子宫腔。30 min后,除去LPS溶液。eMSCs组在模型损伤后立即给予治疗,移植的eMSCs细胞悬液总量为每子宫0.05 ml(2×107细胞/ml)[11];用1 ml注射器将它们注射到子宫浆膜下。在第3周对所有大鼠实施安乐死,收集单侧损伤子宫用于以下实验。
1.7 苏木精-伊红(HE)染色和Masson染色将子宫内膜组织样品在4%多聚甲醛中固定24 h,然后在脱水和透明化后包埋在石蜡块中。将石蜡包埋切片切成4 μm连续切片,并根据常规程序进行HE和Masson染色。使用直立显微镜观察切片。选择3个不同的高倍视野,分别用HE和Masson染色计算子宫内膜腺体数量和纤维化程度。使用Image J对各组的平均比例进行统计分析。
1.8 免疫组织化学染色将样品固定在4%多聚甲醛中并包埋在石蜡中。横向石蜡切片使用二甲苯脱蜡,通过一系列酒精梯度再水合。然后,将切片在3%过氧化氢中孵育30 min以灭活内源性过氧化物酶活性,并与下列一抗孵育2 h:抗p-Keratin(1 ∶200)、抗CK7(1 ∶200)、Vimentin(1 ∶200)和抗α-SMA(1 ∶200)。随后,用抗兔或抗小鼠免疫球蛋白(IgG)二抗处理切片。在高倍显微镜下观察阳性染色细胞的数量,并在5个随机选择的视野中定量。
1.9 蛋白质印迹分析从大鼠子宫组织中提取总蛋白样品,并使用RIPA裂解缓冲液裂解,然后使用无菌剪刀匀浆。在冰上裂解1 h后,将提取物以12 000 r/min离心20 min,然后收集上清液,使用BCA蛋白检测试剂盒测定总蛋白浓度。蛋白质样品(30 μg)在10% SDS-PAGE凝胶上分离,并转移到PVDF膜上。在室温下用5%脱脂奶粉封闭膜1 h,并在4 ℃下与下列初级抗体一起孵育过夜:抗N-cadherin(1 ∶1 000)、CyclinE(1 ∶1 000)、C-myc(1 ∶1 000)、Axin2(1 ∶1 000)、β-catenin(1 ∶1 000)、抗I型胶原(1 ∶1 000)、抗ZEB1 (1 ∶1 000)、抗α-SMA (1 ∶2 000)、抗E-cadherin(1 ∶1 000)、抗Vimentin(1 ∶2 000)。用PBS洗涤膜3次,然后与第二抗体在37 ℃黑暗中孵育1 h。最后,在生物成像系统中使用ECL对蛋白质进行可视化。GAPDH被用作内部对照来标准化目标蛋白质的相对表达。使用Image J软件分析条带的密度。
1.10 统计学处理使用SPSS 25.0软件进行统计分析。所有的统计数据至少重复了3次独立实验,以平均值±标准差表示。两组均数比较采用t检验,三组及以上均数比较采用单因素方差分析。P<0.05认为差异有统计学意义。
2 结果
2.1 eMSCs的体外培养和表型鉴定当eMSCs扩增并传代至第三代,细胞趋于稳定并呈现成纤维细胞样形态,并以螺旋模式排列。然后对eMSCs的成脂和成骨分化进行鉴定,结果表明,在相应的分化培养基中培养3周后,细胞形态由原来的长梭形变为圆形,细胞质中出现大量空泡,茜素红染色显示细胞中出现钙化的细胞外基质,表明eMSCs可以分化为成骨细胞。油红O染色显示细胞内形成脂滴,表明eMSCs可以分化为脂肪细胞(图1A)。通过流式细胞仪检测细胞表面表型。如图1B所示,细胞表面标志物CD44、CD73、CD90和CD105呈阳性表达,而CD34和CD45阴性表达。这些结果与间充质干细胞的特性一致。
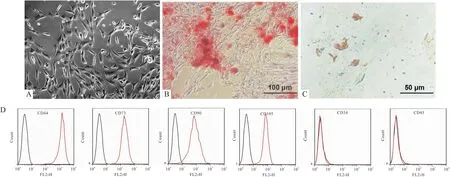
图1 eMSCs的体外培养、分化和鉴定
2.2 PKH26标记eMSCs的迁移为了追踪和确定eMSCs是否能迁移到受损的子宫内膜以修复组织再生,P3代细胞用红色荧光细胞膜染料PKH26标记并移植到IUA模型中。对冰冻OCT包埋的子宫组织切片进行观察,发现随着移植时间的延长,子宫内膜腺体周围分散的红色荧光分布增加。表明eMSCs可迁移到受损的子宫内膜。见图2。
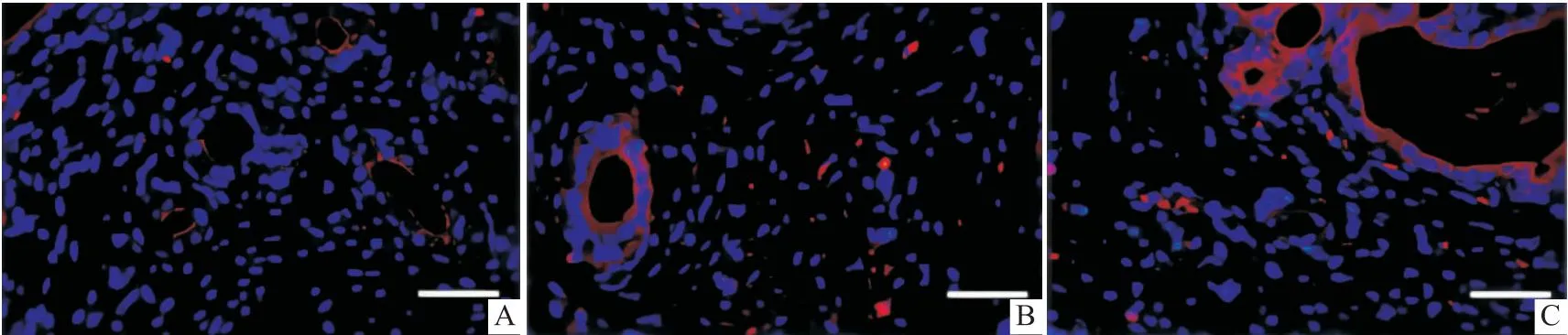
图2 PKH26标记的eMSCs体内示踪 × 100 A:1 d;B:3 d;C:5 d
2.3 eMSCs改善子宫内膜损伤在第3周收集各组子宫组织,观察eMSCs治疗在促进子宫内膜形态和功能方面的作用。HE染色结果显示,Sham组宫腔形态规则,大量单层柱状上皮细胞覆盖子宫和腺腔,上皮细胞结构完整,间质腺体丰富,呈椭圆形。Model组宫腔结构破坏,腺体数量明显减少(P<0.001),结缔组织碎片增多,但在eMSCs治疗后子宫内膜腺体数量显著增加(P<0.001)(图3A、3B)。Masson染色显示Sham组子宫内膜间质中几乎没有蓝色胶原沉积。相比之下,Model组宫腔内形成并积聚大量蓝色胶原纤维,形成明显的粘连带,但在eMSCs治疗后纤维化面积的比例显著降低,胶原纤维排列有序(图3A、3C)。三组在子宫内膜腺体数量和子宫内纤维化面积的比例存在显著差异(F=35.47、25.32,P<0.001)。
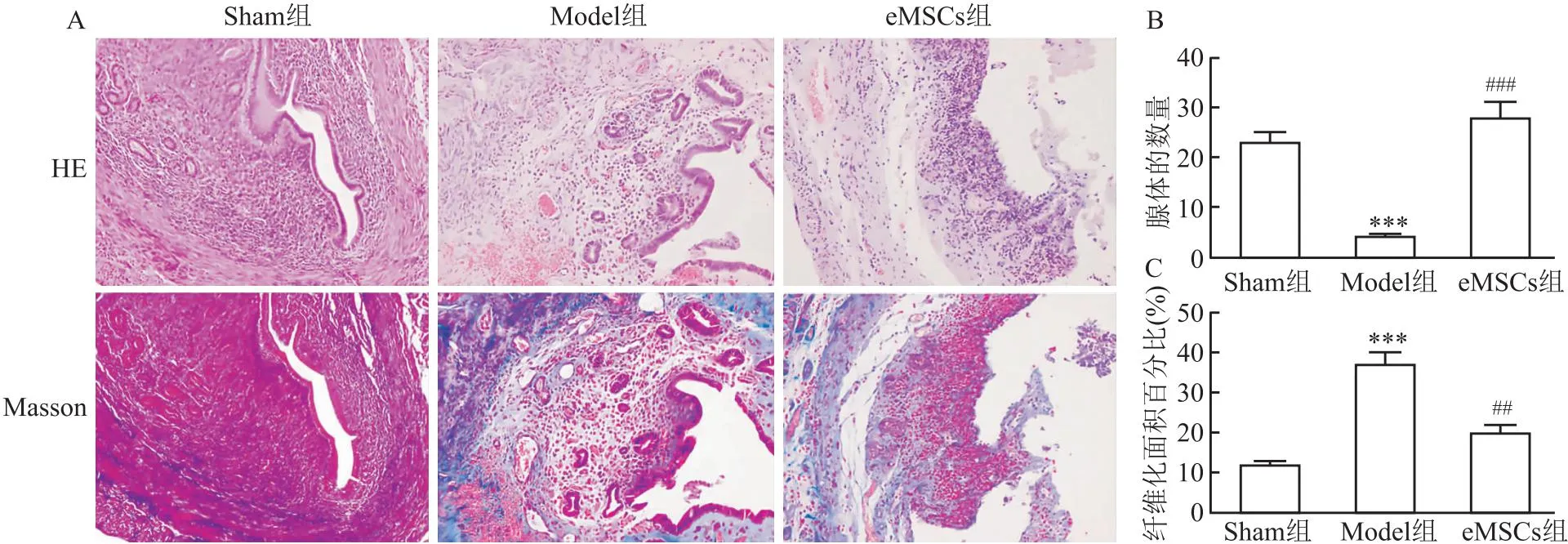
图3 eMSCs对子宫内膜形态恢复的影响
2.4 eMSCs减少子宫内膜纤维化三组在I型胶原和α-SMA的表达水平存在显著差异(F=14.56、24.71,P<0.001);与Sham组相比,Model组中I型胶原和α-SMA蛋白的表达水平显著增加(P<0.05),但在eMSCs组中I型胶原和α-SMA蛋白的表达水平均显著减少(P<0.05)(图4A)。同时,免疫组织化学染色显示,α-SMA的表达在Model组中显著增加,纤维化程度加重,而在eMSCs组中降低(图4B、4C)。此外,通过免疫组织化学染色评估了p-Keratin的表达,一种腺上皮标志物。如图4B所示,与Sham组相比,Model组中p-Keratin阳性染色显著增加(P<0.05),并且eMSCs组中p-Keratin阳性染色较Model组进一步增加(P<0.05)(图4C)。
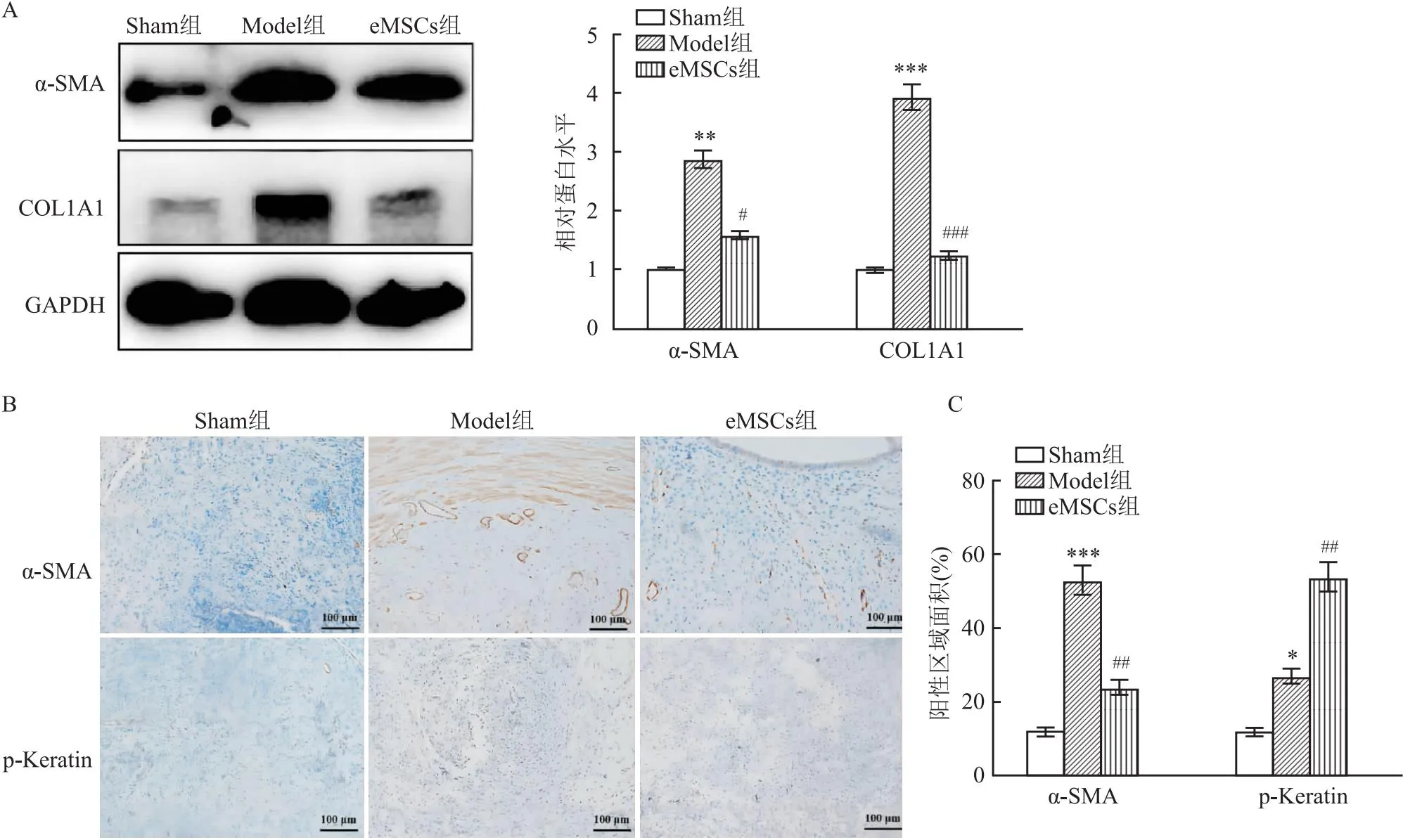
图4 eMSCs治疗后子宫内膜纤维化的变化
2.5 eMSCs抑制EMT的发生三组在N-cadherin、Vimentin、ZEB1和E-cadherin的表达水平存在显著差异(F=12.83、21.37、15.60、14.49,P<0.001);在Model组中,N-cadherin、Vimentin和ZEB1的表达显著增加,而E-cadherin的表达减少。然而,在eMSCs组中,上述分子蛋白质的变化完全相反(图5A)。为了进一步验证eMSCs治疗对EMT的影响,进行免疫组织化学染色以分析CK7和Vimentin在子宫腔中的丰度和分布。结果显示Model组中CK7几乎不表达,而Vimentin表达显著升高。在eMSCs治疗后,CK7表达显著增加,并且主要位于腺体和周围组织中,而Vimentin的表达减少,并且主要位于子宫内膜间质中(图5B、5C)。
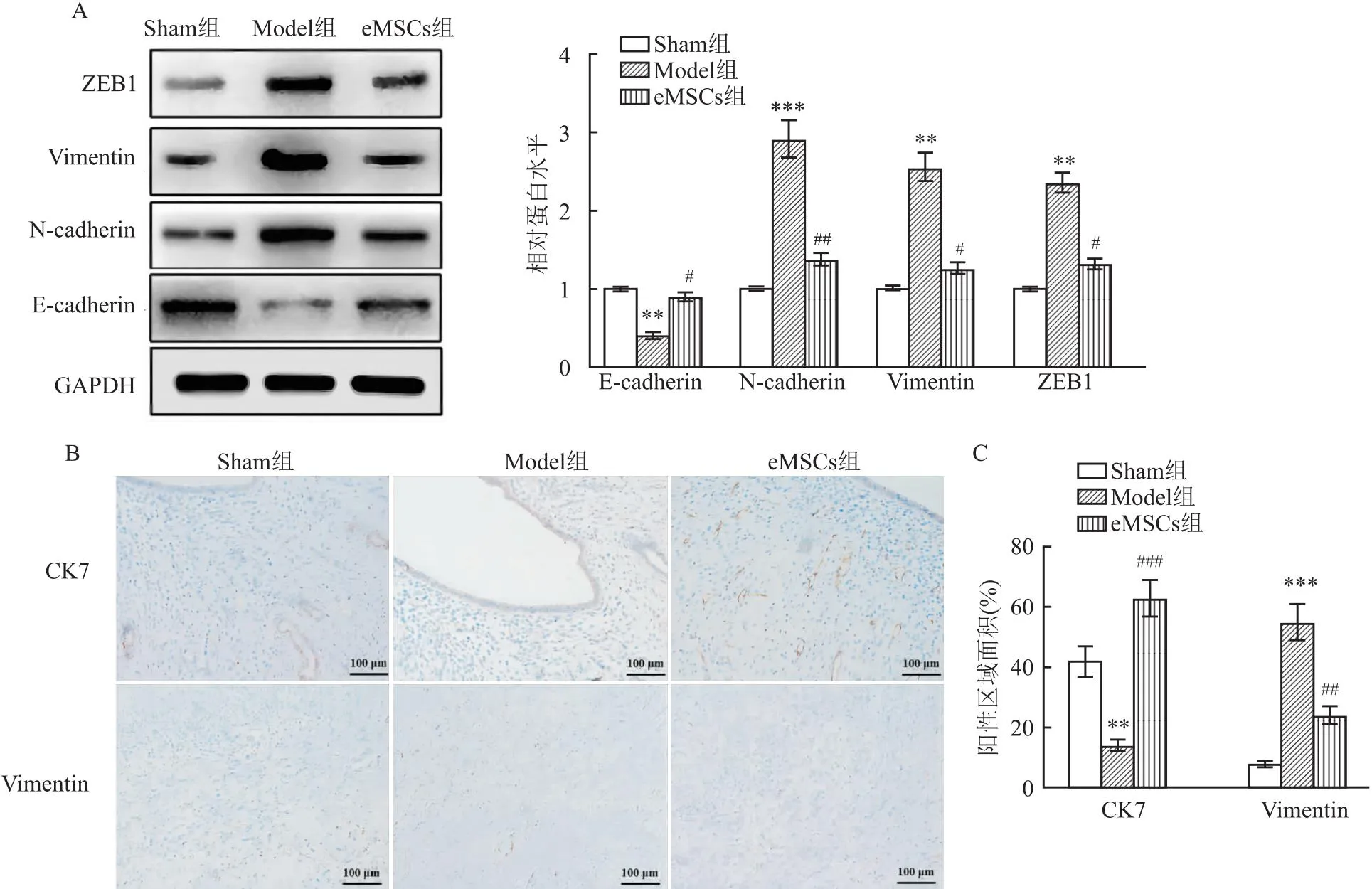
图5 eMSCs抑制EMT的发生
2.6 eMSCs治疗对Wnt/β-catenin通路蛋白表达的影响三组在β-catenin、C-myc和CyclinE的表达水平存在显著差异(F=10.96、13.16、8.72,P<0.001);与Sham组相比,Model组β-catenin和C-myc表达增加(P<0.05)。与Model组相比,eMSCs组中CyclinE、β-catenin和C-myc表达增加(P<0.05),见图6。
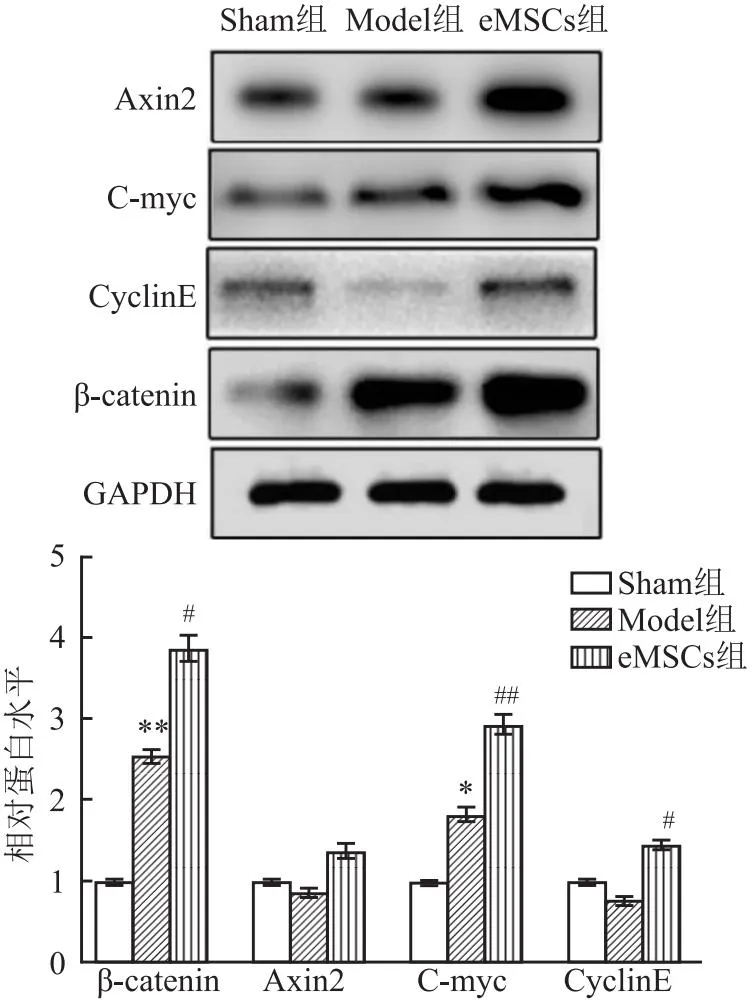
图6 Wnt信号通路核心分子在子宫内膜的表达
3 讨论
IUA的常见治疗方案包括宫腔镜粘连松解术和激素治疗。尽管IUA的治愈率有所提高,但复发率仍然很高,治疗仍然是一个挑战[12]。据报道,子宫内膜的再生和修复依赖于基底层干细胞的增殖和分化[10]。最近,用间充质干细胞理论治疗IUA引起了广泛关注。研究[13]表明,eMSCs可以迁移到子宫腔的损伤区域以促进子宫内膜再生。PKH26是一种简单有效的体内示踪标记技术,可以追踪MSC的迁移和分布。本研究将PKH26标记的eMSCs移植到IUA模型的子宫腔中,发现eMSCs主要位于子宫内膜腺体和周围基质中,表明eMSCs可能分化为上皮细胞,促进受损子宫内膜修复。此外,随着移植时间的延长,eMSCs逐渐增加。这些结果表明,eMSCs可能参与促进子宫内膜修复,这与相关研究[14]结果一致。
细胞疗法是临床医学的一个新兴领域。许多成人干细胞或多能细胞衍生物正应用于治疗慢性和退行性疾病的临床试验中,最常见的是骨髓间充质干细胞,其次是干细胞[4]。尽管用于细胞治疗的间充质干细胞有很多来源,但用于子宫内膜修复的研究很少。证据表明,eMSCs可能为子宫内膜修复提供一种改进的治疗选择。eMSCs是具有高增殖潜力的小群体,其能分化成大的腺样结构,并能在常规活检中轻易获得[15]。先前研究[16]显示,皮下筋膜缺损模型大鼠接种了eMSCs后,缺损部位血管分布密度更高,并在接种细胞的周围形成卷曲的、更有组织的胶原纤维沉积,表明eMSCs可能促进生理胶原的产生,这有助于生物力学性能的改善。在体外,eMSCs可分化为表达平滑肌-肌球蛋白重链的平滑肌细胞和产生胶原的成纤维细胞,伴随着SUSD2表达的下调[17]。成纤维细胞和平滑肌细胞是再生人阴道壁以及合成和组织细胞外基质的理想细胞类型。本研究显示,在IUA大鼠模型中施用eMSCs明显增加了子宫内膜腺体的数量并降低了子宫内膜纤维化的程度,这与以前的研究[11]结果一致,表明eMSCs治疗可以通过减少子宫内膜纤维化来促进子宫内膜修复。因此,eMSCs移植可用于治疗大鼠子宫内膜损伤。在未来的研究中,将继续深入探讨如何提高eMSCs在子宫内膜修复中的利用率,以更好地促进eMSCs迁移和分化为子宫内膜上皮细胞。
IUA最重要的病理特征是子宫内纤维化[18]。纤维连接蛋白、I型胶原和α-SMA是纤维形成的特异性标志,与细胞纤维化密切相关。在目前的研究中,这些标志物的表达在eMSCs治疗组中显著降低,表明eMSCs抑制了纤维化的进展,并有助于子宫内膜上皮的修复。在IUA期间,EMT总是伴随着纤维化[19]。因此,本课题组还探讨了eMSCs对EMT的调节作用,结果表明eMSCs治疗组上皮标志物的表达增加,间质标志物的表达减少,表明eMSCs可以通过逆转EMT的发生促进上皮再形成。先前的研究[20]表明,Wnt/β-catenin信号通路与子宫内膜纤维化中的EMT密切相关。因此,本研究探讨了Wnt信号在eMSCs移植治疗IUA中的作用和机制。在eMSCs组IUA大鼠模型中,在子宫组织中检测到Wnt信号传导中关键蛋白的表达。
