METTL3通过mRNA m6A甲基化促进类风湿关节炎滑膜成纤维细胞增殖、迁移及分泌炎症因子
2024-05-10蒋扬青沈瑞明李国铨徐逢皇
李 娟,蒋扬青,沈瑞明,李国铨,王 敏,徐逢皇
类风湿关节炎(rheumatoid arthritis, RA)是一种以侵袭性对称性多关节炎为主要临床表现的自身免疫性疾病,RA关节病理特征是滑膜增生、血管翳形成,表现为滑膜成纤维细胞(synovial fibroblast,SF)类瘤样增生、浸润软骨和骨,并导致关节破坏[1]。目前,我国RA的发病率约为0.34%,3年致残率达70%,每10年死亡的总体危险增加1.3~2倍,且患者出现心血管疾病的风险显著增高[2],给个人、家庭和社会带来沉重的经济负担。迄今RA的发病机制尚未明确,SF是RA疾病进展最主要的效应细胞[3],深入研究病理状态下SF表型发生变化的机制、寻找可能干预的靶点将对未来开发潜在的治疗药物具有重大意义。研究[4-6]显示表观遗传学的异常可导致类风湿关节炎滑膜成纤维细胞活化及炎症反应的发生,表现为异常增殖,具有侵袭性,破坏软骨和骨。mRNA腺嘌呤N6位甲基化(N6-methyladenosine,m6A)是高等真核生物基因转录后mRNA最主要的修饰[7],m6A是否参与RA-SF表型的改变及其中的调节机制尚未明确。该研究以RA关节滑膜组织、滑膜成纤维细胞为研究对象,采用免疫组化、酶联免疫吸附试验、流式细胞术、基因过表达及敲低等技术探讨METTL3对滑膜细胞增殖、迁移及分泌细胞因子的作用及机制。
1 材料与方法
1.1 临床资料选取2020年1月-2021年12月海南医学院第一附属医院风湿免疫科及关节外科收治的行关节置换或关节镜下滑膜切除术的RA及骨关节炎(osteoarthritis, OA)患者各25例,两组患者年龄、性别比例差异无统计学意义。RA患者符合1987年美国风湿病协会或2010年美国风湿病协会和欧洲抗风湿联盟发布的分类标准。本研究经过医院伦理委员会的批准[批准号:2020(科研L)第(114)号)],所有患者均签署知情同意书。
1.2 方法
1.2.1主要试剂及仪器 兔抗METTL3单克隆抗体(ab195352)、鼠抗人METTL14单克隆抗体(ab220030)、兔抗WTAP单克隆抗体(ab195380)、兔抗ALKBH5单克隆抗体(195377)、m6A RNA甲基化定量试剂盒(ab185912)购自英国Abcam公司;抗兔IgG过氧化物酶(31460)、抗鼠IgG过氧化物酶(32430)购自美国赛默飞公司;STM2457(HY-134836,MedChemExpress公司),TRIzol试剂(A33250)、转染试剂Lipofectamine 3000(L3000001)购自美国Invitrogen公司;细胞计数试剂盒-8(FY600001)购自弗元生物公司;凋亡试剂盒(22839)购自AAT Bioquest公司; 5×PrimeScript RT Master Mix(RR036A)、TB Green qPCR Premix Ex Taq II(RR820Q)购自TAKARA公司;METTL3-siRNA及METTL3-pcDNA3.1购自上海吉玛制药技术有限公司。
NanoDrop 2000分光光度计(nd2000)、Pikoreal 96 real-time PCR系统(PikoReal)、iBright CL750 成像系统(iBright CL750)购自美国赛默飞公司。
1.2.2RA滑膜成纤维细胞的分离培养及分组 RA患者滑膜组织中加入RPMI 1640洗涤,解剖剪锐性切碎。用4 mg/ml I型胶原酶的RPMI 1640消化37 ℃孵育120 min。收集细胞悬液,经细胞滤网过滤,反复离心洗涤,重悬,接种到培养瓶中培养。取P3代SFs制细胞爬片,细胞免疫组化检查抗原Vimentin和CD68的表达水平。对滑膜细胞分别转染针对METTL3-siRNA(si-METTL3组)、METTL3-pcDNA3.1(hi-METTL3组)及阴性对照(MOCK组),以及给予STM2457(METTL3抑制剂) 10 μmol/ml干预组。分别在细胞培养的12、24、48 h检测每组细胞的增殖活性、凋亡比例、迁移能力及培养液上清液白介素-6 (interleukin-6, IL-6)、白介素-17A (interleukin-17A, IL-17A)、 肿瘤坏死因子-κB活化受体配体(receptor activator of nuclear factor-kappa B ligand, RANKL)、骨保护素(osteoprotegerin, OPG) 的浓度。
1.2.3m6A检测 使用m6A RNA甲基化定量试剂盒检测总RNA中的m6A水平。根据实验操作步骤,使用TRIzol试剂提取滑膜组织中总RNA。分别加入200 ng总RNA、捕获抗体溶液和检测抗体溶液,用比色法测量每个孔在450 nm的吸光度,根据标准曲线定量m6A水平。
1.2.4免疫组化检测甲基转移酶样3 (methyltransferase-like 3, METTL3)、甲基转移酶样14 (methyltransferase-like 14, METTL14)、肾母细胞瘤 1 相关蛋白(Wilms′tumor 1-associating protein,WTAP)、AlkB 同系物5(AlkB homologue 5,ALKBH5)的表达 滑膜组织浸泡于10%的多聚甲醛中24 h后石蜡包埋。石蜡块切片(5 μm)后进行苏木精-伊红(HE)染色,免疫组化检测METTL3、METTL14、WTAP、ALKBH5表达。石蜡切片干燥、脱蜡和水合、抗原修复、蛋白封闭后,加入特异性一抗进行孵育,4 ℃过夜,加入二抗孵育2 h后显色。显微镜下观察目的蛋白表达情况。将免疫组化图片输入Image J软件中计算阳性细胞数占比。
1.2.5细胞转染 小干扰RNA转染:METTL3 siRNA的序列为5′-GUCAGUAUCUUGGGCAAAUTT-3′(正向)和5′-AUUUGCCCAAGAUACUGACTT-3′(反向)。在6孔板中培养滑膜成纤维细胞(3.0×105/孔),按照操作流程使用转染试剂Lipofectamine 3000转染1 μg小干扰RNA,RT-qPCR和Western blot验证METTLE转染后mRNA及蛋白的表达。质粒转染:在6孔板中培养滑膜成纤维细胞(3.0×105/孔),按照操作流程使用转染试剂Lipofectamine 3000转染1 μg METTL3-pcDNA3.1,RT-qPCR和Western blot验证METTLE转染后mRNA及蛋白的表达。
1.2.6CCK-8法检测细胞增殖 原代RA滑膜细胞在96孔培养板(每孔6 000个细胞)中培养,每组分别在培养12、24、48 h,加入10 μl CCK-8溶液,并共培养1.5 h。用酶标仪在450 nm下测试吸光度值。
1.2.7流式细胞术检测细胞凋亡 在6孔板中培养滑膜成纤维细胞(2.0×105/孔),各组分别在培养12、24、48 h收集细胞,采用凋亡试剂盒对细胞进行染色,使用流式细胞仪进行细胞凋亡检测。
1.2.8划痕实验检测细胞迁移 4组滑膜成纤维细胞分别培养在6孔板中(1.0×105/孔),用10 μl移液管尖端在每个孔的单细胞层中间刮划一痕,PBS洗涤未附着的细胞,每组分别在培养12、24、48 h,用4%多聚甲醛固定细胞,用0.1%结晶紫染色后使用显微镜进行观察。
1.2.9RT-qPCR检测 为检测METTL3 mRNA表达,首先根据操作说明使用TRIzol试剂提取总RNA,使用NanoDrop 2000分光光度计测量浓度。使用5×PrimeScript RT Master Mix通过反转录获得互补DNA(cDNA)。在实验说明的基础上利用TB Green qPCR Premix Ex Taq Ⅱ制备反应混合物。反应在Pikoreal 96 real-time PCR系统中进行,使用以下条件检测mRNA水平:95 ℃持续10 min,然后在95 ℃下循环40次持续15 s,60 ℃持续60 s。使用2-ΔΔCT方法计算相对表达,以β-actin mRNA表达作为内参。
1.2.10Western blot检测 等量(约0.2 g)的组织或计数细胞在RIPA缓冲液(0.1 g/ml)中匀浆,在4 ℃下以12 000 r/min离心20 min,收集上清液蛋白质。测量蛋白浓度后,在1×SDS缓冲液中煮沸(100 μl /106cells)5 min。在10%SDS-PAGE凝胶上加等量(50 μg)蛋白,分离后转移到PVDF膜,之后分别与特异性抗METTL3(1 ∶2 000)、抗METTL14(1 ∶5 000)、抗WTAP(1 ∶5 000)、抗ALKBH5(1 ∶2 000)、二抗(1 ∶5 000)一起孵育后用蛋白印迹成像系统检测。
1.2.11ELISA法检测细胞培养上清液IL-6、IL-17A、RANKL、OPG浓度 在6孔板中培养滑膜成纤维细胞(2.0×105/孔),各组分别在培养12、24、48 h收集细胞培养液上清液,按照人IL-6、IL-17A、RANKL、OPG ELISA试剂盒操作步骤进行检测。

2 结果
2.1 RA和OA滑膜组织m6A含量RA滑膜组织m6A含量显著高于对照组(OA组),差异有统计学意义(图1),说明RA滑膜组织m6A甲基化水平增高。
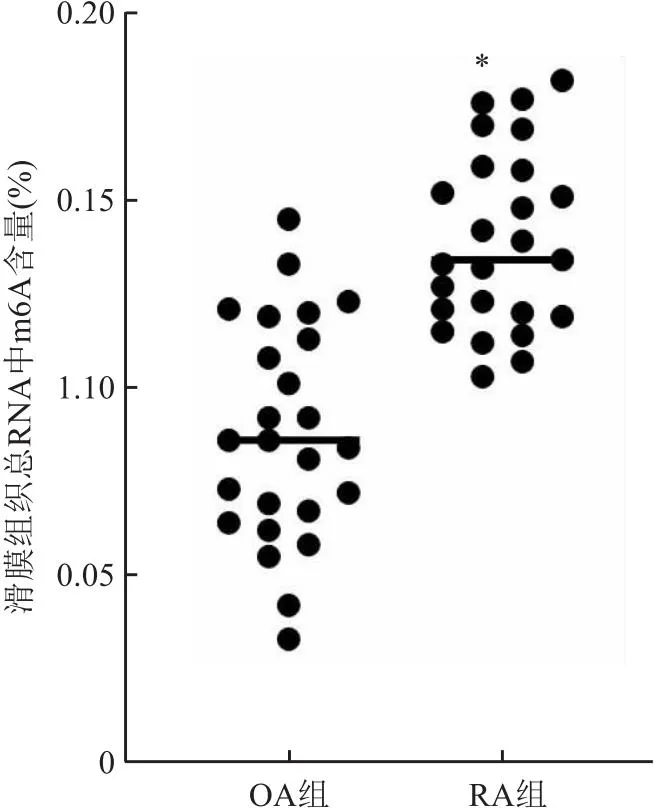
图1 RA与OA滑膜组织m6A的含量
2.2 RA及OA滑膜组织中METTL3、METTL14、WTAP及ALKBH5的表达与OA滑膜组织相比,免疫组化(阳性细胞数占比,图2)及Western blot(图3)结果显示RA滑膜组织METTL3的表达显著高于OA组(P<0.05),METTL14、WTAP及ALKBH5的表达在两组间差异无统计学意义(P>0.05)。

图2 免疫组化检测RA及OA滑膜组织中METTL3、METTL14、WTAP及ALKBH5的表达 ×200
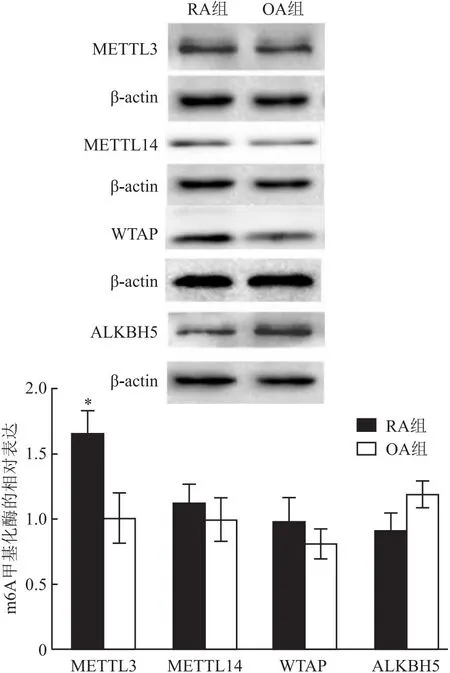
图3 Western blot检测RA及OA滑膜组织中METTL3、METTL14、WTAP、ALKBH5的表达
2.3 RA滑膜细胞培养及鉴定体外培养RA滑膜成纤维细胞,P3时呈较为均一的长梭形细胞(图4)。流式细胞术检测体外培养滑膜样成纤维细胞:CD68-CD14-CD90+(图5)。
图4 体外培养RA滑膜细胞 ×400

图5 流式细胞术检测体外培养滑膜样成纤维细胞
2.4 METTL3促进RA滑膜成纤维细胞增殖、迁移及分泌炎症因子与阴性对照相比,RT-qPCR及Western blot显示si-METTL3组滑膜成纤维细胞中METTL3表达显著降低,hi-METTL3组滑膜成纤维细胞中METTL3表达显著增高,见图6A-6C。
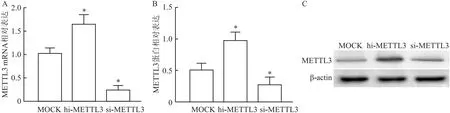
图6 RT-qPCR及Western blot检测si-METTL3及hi-METTL3细胞METTL3的表达
2.4.1METTL3对RA滑膜成纤维细胞增殖的作用 细胞培养12、24 h,四组细胞增殖差异无统计学意义,48 h后,hi-METTL3组滑膜成纤维细胞增殖能力显著高于对照组(P<0.05),si-METTL3组和STM2457组滑膜成纤维细胞增殖能力显著低于对照组(P<0.05),见图7。

图7 CCK-8法检测四组滑膜成纤维细胞12、24、48 h增殖能力
2.4.2METTL3对RA滑膜成纤维细胞凋亡的作用 hi-METTL3组滑膜成纤维细胞凋亡比例低于对照组,差异无统计学意义(P>0.05);si-METTL3组和STM2457组细胞凋亡比例高于对照组,差异无统计学意义(P>0.05),见图8。

图8 流式细胞术检测四组滑膜成纤维细胞凋亡比例
2.4.3METTL3对RA滑膜成纤维细胞迁移的作用 滑膜成纤维细胞培养12 h开始,hi-METTL3组细胞迁移能力显著高于对照组,si-METTL3组及STM2457组细胞迁移能力显著低于对照组,并持续至24 h和48 h,差异有统计学意义(P<0.05),见图9。
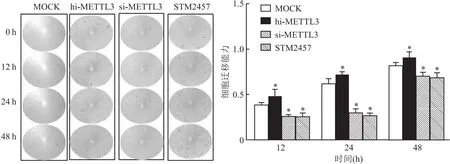
图9 划痕实验检测四组滑膜成纤维细胞 12、24、48 h细胞迁移能力
2.4.4METTL3对RA滑膜成纤维细胞分泌细胞因
子的作用 滑膜成纤维细胞培养48 h后上清液IL-6的浓度在si-METTL3组和STM2457组均显著低于对照组,hi-METTL3组显著高于对照组(P<0.05)。滑膜成纤维细胞培养24 h后,培养上清液中RANKL的浓度在hi-METTL3组显著高于对照组,并持续至48 h;培养48 h后,hi-METTL3及STM2457组上清液RANKL的浓度显著低于对照组(P<0.05)。滑膜成纤维细胞培养24、48 h时,hi-METTL3组细胞培养上清液OPG浓度显著低于对照组(P<0.05),si-METTL3组及STM2457组浓度显著高于对照组(P<0.05)。四组间在各培养时间点IL-17A浓度无显著差异(图10)。
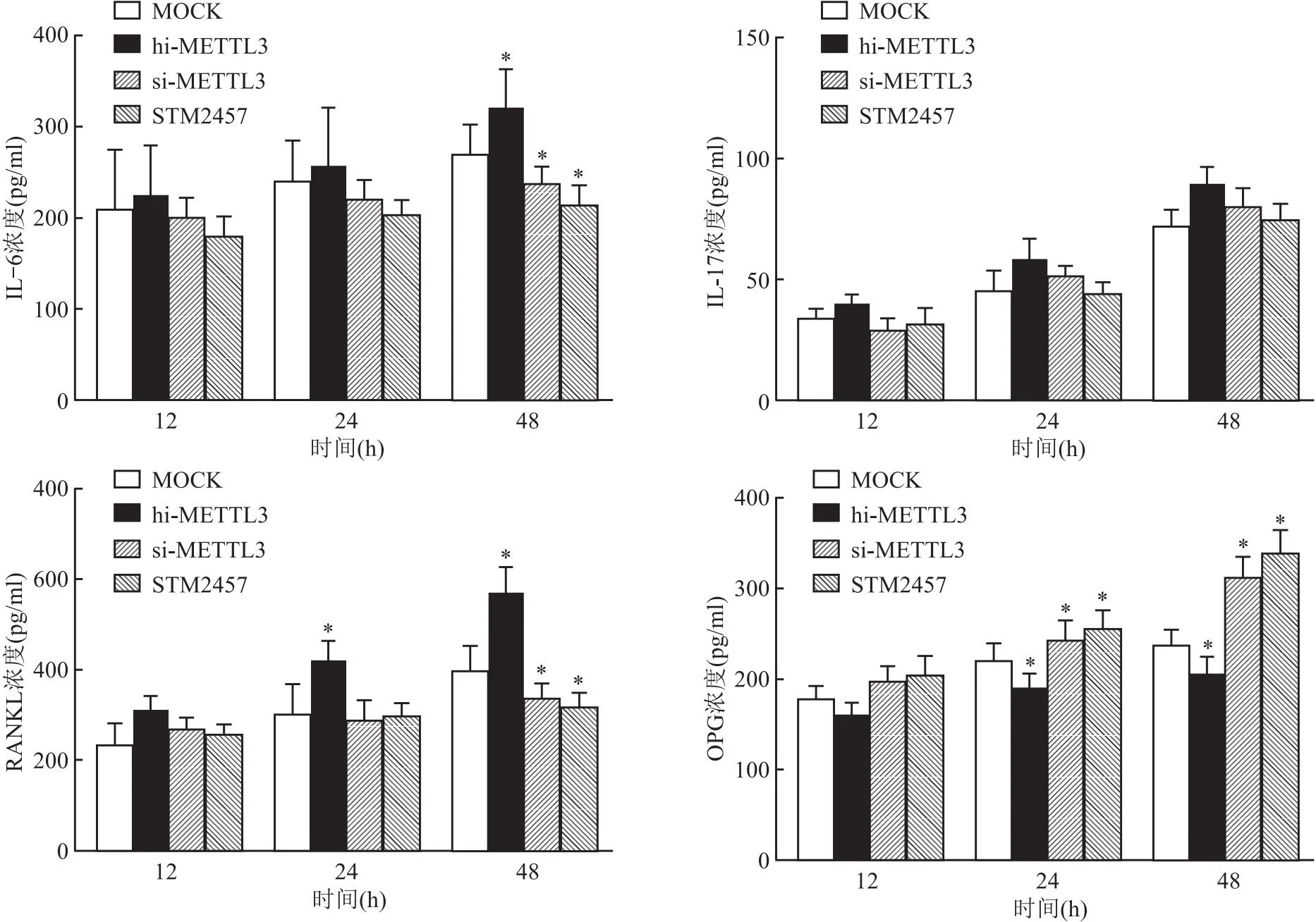
图10 ELISA法检测四组滑膜成纤维细胞12、24、48 h细胞培养上清液中IL-6、IL-17A、RANKL、OPG浓度
3 讨论
RA是一种慢性自身免疫性疾病,如未及时正规治疗可导致关节畸形、残疾,严重影响患者的生活质量。类风湿关节炎的病因目前尚未明确,SF是RA疾病进展最主要的效应细胞,在生理条件下,SF是滑液和滑膜基质中分子成分的关键制造者,保证关节的平衡与功能优化。在RA病理条件下,滑膜衬里层SF可由正常的1~3层增至15层甚至更多层细胞。SF表现为失去接触抑制的非依赖性生长,具有异常的增殖和侵蚀特性[8]。
表观遗传调控是以独立于基因组序列的方式,在核苷酸序列不发生改变的情况下调控基因的表达,并影响蛋白功能等重要的生命过程。研究[9]显示表观遗传学异常可导致RA-SF活化及炎症反应的发生,表现为异常增殖,具有侵袭性,破坏软骨和骨。mRNA m6A甲基化是高等真核生物基因转录后mRNA最主要的修饰。mRNA m6A修饰由甲基转移酶复合体对mRNA进行甲基化,去甲基化酶移除甲基,RNA结合蛋白与其特异性结合后可读取相关信息。其中甲基转移酶复合体是由METTL3、METTL14和WTAP组成。ALKBH5作为去甲基酶从而实现去甲基化[7]。因正常关节滑膜组织较难获得,因此本课题组研究了RA和OA患者关节滑膜组织RNA m6A甲基化情况,发现RA滑膜组织RNA m6A甲基化程度显著增高,进一步研究了参与RNA m6A甲基化的相关甲基化酶及去甲基化酶,发现METTL3在RA滑膜组织中的表达显著增高。接下来本课题组对SF进行体外培养,发现与对照组相比,过表达METTL3组SF细胞RNA m6A显著增加,细胞增殖活性、迁移能力显著增强[10],细胞凋亡无明显差异;敲低METTL3细胞RNA m6A显著减少,SF细胞增殖活性、迁移能力显著下降[11]。STM2457干预SF后,细胞增殖、迁移的变化与siMETTL3组相似。说明METTL3通过调控SF mRNA m6A甲基化促进SF细胞增殖和迁移。
SF除了具有异常的增殖特性,也能够刺激炎症,更能够直接破坏关节软骨和骨。研究[12]表明SF可分泌一系列细胞因子,对单核巨噬细胞、淋巴细胞和骨细胞发挥多效性作用。RA SF能够产生及(或)应答的炎症介质包括IL-6、IL-17、RANKL、OPG等。IL-6是活化的T细胞和成纤维细胞产生的淋巴因子,是RA的发生发展中重要炎症因子之一[13-14]。IL-17是重要的促炎细胞因子,由T辅助细胞17产生,IL-17能够诱导上皮细胞、内皮细胞、成纤维细胞合成分泌IL-6,从而导致炎症产生[15-16]。RANKL也叫做破骨细胞分化因子,其与受体结合后可激活破骨细胞,促进骨破坏[17-18]。OPG属于肿瘤坏死因子(TNF)受体家族,是RANKL的诱导受体,通过与RANKL的结合减少破骨细胞的产生,发挥骨保护作用[19-20]。本研究显示,与对照组相比,hi-METTL3组滑膜成纤维细胞RNA m6A甲基化程度增加,细胞分泌IL-6、RANKL显著增加、OPG显著减少;si-METTL3组SF RNA m6A甲基化程度显著下降,细胞分泌IL-6、RANKL显著减少,OPG显著增加,说明METTL3调控RNA m6A甲基化后可促进炎症因子IL-6的表达及破骨细胞分化因子RANKL的表达,减少骨保护素OPG的表达,可能会促进骨破坏。各组细胞培养上清液中IL-17A浓度无明显变化,说明METTL3对IL-17A的作用影响小。METTL3对SF合成分泌IL-6、RANKL及OPG的具体调控机制,如蛋白基因转录的影响、mRNA m6A甲基化的区域或位点值得进一步探讨,这也是课题组下一步的研究方向。本研究显示给予METTL3特异性抑制剂STM2457干预后,SF细胞增殖活性、迁移能力显著下降,分泌IL-6及RANKL显著减少,OPG表达显著增加,STM2457作为METTL3特异性抑制剂是未来RA治疗的潜在药物之一,本课题组下一步将对STM2457干预RA动物模型的体内作用进行研究。
总之,本研究表明RA滑膜成纤维细胞mRNA m6A甲基化显著增加,且主要为METTL3所调控。METTL3可通过促进RA-SF细胞mRNA m6A甲基化,促进SF增殖和迁移,同时促进SF分泌IL-6及RANKL。METTL3特异性抑制剂STM2457是RA治疗的潜在靶点药物,值得后续进一步研究。
