牛新发病毒性传染病及其诊断技术研究进展
2024-05-09孙睿雪李玉铎赵建军
孙睿雪,李玉铎,赵建军
(黑龙江八一农垦大学 动物科技学院,黑龙江大庆 163319)
新发传染病(emerging infectious disease,EID)是由新出现病原体或经变异而获得新生物学特性的已知病原体所引起人或动物的传染性疾病[1]。EID传播途径和致病性表现多样,其病原微生物种类复杂,但大多数病原为病毒。由于发现时间较短、研究不足,人们对其认知有限,无法在疾病流行早期对病原体进行检测和防控,最终导致疫病流行。据统计,近80%人类新发病来源于动物。因此,动物新发动物传染病给全球性公共卫生安全带来严重威胁。
我国幅员辽阔并与多个国家接壤,畜禽及其产品走私入境情况时有发生,存在外来动物传染病和新发传染病传入的风险,对我国畜牧养殖业产生潜在威胁。2011年,以施马伦贝格病为代表的牛新发传染病首次在欧洲牛养殖场、野生鹿群中暴发,其病原为施马伦贝格病毒(Schmallenberg virus,SBV),该病毒可侵害反刍动物的中枢神经系统,导致怀孕母畜流产,患畜的生产性能下降等[2]。该病现已传播至与我国接壤的西亚多个国家,存在传入我国的潜在风险。此外,牛肠道病毒(Bovine enterovirus,BEV)、牛星状病毒(Bovine astrovirus,BoAstV)、牛库布病毒(Bovine kobuvirus,BKV)等引起的牛新发传染病在国内陆续发生,上述肠道病毒不仅导致宿主腹泻,还可引起宿主出现呼吸系统(哮喘、咳嗽和呼吸困难)、神经系统疾病(全身痉挛、角弓反张和脑膜炎)[3-5]。
目前,针对牛新发传染病的诊断多采用传统病原学、血清学、分子生物学检测技术如病毒分离(virus isolation,VI)、酶联免疫吸附试验(enzyme-linked immunosorbent assays,ELISA)、聚合酶链反应(polymerase chain reaction,PCR)等,随着牛新发传染病广泛流行和病毒基因变异,传统诊断技术将难以满足当前对动物新发传染病诊断的快速、敏感和高通量等需求。本文从牛新发病毒性传染病病原学、流行病学及其诊断技术进行了综述,以期为我国上述疫病的防控提供参考。
1 牛新发病毒性传染病及其病原
2011年以来,我国陆续发现8种牛新发病毒,可引起肉牛、奶牛消化和呼吸道传染病(表1)。其中,BoAstV、BKV、牛纽布病毒(Bovine nebovirus,BNeV)和牛诺如病毒(Bovine norovirus,BNoV)均为引起犊牛腹泻病原[4-6];D型流感病毒(Influenza D virus,IDV)为牛呼吸道疾病重要病原[7];BEV和牛环曲病毒(Bovine torovirus,BToV)不仅可引起不同日龄牛腹泻,还可引发呼吸道疾病[3,8]。其中,IDV和BToV均具有血凝素酯酶蛋白(HE),该蛋白通过作为凝集素和受体破坏酶介导与O-乙酰化唾液酸的可逆性附着。因此,它们被视为潜在的人畜共患性病原[9-10]。牛结节性皮肤病病毒(Lumpy skin disease virus,LSDV)可致牛全身皮肤结节,引起牛生产性能下降[11],由LSDV引发的牛结节性皮肤病(Lumpy skin disease,LSD)虽非人畜共患传染病,但它具有高度传染性,对养牛业危害巨大,被世界动物卫生组织(WOAH)列为必须通报的疫病。
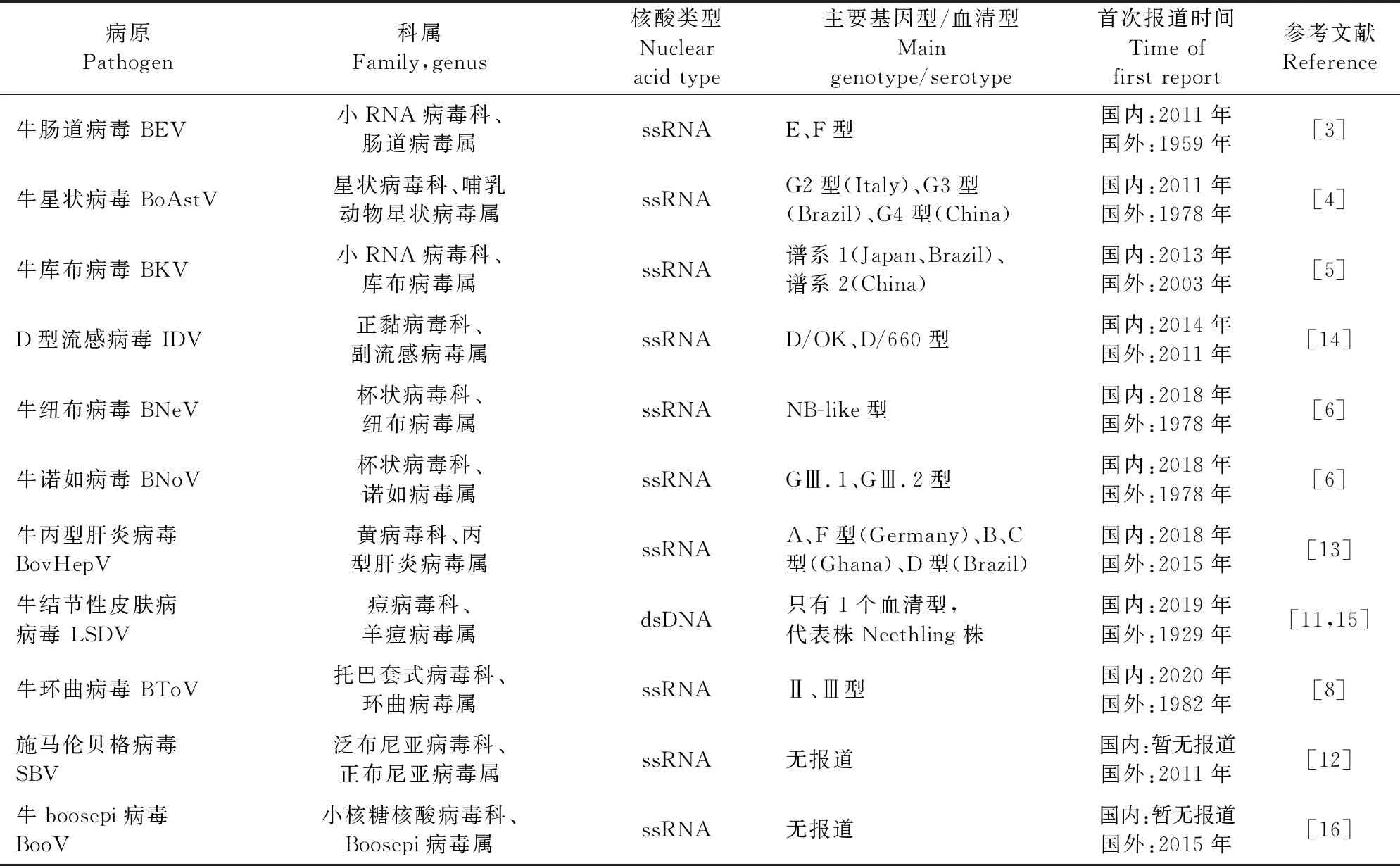
表1 国内外牛新发病毒性传染病病原统计表
2011-2020年,国外科学家先后发现了SBV、牛丙型肝炎病毒(Bovine hepacivirus,BovHepV)、牛boosepi病毒(Bovine boosepivirus,BooV)以及Hayes Yard病毒(Hayes Yard virus,HYV)等引起牛新发传染病的病毒(表1)。SBV为正布尼亚病毒属成员,该属病毒易发生基因重排而使毒力和易感宿主变化[12];BovHepV与人丙型肝炎病毒相似,可造成宿主无明显临床症状的急性和慢性感染,对从事相关行业人员的健康具有潜在威胁[13]。上述病毒不仅影响养牛业的持续性发展,还可能对人类健康带来潜在威胁。
1.1 D型流感病毒
D型流感病毒(IDV)是造成牛呼吸道疾病综合征的病原之一[7]。其基因组由7个节段组成,可编码聚合酶(PB2、PB1、P3)、核蛋白(NP)、血凝素酯酶融合蛋白(HEF)、基质蛋白(M1、CM2)、非结构蛋白(NEP、NS1)。根据IDV HEF基因将其分为D/OK、D/660和D/Japan基因型[17]。
IDV主要宿主为牛,病毒通过直接接触或气溶胶传播,在宿主上下呼吸道进行复制,引起呼吸系统疾病[17]。自2011年Hause B M等[18]从类似流感症状的猪体内分离出首株IDV后,中国、意大利、日本等多个国家均报道该病毒在牛群中广泛流行,山羊、绵羊、马等多个动物种群也可检测到IDV核酸[17]。White S K等[9]对养殖场工作人员血清中IDV抗体进行检测,结果显示抗IDV抗体阳性率为94%(抗体效价≥1∶40),表明IDV对人类健康可能造成威胁,是一种潜在的人畜共患病原体。
1.2 牛结节性皮肤病病毒
牛结节性皮肤病(LSD)于2019年传入我国,其病原LSDV基因组由一个2.4 kb末端重复序列包围的中心编码区组成,其中ORF3、ORF5、ORF8等23个基因与病毒毒力相关,ORF73编码蛋白参与体液免疫[15]。LSDV可引发高度传染性的LSD,患畜临床特征表现为发热、食欲不振、全身皮肤结节、淋巴结肿大、消瘦、产奶量下降以及流产。严重时,口腔、气管、喉和食道黏膜可发展为溃疡性病变[11,19]。LSDV主要通过蚊、蝇等节肢动物叮咬进行传播,也可通过皮肤擦伤、污染的环境传播,其自然宿主为牛、水牛和野生反刍动物,患畜恢复后携带病毒至少3周[15]。
LSD于1929年首次在赞比亚报道,20世纪80年代末传入亚洲。2019年,我国新疆伊犁州首次暴发LSD疫情,该地区养殖密度大且与流行LSD的哈萨克斯坦接壤,推测疫情来源为边境的带毒嗜血虫媒,此次疫情发病率为17.83%、病死率为0.2%[11]。此后不到1年时间,我国福建、江西、广东等临海省区均出现疫情,对我国养牛业造成较大危害。
1.3 牛环曲病毒
牛环曲病毒(BToV)基因组包含2个大的ORF,编码2个非结构蛋白ORF1、ORF2,以及4种结构蛋白。根据其血凝素酯酶(HE)基因序列,BToV可分为3个基因型,其中Ⅱ型和Ⅲ型最为常见[20]。
BToV主要经粪-口传播,也可经呼吸道传播,主要感染3月龄以内犊牛,也可感染成年奶牛,病牛、健康牛均可带毒[8]。目前,BToV已在世界范围内流行,在亚洲、北美洲、非洲、欧洲、南美洲均有报道[8,20]。我国四川、辽宁、山西和河南地区3月龄以内犊牛BToV阳性率为21.73%[20],河南地区奶牛BToV阳性率为4.07%,肉牛为3.06%[8],证实BToV在我国牛群中广泛传播。
环曲病毒与冠状病毒曾被列入同科,两者的HE蛋白具有类似的结构和功能,该蛋白的氨基酸突变可能影响病毒与受体的结合能力、组织噬性从而导致病毒跨物种传播[10]。Ito M等[21]发现日本BToV毒株是原型毒株Breda1与猪环曲病毒的重组毒株,其基因组在ORF1b 3'端和HE基因的3'端存在2个重组断点,与猪环曲病毒基因组相似度达76%。与原型毒株Bredar1相比,现流行的BToV毒株S蛋白和HE蛋白均有氨基酸突变与猪环曲病毒毒株亲缘关系更为密切,表明BToV具有丰富的遗传多样性,具备进化出新基因型毒株的可能[20-21]。
1.4 施马伦贝格病毒
施马伦贝格病毒(SBV)基因组包括3段单股负链RNA,分别称为小(S)、中(M)和大(L)段。S段编码核衣壳蛋白(N)和非结构蛋白(NSs)[2],而N蛋白是SBV病毒粒子中含量最丰富的蛋白,具有很强的免疫原性,可诱导机体产生早期抗体[22],因此被作为该病毒诊断的靶蛋白。
自2011年Hoffmann B等[12]首次在德国感染动物分离到SBV后,荷兰、比利时、英国等欧洲多国均出现施马伦贝格疫情,现已呈由欧洲向亚洲扩散的趋势[2]。施马伦贝格病主要表现为厌食、高热、腹泻和产奶量下降等症状[12],部分导致母畜流产、产死胎和畸形胎[23]。目前,我国尚无该病的报道,但SBV有可能通过库蠓从欧洲、西亚、中亚传入我国,也可能因土耳其-巴基斯坦的非法动物贸易造成跨境传播,给与巴基斯坦接壤的新疆带来较高的传入风险[24]。
1.5 牛Boosepi病毒
2015年,Nagai M等[16]利用病毒宏基因组学技术,首次在腹泻牛粪便中发现牛Boosepi病毒(BooV)并确定其近完整基因组序列。序列分析显示,它具有标准的小核糖核酸病毒基因组结构。基于结构蛋白P1氨基酸序列的系统发育分析显示,该病毒与未分类的中国小核糖核酸病毒亲缘关系密切。该项研究中BooV检出率为23%,证实该病毒已在日本北海道地区流行。2021年,Hause B M等[25]首次在美国腹泻犊牛肠道组织和粪便中检测到BooV,所得毒株21-0305与日本毒株(12-7/2009/JPN、12-38/2009/JPN、12-11/2009/JPN、12-3/2009/JPN)的基因组同源性为86%。目前该病毒只在日本、美国地区有报道。
1.6 Hayes Yard病毒
2020年,Blasdell K R等[26]从澳大利亚北部一公牛血液中分离出一种新型病毒,现将其命名为Hayes Yard病毒(HYV)。该牛患有严重类暂时热疾病并伴有神经系统损伤。HYV具有弹状病毒典型特征,其全基因组序列分析显示,它具有与牛流行热病毒相似的基因组结构。根据病毒L蛋白序列分析结果,HYV与Puchong病毒、贝里马病毒及牛流行热病毒等亲缘关系密切。研究人员通过进一步对该地区收集的牛血清回顾性调查研究显示,2000年采集的血清样本中HYV中和抗体阳性率为65.85%,表明HYV长期流行于澳大利亚北部地区牛群中,对畜牧业具有潜在威胁。
2 诊断技术
目前,国内外用于牛新发病毒性传染病诊断技术主要分为病毒学检测、血清学检测和分子生物学检测技术3类(表2)。
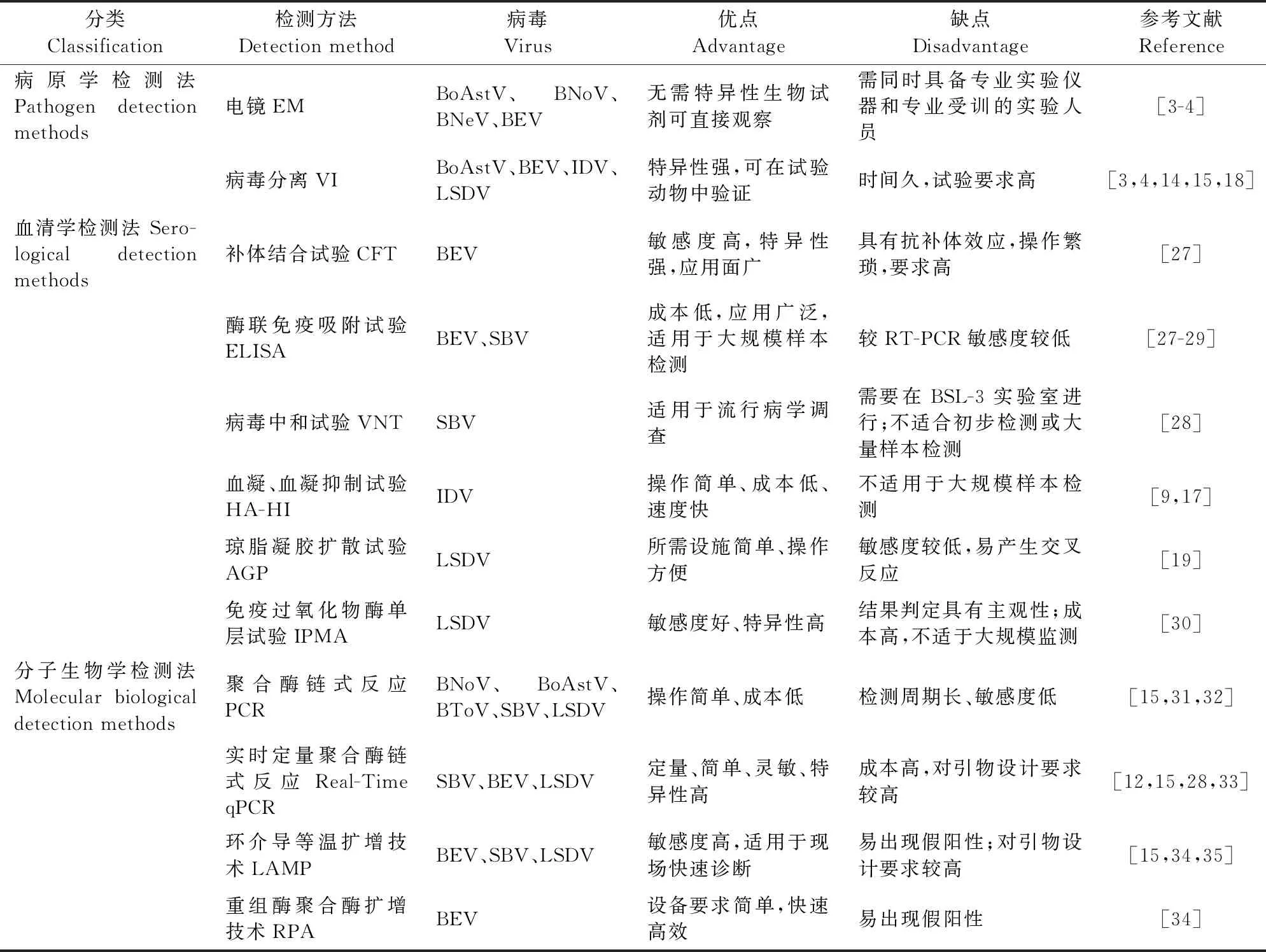
表2 当前牛新发病毒性传染病诊断技术
2.1 病原学诊断
病毒分离(VI)和电镜观察(electron microscopy,EM)是病毒性传染病经典诊断技术。VI通过收集待检测样本处理除菌后接种到病毒易感的细胞、动物等,培养鉴定致病病毒,它是多种病原体检测的“金标准”[18]。研究人员通过EM首次在犊牛腹泻粪便样本中鉴定出BoAstV、BNoV、BNeV,并利用原代牛肾细胞成功分离培养BoAstV[4]。李英利等[3]将犊牛粪便样本处理后接种MA104细胞,出现细胞病变后利用超薄切片技术观察到病毒粒子,经后续检测证实为我国首株BEV。
EM和VI虽为牛新发病毒研究重要诊断技术,但难以大规模推广使用,原因主要为:(1)一些病毒形态不易区分,如羊痘病毒属病毒与正痘病毒,需要专业的实验仪器以及专业受训的实验人员进行鉴定;(2)部分病毒暂无分离培养体系如BNoV、BNeV等[6];(3)实验材料要求较高。
2.2 血清学诊断
血清学诊断主要针对病毒的抗原、遗传物质以及病原体诱导产生的抗体进行检测。现有多种牛新发病毒的血清学检测技术,如补体结合试验(complement fixation test,CFT)、血清中和试验(serum neutralization test,SNT)、病毒中和试验(virus neutralization test,VNT)等。IDV表面糖蛋白能与鸡红细胞发生凝集作用,多采用血凝(HA)、血凝抑制试验(HAHI)进行血清学诊断[17],除此以外主要采用ELISA法对牛新发病毒进行检测。2013年,欧洲SBV参考实验室利用法国ID-VET研发基于SBV重组N蛋白的间接ELISA试剂盒检测多种反刍动物阳性血清,与VNT检测结果进行对比,验证ELISA试剂盒检测效果。结果显示,两者检测结果的符合率达98.9%,ELISA试剂盒敏感度、特异性分别可达97.2%和99.8%[28]。2021年,Wernike K等[29]针对辛波血清群病毒(Simbu serogroup)Gc蛋白,建立了一种新型、高特异性的用于区分SBV、舒尼病毒、阿卡斑病毒抗体的三重ELISA检测方法。该方法对SBV的诊断特异性和敏感性分别可达84.56%和89.08%,可用于疑似群体的血清学筛查。
此前有学者建立了分别检测BToV抗体和抗原的竞争ELISA和双抗体夹心ELISA法。但因存在BToV抗原制备、分离纯化困难等问题,两者未被广泛应用。现阶段主要利用分子生物学检测技术对BToV进行诊断。
2.3 传统分子生物学诊断
2.3.1 基于(RT-)PCR的分子检测技术 针对BNoV、BoAstV和BToV混合感染导致犊牛腹泻的情况,师志海等[31]建立了可同时检测该3种病毒的多重PCR检测方法。该方法可同时检出样本中的3种病毒,结果与单一PCR结果一致。针对外来疫病,赵文华等[32]分别建立了同时检测SBV、小反刍兽疫病毒和裂谷热病毒的三重RT-PCR和实时荧光定量RT-PCR方法。前者检测敏感度可达103copies/μL,后者检测敏感度均低于102.33copies/μL。两种方法均可特异地对3种病毒进行同步快速检测。
相较于竞争性PCR、半定量RT-PCR等传统的mRNA定量方法技术,朱彤等[33]建立的BEV SYBR Green I实时荧光定量RT-PCR检测法操作更简便、高效,还具有更高的敏感度和特异性。该方法无需探针,与TaqMan荧光定量RT-PCR法相比,更具成本优势,更适于临床样本检测。
崔雨晨等[36]针对BNeV建立的iiRT-PCR法的最低检测限为5.38 copies/μL,临床样本中BNeV的平均检出率(64.36%)高于SYBR Green荧光定量RT-PCR法(46.53%)、TB Green荧光定量法(61.39%)、套式RT-PCR法(18.81%)。该方法不但适用于实验室检测BNeV,配合相应工具还可在现场检测BNeV,获得检测结果仅需1 h[36]。
2.3.2 等温扩增技术 等温扩增技术是一种能在恒定温度下进行体外核酸扩增的新型技术。王志成[34]先后建立了BEV LAMP、RPA两种检测法,检测敏感度均显著高于常规PCR检测方法,分别可达1×103copies/μL、1×102copies/μL。这两种方法可以通过体系反应前后的颜色变化肉眼判断结果,适用于现场快速诊断。针对难以明确SBV患畜病毒血症时间,病毒分离受到限制的问题,陈轩等[35]首次建立了检测SBV的RT-LAMP法,敏感度达到1.33×102copies/μL。该方法快速简便,对实验设备要求低,利用恒温水浴锅1 h即可完成检测,适用于进出境口岸、养殖场等具有简易设备的基层单位。
但当动物感染某些病毒如SBV后出现病毒血症时间短[12],在评估病毒流行率时,抗体检测比抗原检测更为有用,此时更适合采用血清学检测技术进行诊断。
2.4 病毒宏基因组学技术
病毒宏基因组学是以待测样本中存在的病毒群体为研究对象,基于高通量基因测序技术来研究环境样本中病毒组成。现已被成功应用于临床样本新型病毒挖掘、传染病流行病学调查。通过对患畜血液、粪便等样本进行宏基因组测序分析,研究人员现已成功发现SBV、BooV等新发病毒[10,16]。将宏基因组测序分析结果与原位杂交等后续试验结果相结合,即可获知多种牛新发病毒的生物学特性,例如牛呼吸道疾病综合征的致病因子包括IDV,并常与牛腺病毒和牛细小病毒混合感染犊牛[7];BoAstV PE3373/2019/Italy为嗜神经性毒株,可导致奶牛出现神经症状,患畜脑干、三叉神经发炎,大脑和神经节中有大量的神经元坏死[37]。与其他技术相比,该技术可详细描述生物样本内病毒组成和功能,获取完整的微生物群落信息。但也存在基因组扩增后获取的病毒组信息有偏差、数据处理分析工作繁重以及成本相对昂贵等缺点。
3 结语与展望
目前,多数牛病毒性新发传染病危害大且尚无有效疫苗防控,因此针对牛新发病毒建立高效诊断技术、开展流行病学调查、查明病毒遗传变异规律对新发传染病的防控尤为重要。同时,建立敏感、快速的病毒检测技术,满足当下自动化、精密化、多元化的疫病防控需求是开展牛新发病毒性传染病的关键。如整合激光技术、数字信号处理、传统化学技术等的液相芯片技术不仅适用于微量样品的检测,还可同时对多种病原体进行检测。现已利用该技术建立了可同时检测牛多瘤病毒、牛细小病毒、蓝舌病毒等6种病毒的液相芯片检测方法[38]。近年来,基于CRISPR/Cas(clustered regularly interspaced short palindromic repeats/CRISPR-associate)基因编辑技术的分子诊断技术展现出良好的应用前景,将RPA与Cas13a系统结合可实现对病毒核酸高敏感度、高特异性的检测[39],将PCR技术与Cas12a结合的核酸检测系统可区分病毒株、进行基因分型[40]。今后,上述新型诊断技术有望在牛新发病毒性传染病诊断中发挥重要作用。
